磷脂酰肌醇3-激酶/蛋白激酶B信号通路对放射性肠炎作用及机制研究
肖亚男, 张 丹, 于 丽, 吴佳蔓, 耿 晓, 巩 阳
北部战区总医院 中医科,辽宁 沈阳 110016
腹部和盆腔经辐射后引起的放射性肠炎是临床中常见问题之一,其临床表现通常包括腹痛、腹泻、血便、败血症、全身炎症和多器官功能障碍综合征等[1-3]。目前,临床治疗放射性肠炎以手术、对症治疗及营养支持疗法为主,但远期效果并不理想[4]。随着国内外对放射性肠炎广泛深入的研究,迫切需要建立适合临床研究的放射性肠炎动物模型。有研究报道,磷脂酰肌醇-3 激酶(phosphatidyl inositol 3-kinase,PI3K)可通过调控蛋白激酶B(protein kinase B,AKT)进而调节细胞因子介导的中性粒细胞存活,并进一步调节促炎因子白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的分泌[5]。本研究旨在探讨PI3K/AKT信号通路对放射性肠炎的作用及机制。现报道如下。
1 材料与方法
1.1 实验动物及分组 30只健康雄性SD大鼠(6~7周龄,体质量180~200 g)购自辽宁长生生物技术股份有限公司。大鼠饲养于北部战区总医院实验动物房,实验室温度为 20℃~24℃,相对湿度为45%~65%,自由饮食饮水。将30只雄性SD大鼠随机分为0 Gy组、10 Gy组、13 Gy组、16 Gy组、18 Gy组,每组各6只。所有实验操作和实验方案经北部战区总医院动物伦理委员会审批通过。
1.2 试剂及仪器 TB Green Premix Ex Taq试剂盒,TaKaRa;雅酶一步法PAGE凝胶快速制备试剂盒(6%、10%,上海雅酶生物医药科技有限公司);AKT抗体、PI3K抗体(Cell Signaling Technology)、Anti-GAPDH抗体(Sigma-Aldrich)。Rayto RT-6100酶标分析仪(深圳雷度生命科学股份有限公司);Thermo NanoDrop2000分光光度计(美国Thermo Fisher公司);ABI 7500型荧光定量PCR仪(美国Thermo Fisher公司);医用直线加速器(医科达Infinity,北部战区总医院放疗科提供)。
1.3 照射方法 10 Gy组、13 Gy组、16 Gy组、18 Gy组大鼠均给予10%水合氯醛3 ml/kg腹腔注射麻醉。待大鼠肌肉完全松弛后,以仰卧固定,6MV-X射线单次大剂量给予腹盆照射,照射范围上界胸骨剑突下、下界耻骨联合,周围不用铅块遮挡,源皮距100 cm,吸收剂量率290 cGy/min。
1.4 疾病活动指数 自照射后第1天起,每天观察各组大鼠的一般征象,自主活动等情况。依据疾病活动指数(disease activity index,DAI)评分标准计算各组大鼠DAI评分[5]。DAI评分越高,表示疾病活动越剧烈,炎症反应越重。
1.5 苏木精-伊红染色法 照射后第4、14天,将各组大鼠麻醉开腹,以肛门到盲肠为标志点切取肠组织,生理盐水冲洗,以4%多聚甲醛溶液固定,肠组织脱水,石蜡包埋、切片,进行苏木精-伊红染色法(hematoxylin-eosin,HE)染色。显微镜下观察大鼠肠黏膜组织病理变化,并进行病理评分[6]。评分标准:0 级,正常的直肠黏膜;1 级,很轻微损伤,切片中<10%视野炎性细胞浸润,黏膜极少量破坏,直肠腺体大体完整,无血管急性充血反应;2 级,轻微损伤,切片中约10%组织炎性细胞浸润,黏膜坏死,无脱落,直肠腺体轻度破坏,无血管急性充血反应;3级,中度损伤,有明显的直肠上皮丢失,切片中约10%~20%视野炎性细胞浸润,黏膜坏死,有脱落,直肠部分腺体脱落,可见血管急性充血反应;4级,严重损伤,出现溃疡或坏死,切片中>20%视野炎性细胞浸润,黏膜坏死,脱落明显,直肠腺体脱落,血管急性充血反应较多。病理评分越高,表示肠组织炎症反应越重。
1.6 实时荧光定量PCR检测 取各组大鼠肠组织液氮处理,采用Trizol法提取总RNA,反转录试剂盒将2 μg总RNA反转录为cDNA。利用TB Green Premix Ex Taq试剂盒进行实时荧光定量PCR检测,IL-6、TNF-α、IL-1β、内参β-actin引物由金斯瑞生物科技有限公司合成。引物序列如下:IL-6,正向5′-TTCACAGAGGATACCACCCACA-3′,反向5′-CAGTGCATCATCGCTGTTCATAC-3′;TNF-α,正向5′-GCGTGTTCATCCGTTCTCTACC-3′,反向5′-AGAGCCACAATTCCCTTTCTAAGTT- 3′;IL-1β,正向5′-GACAAGCAACGACAAAATCCCT-3′,反向5-GGAACTGTGCAGACTCAAACTCC-3;内参β-actin,正向5′-CGTTGACATCCGTAAAGACCTCTA-3′,反向5′-GAGCCACCAATCCACACAGAGTA-3′。
1.7 蛋白质印迹法 取80 mg肠黏膜组织,提取总蛋白,采用蛋白浓度测定试剂盒进行蛋白定量,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离目的蛋白,转膜,室温下封闭2 h,分别加入PI3K一抗(1∶500稀释)、AKT一抗(1∶1 000稀释)、GAPDH一抗(1∶3 000稀释),以4℃孵育过夜。再加入辣根过氧化物酶标记二抗(1∶20 000稀释),室温孵育2 h,浸入电化学发光液,使用Chemidoc成像系统进行扫描拍照,应用ImageJ软件分析蛋白条带灰度值,使用GAPDH做为内参,统计得出各组大鼠的蛋白表达量。

2 结果
2.1 各组大鼠一般情况及DAI评分比较 0 Gy组大鼠进食、饮水量及排便情况均正常,反应灵敏,皮毛光洁;10 Gy组大鼠自照射后第3天体质量下降,大便呈黄色,喜静,皮毛欠光洁;13 Gy组大鼠摄食饮水量明显减少,自照射后第1天体质量下降,出现稀便血便,反应迟缓,皮毛光洁度差;16 Gy组与18 Gy组大鼠自照射后第1天起体质量下降,出现拒食拒水,毛发枯槁,蜷缩少动,腹泻,水样便脓血便。照射后第4天,16 Gy组大鼠死亡3只,18 Gy组大鼠全部死亡,其余各组未出现因照射死亡。与0 Gy组比较,10、13、16和18 Gy组大鼠肠组织长度呈不同程度缩短,缩短程度与照射剂量呈正相关(P<0.000 1)。见图1。10、13、16和18 Gy 组大鼠照射后第4天的DAI评分均高于0 Gy组,差异均有统计学意义(P<0.05)。13、16和 18 Gy组大鼠照射后第4天的DAI评分均高于10 Gy组,差异均有统计学意义(P<0.05)。见图2。

图2 各组大鼠DAI评分比较(a.照射后第4天;b.照射后第14天)
2.2 各组大鼠病理组织学变化比较 HE染色结果显示,照射后第4天,0 Gy组大鼠肠黏膜单层柱状上皮、黏膜肌层和固有层结构完整;10 Gy组大鼠可见轻度隐窝受损,黏膜下少量炎细胞浸润,为轻度炎症表现;13 Gy组大鼠全层变性、坏死,黏膜层坏死、脱落,大量炎性细胞浸润;16、18 Gy组大鼠炎症过重,黏膜层结构部分完全消失,腺体重度损伤。照射后第14天,0 Gy组黏膜上皮完整,排列整齐未见异常;10 Gy组隐窝、腺体结构基本完整,仅可见黏膜组织轻微水肿;13 Gy组腺体萎缩,黏膜下水肿及炎性细胞浸润。见图3。10、13、16和18 Gy组大鼠照射后第4天的病理学评分均高于0 Gy组,差异均有统计学意义(P<0.05);13、16和18 Gy组大鼠照射后第4天的病理学评分均高于10 Gy组,差异均有统计学意义(P<0.05)。10、13 Gy组大鼠照射后第14天的病理学评分均高于0 Gy组,差异均有统计学意义(P<0.05);13 Gy组大鼠照射后第14天的病理学评分高于10 Gy组,差异有统计学意义(P<0.05)。见图4。

图3 各组大鼠肠组织病理学变化比较(a.照射后第4天;b.照射后第14天;HE×200)
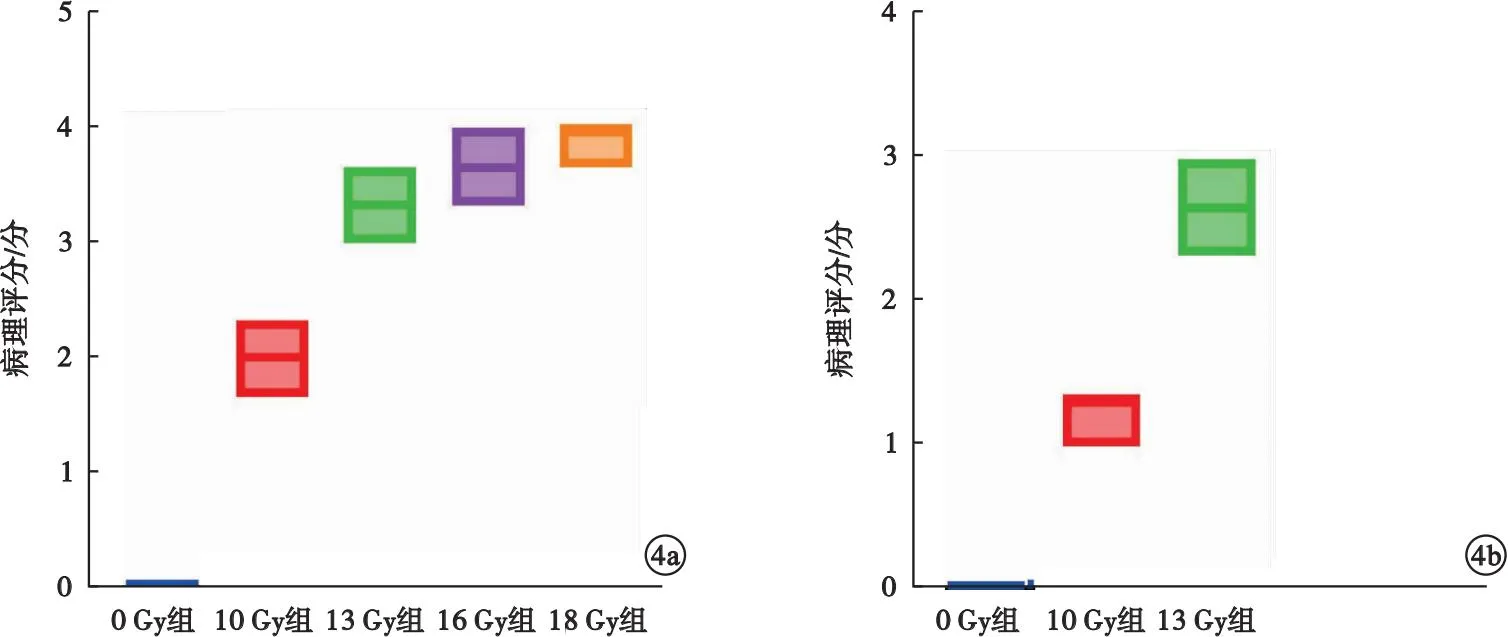
图4 各组大鼠病理学评分比较(a.照射后第4天;b.照射后第14天)
2.3 各组大鼠肠黏膜IL-6、TNF-α、IL-1βmRNA表达比较 10、13和16 Gy组照射后第4天大鼠肠黏膜IL-6、TNF-α、IL-1β mRNA表达均高于0 Gy组,差异均有统计学意义(P<0.05);13、16 Gy组大鼠照射后第4天大鼠肠黏膜IL-6、TNF-α、IL-1βmRNA表达均高于10 Gy组,差异均有统计学意义(P<0.05)。10、13 Gy组大鼠照射后第14天肠黏膜IL-6、TNF-α、IL-1βmRNA表达均高于0 Gy组,差异均有统计学意义(P<0.05);13 Gy组大鼠照射后第14天肠黏膜IL-6、TNF-α、IL-1βmRNA表达均高于10 Gy组,差异均有统计学意义(P<0.05)。见图5。

图5 各组大鼠肠黏膜IL-6、TNF-α、IL-1βmRNA表达比较(a.照射后第4天;b.照射后第14天)
2.4 各组大鼠肠黏膜组织PI3K/AKT通路相关蛋白表达水平比较 10、13和16 Gy组大鼠照射后第4天肠黏膜PI3K、AKT蛋白相对表达量均高于0 Gy组,差异均有统计学意义(P<0.05);13、16 Gy组大鼠照射后第4天肠黏膜PI3K、AKT蛋白相对表达量均高于10 Gy组,差异均有统计学意义(P<0.05)。10、13 Gy组大鼠照射后第14天肠黏膜PI3K、AKT蛋白相对表达量均高于0 Gy组,差异均有统计学意义(P<0.05);13 Gy组大鼠照射后第14天肠黏膜PI3K、AKT蛋白相对表达量高于10 Gy组,差异均有统计学意义(P<0.05)。见图6。

图6 各组肠组织蛋白表达水平比较(a.照射后第4天;b.照射后第14天)
3 讨论
PI3K/AKT信号通路是细胞内重要的信号传导通路之一[7]。有研究报道,PI3K/AKT通路在多种疾病中对细胞的存活、凋亡和转移过程中起到关键的调控作用[8-11]。有研究报道,PI3K/AKT信号通路参与放射性肠炎的发生[12]。PI3K具有第二信使作用,多种生长因子和信号传导复合物均能启动PI3K的激活过程,最终磷酸化AKT[13-14]。AKT磷酸化可导致核因子-κB活化,活化后的核因子-κB异位入核,促进细胞转录基因编码大量炎症反应蛋白(IL-6、TNF-α、IL-1β),进而诱导单核细胞、巨噬细胞和血管内皮细胞产生炎性细胞浸润,分泌产生炎性因子和炎症递质,促进趋化中性粒细胞等炎性细胞进入肠道病变部位,引起一系列组织破坏[15-20]。
本研究结果显示:与0 Gy组比较,10 Gy组大鼠相应表型不明显;13 Gy组大鼠DAI及病理评分均升高,且病理损伤程度符合放射性肠炎的病理变化;16、18 Gy组大鼠病理损伤过重,大量死亡,难以开展进一步的观察研究。这提示,X线造成肠上皮细胞损伤,炎性细胞浸润,肠组织结构破坏,其中存活数量最多的大鼠中13 Gy组放射剂量最大,为该实验最佳放射剂量。本研究结果还显示,各组大鼠的肠黏膜组织PI3K、AKT蛋白相对表达量均高于0 Gy组,IL-6、TNF-α、IL-1βmRNA表达量均高于0 Gy组。
这提示,放射性肠炎发病机制可能为X线照射激活PI3K/AKT通路,促使IL-6、TNF-α、IL-1β表达上调,致使肠道炎症出现。本研究结果显示,除0 Gy组外,照射后第4天其他照射组大鼠的肠组织缩短程度、DAI及病理评分均高于第14天;第4天较第14天各指标表达量升高更加显著。这提示,照射后第4天大鼠的症状最重,第14天已出现自愈,因此该方法建立的放射性肠炎大鼠模型最佳造模时间为7~10 d。
综上所述,直线加速器单次腹盆腔局部照射13 Gy能在保证大鼠存活率的前提下最大程度增加对肠组织的损伤,成功诱导大鼠放射性肠炎,可作为最佳照射剂量,且其发病机制可能与PI3K/AKT信号通路有关。

