新型促排剂NBED对铀的促排效果及机制
张梦丹,周文华,龚佳格,李鹏,高洁,李建国
(1.山西中医药大学中药与食品工程学院,山西 晋中 030619;2.中国辐射防护研究院/药物毒理与放射损伤药物山西省重点实验室/中核放射毒理与放射性药物临床前评价重点实验室,山西 太原 030006)
铀(uranium,U)存在于岩石、土壤及水、食物和空气中,是天然存在的重要放射性锕系元素。近年来,大量天然铀经提炼浓缩成富集铀作为核工业中的重要核燃料,也被用于纺织业和制造业等其他领域[1]。自然界中,铀有+3,+4,+5 和+6 共4 种价态,其中难溶性的四价态和易溶性的六价态化合物较为稳定[2]。铀主要通过皮肤接触、呼吸和饮食等途径进入人体[3]。铀会迅速转移到血液中,以UO22+的形式与血液中的柠檬酸盐、碳酸氢盐和蛋白质形成络合物[4-5],经过血液循环通过肾小球过滤,结合在近端小管上皮部位导致近端小管损伤和肾功能衰竭[6-7]。随着时间延长,铀会大量附着于骨,影响骨的正常代谢和功能[8]。目前螯合疗法被认为是减少铀等锕系元素内污染的最有效的方法之一,而临床除1.4%碳酸氢钠可用外,仅有美国FDA 批准的二乙胺五乙酸盐用于铀促排,但其与铀酰的螯合物存在体内不稳定及无法进入细胞等问题,促排效果均不理想[3,9]。因此,寻找高效、低毒的铀促排剂一直是研究者努力的目标。由中国辐射防护研究院自主设计合成的邻苯二酚类促排剂N1,N2-双(2,3-二羟基-4,6-二磺酸苄基)亚乙基二胺钠盐〔N1,N2-bis(2,3-dihydroxy-4,6-disulfonic acid benzyl)ethylenediamine sodium salt,NBED〕对钚、铜和铅等具有较好的促排效果[10]。前期研究表明,ICR 小鼠ig 给予NBED能显著降低肾和骨内铀含量[11]。本研究将从动物水平进一步研究iv给予NBED对铀的促排效果,并从热力学水平探讨NBED促排铀的机制。
1 材料与方法
1.1 药物、主要试剂和仪器
NBED 由中国辐射防护研究院合成,相对分子质量为712.52,为黄色粉末,相对纯度为95%(用蒸馏水稀释);二乙烯三胺五乙酸钙钠盐(DTPACaNa3,批号:20190-605)由军事医学研究院辐射医学研究所赠送;醋酸铀酰〔C4H6O6U(H2O)2,批号:U3873101B〕(用蒸馏水稀释),上海吉至生化科技有限公司;硝酸(优级纯,批号:20200911),国药集团化学试剂有限公司;H2O2(分析纯,批号:20200531),天津欧博凯化工有限公司;KCl(分析纯,批号:20180502)和KOH(分析纯,批号:20170327),天津市风船化学试剂科技有限公司;HCl(分析纯,批号:100620200602),湖南尔康制药股份有限公司;超纯水,Milli-Q超纯水处理系统制备。
Milli-Q型超纯水处理系统,美国Millipore公司;ZDJ-5B 型全自动电位滴定仪,上海仪电科学仪器股份有限公司;NexION-5000型电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)仪,英国Perkin Elmer 公司;BSA124S 电子天平,赛多利斯科学仪器北京有限公司。
1.2 动物、分组和给药
48 只SPF 级ICR 雄性小鼠,体重18~22 g,购自北京维通利华实验动物技术有限公司,质量合格证号:110011210106756516,实验动物许可证号:SCXK(京)2016-0006。所有小鼠均饲养于中国辐射防护研究院药物安全评价中心SPF 级动物房内,小鼠自由摄食、饮水。本实验所用动物及相关处置符合动物福利的要求,且在实验开展前通过中国辐射防护研究院实验动物管理和使用伦理委员会批准。
据随机数字表将小鼠随机分为6 组:正常对照组、铀染毒组、铀染毒+DTPA-CaNa3150 mg·kg-1组(剂量与临床剂量相当,配体/铀摩尔比158∶1)、铀染毒+NBED 45,90和180 mg·kg-1组(配体/铀摩尔比分别为26∶1,52∶1 和104∶1)。所有小鼠均于实验前适应性喂养7 d。禁食过夜后,于第8 天开始实验。除正常对照组外,其余各组每只小鼠尾静脉iv 给予醋酸铀酰〔相当于U(Ⅵ)0.03 mg〕[11],随后立即尾静脉iv给予相应药物;正常对照组iv给予生理盐水。给药2 h后,小鼠可摄食、饮水。
1.3 lCP-MS测定小鼠组织中铀含量
给药24 h 后,脱臼处死小鼠,取两肾、股骨、脾、肝和股骨外侧肌肉,于80 ℃恒温干燥至恒重;研磨均匀后,分别取0.02 g于烧杯中(因肝、脾和肌肉中铀蓄积量较少,将三者合并为一组样本处理),加入硝酸5 mL,于电加热板150 ℃下消解至澄清;加入1 mL H2O2继续消解至无色透明。当溶液剩0.5~1.0 mL时停止加热,经稀硝酸0.5 mol·L-1稀释后,采用ICP-MS法[1]测定肾、股骨和肝+脾+肌肉中的铀含量(以每克干组织计)。ICP测定条件为:射频入射功率为1600 W,雾化气流速为1.03 L·min-1,辅助气流速为1.3 L·min-1,等离子气流速为16.25 L·min-1,溶液稳定时间为50 s。每种样品平行测定3次。
1.4 电位滴定法测定不同pH 条件下NBED 的解离常数
取71.2 mg NBED(0.1 mmol)加入电位滴定仪样品池中,用移液管取0.1 mol·L-1KCl 溶液25 mL加入样品池中并不断搅拌,待NBED 溶解后滴加0.1 mol·L-1HCl 溶液2 mL。利用动态滴定模式滴定,即根据所测电动势的变化决定加入KOH溶液的体积,共滴加4 mL KOH 溶液后停止实验。得到1 组滴加体积与相应电动势的数据,用Hyperquad 2013 软件拟合得到累积形成常数lgβ0lh[12]值,并根据式①~⑤计算得到NBED 的解离常数pKas[12]。实验平行进行3次,取平均值。
式中,n为NBED 数,S为配体NBED(表示为L)结合的H+数,K为平衡常数,β为累积形成常数。
1.5 电位滴定法测定NBED与铀酰的络合常数
取14.24 mg NBED(20 μmol·L-1)和4.24 mg醋酸铀酰(10 μmol·L-1)加入样品池中,用移液管取25 mL 0.1 mol·L-1KCl 加入样品池中搅拌至溶解后,手动控制加入2 mL 0.1 mol·L-1HCl 溶液。后续同1.4 处理,根据式⑥~⑦计算得到NBED 与铀酰的络合常数[12]。实验平行进行3 次,取平均值。然后,基于计算结果利用Hyss 软件得到不同pH 条件下UO22+配体不同络合形式的分布曲线图。
式中,m,l和n分别为溶液中UO22+,NBED和H+比率。
1.6 统计学分析
2 结果
2.1 NBED降低铀染毒小鼠组织中铀含量
表1 结果表明,与铀染毒组相比,DTPA-CaNa3(150 mg·kg-1)及各剂量NBED均可显著降低肾内铀含量(P<0.01),且NBED 180 mg·kg-1效果最佳;DTPA-CaNa3150 mg·kg-1(P<0.05)和NBED 90,180 mg·kg-1(P<0.01)显著降低骨铀含量,NBED 45 mg·kg-1无明显作用;DTPA-CaNa3和NBED 180 mg·kg-1显著降低肝+脾+肌肉内铀含量(P<0.01),其余剂量NBED 无明显作用;与阳性对照相比,铀染毒+NBED 180 mg·kg-1组肾、骨、肝+脾+肌肉铀含量显著降低(P<0.05,P<0.01)。
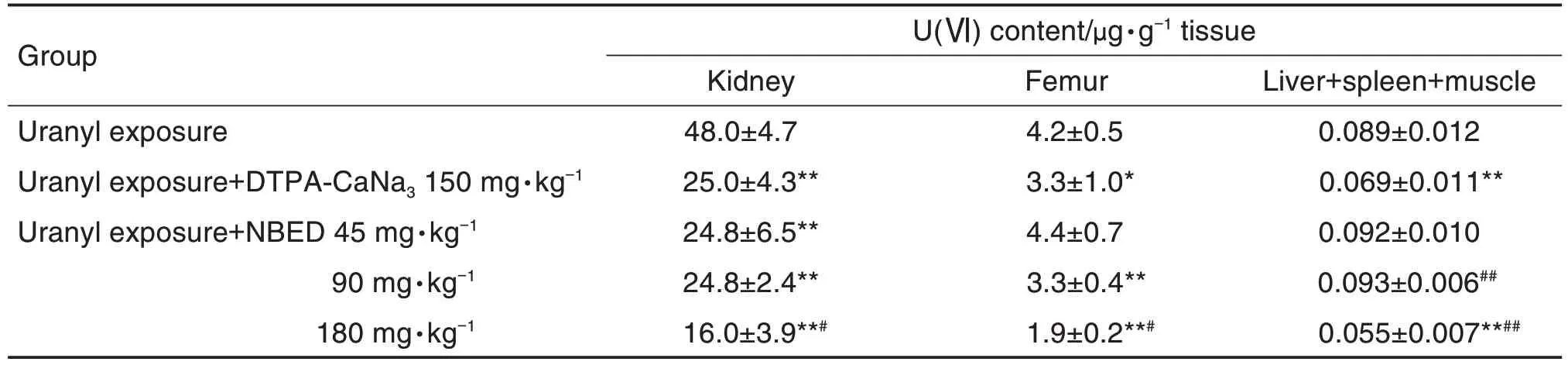
Tab.1 Efficacy of uranium removal from mice by N1,N2-bis(2,3-dihydroxy-4,6-disulfonic acid benzyl)ethylenediamine sodium salt(NBED)
2.2 不同pH条件下NBED的解离常数
NBED 的解离常数pKas,pKa1,pKa2,pKa3,pKa4,pKa5和pKa6分别为10.09,9.68,9.70,8.21,7.26 和4.84。表明NBED 在pH 10.09 时达到解离平衡;在低pH 条件下会被质子化,pH 4.84 时达到质子化平衡。由图1 可知,在生理pH 条件下(pH 7.4),约有22.3% LH5(L 表示配体NBED),59.8% LH4和17.85% LH3存在于0.1 mol·L-1KCl 溶液中,LH4为主要存在形式。表明在生理环境下,NBED 主要进行二级解离。
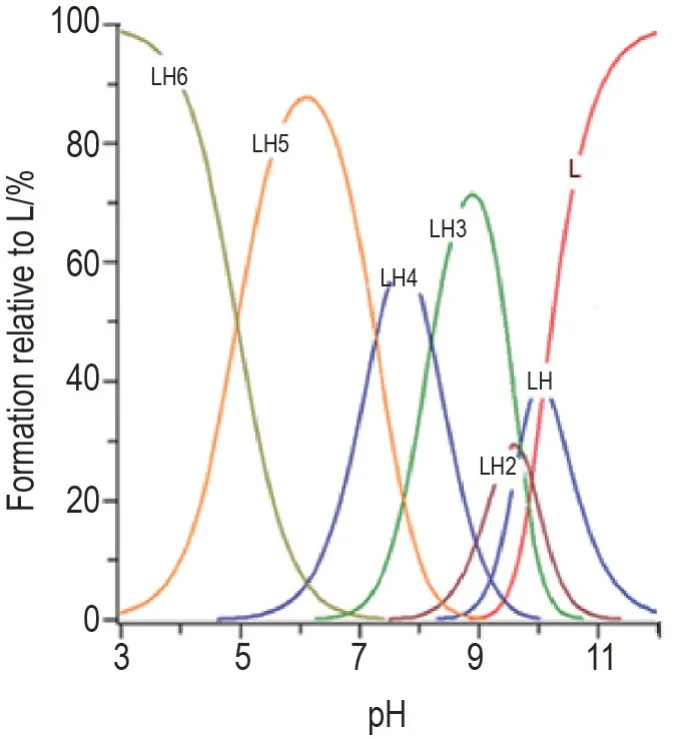
Fig.1 Species distribution of NBED at different pH determined by potentiometric titration.The solution contains 1×10-3 mol·L-1 NBED.L:deprotonated NBED ligand.
2.3 NBED与铀酰的络合常数
由图2 可知,在pH 为3~11 范围内,NBED 与铀酰络合物存在4 种形式,分别是logβ111(12.5)和logβ101(9.8),logβ102(15.3),logβ1-12(6.5)。在pH 7.4时,该体系下溶液中游离铀酰离子浓度为2.693×10-10mol·L-1,pUO2为9.57;大约有75.3%(UO2)L22-,21.7%(UO2)L 和2.956%(UO2)L2H-13-存在于0.1 mol·L-1KCl溶液中。表明NBED对铀酰具有较强的亲和力,且在人体生理环境下主要以2∶1的形式形成(UO2)L22-复合物,并排出体外。
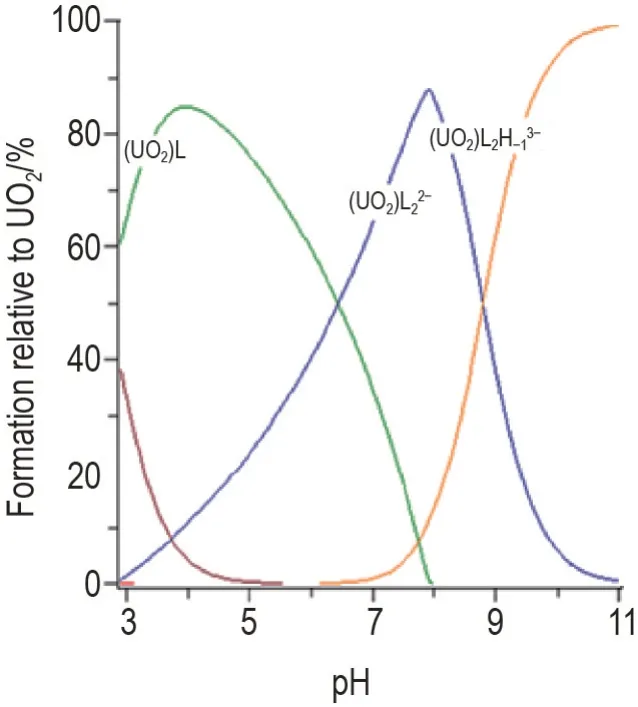
Fig.2 Species distribution of UO22+/NBED systems at different pH determined by potentiometric titration.The solution contains 1×10-4 mol·L-1 UO22+and 1×10-3 mol·L-1 NBED.
3 讨论
本研究结果表明,NBED可显著降低肾、骨、肝、脾和肌肉内铀蓄积量,且优于DTPA-CaNa3。以NBED 口服剂量300 mg·kg-1折算得静脉给药剂量为180 mg·kg-1,该剂量NBED 能分别减少肾、骨、肝+脾+肌肉中66.5%,54.8%,38.2%的铀蓄积量,促排效果优于口服给药,ICR 小鼠ig 给予NBED 300 mg·kg-1可使肾和骨内铀含量分别降低44.3%和18.8%[11]。DTPA-CaNa3临床折算剂量为150 mg·kg-1,其促排效果与NBED 90 mg·kg-1相当。连有磺酸基的邻苯二酚类促排剂(CAMS)被认为是对骨铀促排最有效的配体[13]。Durbin 等[13]筛选出的对铀有较好促排效果的CAMS 类促排剂5-LICAM(S),当配体/铀摩尔比为91∶1 时,立即ip给药,24 h可显著降低肾铀62%、骨铀49%。HOPO类配体是目前报道的促排铀效果最强的一类化合物,其中5-LI-1-Cm-3,2-HOPO(配体/铀摩尔比92∶1)立即ip 给药后,24h 可显著降低肾铀82.7%、骨铀39.0%[13]。表明NBED是较佳的骨铀促排剂。
铀的电子层构型是[Rn]5f36d17s2,因5f 和6d杂化轨道的影响,U与O形成双键,使其具有较强的惰性[14]。因此,螯合剂只能从空间位阻最小的赤道平面提供电子进入5f 和6d 的空轨道进行配位[15]。UO22+可以与O,N,S,I 等多种原子配位,但本质上属于硬酸,更容易与O 配位,如羧基、羟基、磷酸基等[16]。本研究所自主设计合成的NBED 是由线性氨基烷链连接2 个邻苯二酚结构单元组成,空间结构上提供的H和O原子可使NBED更好的与U(Ⅵ)配位。热力学水平研究NBED的解离常数和NBED与铀酰的络合常数发现,在生理条件下,NBED主要以LH5,LH4和LH3形式存在,其比例分别为22.3%,59.8%和17.85%,主要以失去2 个氢的LH4形式存在;在生理条件下,NBED 与铀主要有3 种络合形式,分别为75.3%(UO2)L22-,21.7%(UO2)L 和2.956%(UO2)L2H-13-,NBED 与铀酰主要以2∶1 螯合存在。即在生理条件下,2 个NBED 分子邻苯二酚上的酚羟基共失去4个氢原子,从而产生4个O原子占据铀酰的5f和6 d的空轨道进行配位。
综上所述,新型促排剂NBED 在体内主要以失去2 个氢的LH4 形式存在,与铀酰主要以2∶1 的螯合形式形成NBED-铀酰复合物排出体外,且NBED静脉给药能显著降低肾、骨、肝、脾和肌肉内铀含量,促排效果优于DTPA-CaNa3,与目前正在研究的其他促排药相比,对骨铀的促排效果更显著。由此可见,NBED是一种有前景的新型促排剂,对铀具有较好的促排效果。后续可基于其对骨较好的促排效果进行进一步机制和结构优化研究。

