信迪利单抗致孤立性ACTH缺乏症合并原发性甲状腺功能减退症1例
张高山,刘 彦,朱 华,张真稳,茅蕾蕾*
0 引言
近年来,免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)在肿瘤治疗领域取得突破性进展,其通过阻断T细胞表面的细胞毒性T淋巴细胞相关抗原4(Cytotoxic T lymphocyte-associated antigen-4,CTLA-4)或程序性细胞死亡蛋白-1(Programmed cell death protein-1,PD-1)/程序性死亡蛋白配体-1(Programmed cell death-ligand 1,PD-L1)信号通路,重新激活免疫细胞,特异性杀伤肿瘤细胞,发挥抗肿瘤作用[1]。然而,活化的免疫细胞发挥抗肿瘤效应的同时,其过度的免疫反应可导致机体自身免疫损伤,即免疫相关不良反应(Immune-related adverse effects,irAEs)[2]。irAEs可累及全身各个器官,内分泌系统是最常受累的器官之一,其中以甲状腺功能障碍和垂体炎最常发生,表现为甲状腺、垂体损伤引起的各种内分泌激素缺乏[3]。本文报道1例PD-1抑制剂导致的孤立性ACTH缺乏症(Isolated ACTH deficiency,IAD)合并原发性甲状腺功能减退症。孤立性 ACTH 缺乏症是垂体炎的一种亚型,其特征是继发性肾上腺皮质功能减退,皮质醇生成低或缺失,除ACTH以外的其他垂体激素分泌正常,无结构性垂体缺陷,是ICIs的一种罕见但可能致命的不良反应[4]。
1 病例资料
患者,男性,69岁,因“乏力纳差20余天”入院。2016年8月患者因食管鳞状细胞癌伴淋巴结转移行食管癌根治术,术后行多西他赛、顺铂、替吉奥联合化疗6周期。2018年12月因腹膜后淋巴结转移行淋巴结放疗DT50GY/25次;2018年12月3日至2019年7月18日,行替吉奥单药口服治疗9周。2019年7月30日复查示左锁骨上淋巴结和胸椎椎体转移。2019年8月13日至12月3日,行放疗联合伊立替康、奈达铂化疗。于2020年3月18日起,行信迪利单抗200 mg静滴d1+卡培他滨1.5 g 口服bid d1~14联合治疗,21 d为1个疗程。基线检查:游离三碘甲状原氨酸(FT3)3.01 pmol/L,游离甲状腺素(FT4)13.5 pmol/L,促甲状腺激素(TSH)2.57 μIU/ml;血Na+143 mmol/L。在第5疗程时,患者出现甲状腺功能异常,TSH 19 μIU/ml。第6疗程时,患者出现全身乏力、纳差。FT4 10.3 pmol/L,TSH 24 μIU/ml;血皮质醇(8∶00-16∶00-24∶00):6.62~8.24~8.04 nmol/L,肿瘤科予左甲状腺素75 μg qd口服治疗后出院。2020年7月24日(第6疗程间歇),患者因持续乏力纳差20余天,体重下降约1 kg,不伴头痛及视力障碍,就诊于内分泌科进一步治疗。患者既往无甲状腺、肾上腺及垂体相关病史,个人史、婚育史、家族史无特殊。入院体格检查:体温36.5 ℃,脉搏84次/min,呼吸20次/min,血压126/70 mmHg,体重指数19.1 kg/m2,神志清楚,精神萎靡,右胸壁见陈旧手术瘢痕,全身皮肤无色素沉着,甲状腺无肿大,心肺腹查体无异常。
实验室检查:血常规:红细胞2.59×1012/L,白细胞2.68×109/L,中性粒细胞比例63.5%,血红蛋白90 g/L,血小板133×109/L;生化检查:丙氨酸氨基转移酶4 U/L,天冬氨酸氨基转移酶14 U/L,肌酐59 μmol/L,葡萄糖4.49 mmol/L,Na+129.7 mmol/L,K+3.98 mmol/L;性激素:促黄体生成素(LH)24.4 IU/L(参考范围:1.7~8.6 IU/L,下同),促卵泡刺激素24.9 IU/L(1.65~12.4 IU/L),孕酮0.34 nmol/L(0.16~0.47 nmol/L),雌二醇148 pmol/L(28~158 pmol/L),睾酮20 nmol/L(成年男性:9.9~27.8 nmol/L),泌乳素(PRL)14.8 ng/ml(男性:4.04~15.2 ng/ml);甲状腺功能:TSH 5.92 μIU/ml(0.27~4.2 μIU/ml),FT4 11.4 pmol/L(12~22 pmol/L),FT3 3.67 pmol/L(3.1~6.8 pmol/L),抗甲状腺球蛋白抗体(TGAb)457 IU/ml(0~115 IU/ml),抗甲状腺过氧化物酶抗体(TPOAb)18.8 IU/ml(0~34 IU/ml),促甲状腺素受体抗体<0.8(0~1.75)IU/L;肾上腺皮质功能:8∶00血促肾上腺皮质激素(ACTH)0.5 pg/ml(上午8∶00-10∶00,6~40 pg/ml),16∶00皮质醇11 nmol/L(16∶00,64~327 nmol/L),24 h尿量1 800 ml,24 h尿游离皮质醇70.61 μg(30~350 μg),醛固酮(卧位)186.9 pg/ml(卧位:30~160 pg/ml),血管紧张素Ⅱ(卧位)58.24 pg/ml(卧位普食:28.2~52.2 pg/ml),肾素活性(卧位)2.08 μg/(L·h)[卧位普食:0.05~0.75 μg/(L·h)]。
影像学检查:垂体核磁共振成像(MRI):垂体变薄,高径约为3.5 mm,长径约2.3 mm,垂体信号欠均匀,垂体偏左侧见小片状长T2信号。垂体柄居中,鞍底无明显下陷,鞍隔无上抬。蝶鞍无明显扩大,视交叉、海绵窦形态、信号均未见明显异常,部分空蝶鞍。甲状腺彩超:甲状腺大小形态正常,表面光滑,包膜完整。全腹部CT:右侧肾上腺内侧支稍粗。
诊断及治疗:综合患者临床表现及信迪利单抗治疗前后实验室检查,诊断考虑继发性肾上腺皮质功能减退症、部分性垂体功能不全、原发性甲状腺功能减退症。予氢化可的松静脉滴注,左甲状腺素钠口服治疗,5 d后患者乏力、纳差明显好转,考虑出院。出院后激素替代方案为泼尼松每日上午8∶00 5 mg,下午4∶00 2.5 mg,左甲状腺素每日50 μg口服。
随诊情况:2020年10月12日,患者因自行停药20 d,乏力纳差症状加重再次入院治疗。入院时血压86/48 mmHg,精神萎靡,食欲差。予氢化可的松静脉滴注,左甲状腺素口服治疗。复查:上午8∶00 ACTH 2.24 pg/ml,TSH 28.9 mIU/L,FT4 6.72 pmol/L,FT3 2.05 pmol/L,Na+130.2 mmol/L。遂停免疫治疗,2020年10月19日,起化疗方案改为安罗替尼联合卡培他滨治疗。后续随访过程中患者肾上腺皮质功能及甲状腺功能始终偏低,ACTH 1.09~1.2 pg/ml,TSH 18.3~42 mIU/L,最后一次随访时间为2021年11月18日。
2 讨论
2.1 信迪利单抗不良反应关联性的评定 信迪利单抗为重组全人源IgG4 型抗PD-1 单克隆抗体,通过结合PD-1,阻断其与配体(PD-L1/PD-L2)之间相互作用介导的免疫抑制反应,增强免疫应答[5]。本例患者应用信迪利单抗后,出现肾上腺皮质功能减退、甲状腺功能减退,采用Naranjo′s评估量表评价不良反应因果关系[6],符合其中5条。①先前已有该反应报告:信迪利单抗说明书中明确有关于“甲状腺功能减退”“垂体炎”“ 肾上腺功能不全”的不良反应描述。②用药与不良反应存在时间先后顺序:患者免疫治疗前甲状腺功能正常,且根据血Na+、K+及血压水平正常,推测其肾上腺皮质功能正常。使用信迪利单抗5~6个疗程后,出现肾上腺皮质功能减退、甲状腺功能减退。③停药后不良反应较前减轻:患者首次内分泌科就诊时,ACTH 0.5 pg/ml,停药2个月后,ACTH 2.24 pg/ml,停药后ACTH水平较前恢复。④不良反应与合并用药、肿瘤转移无关:合并用药卡培他滨说明书及文献无相应不良反应记载[7];患者垂体MRI及甲状腺彩超结果可排除肿瘤转移、占位效应引起的垂体、甲状腺功能不全。⑤患者出现乏力、纳差的临床表现,实验室检查TSH 19 μIU/ml,ACTH(8∶00) 0.5 pg/ml,皮质醇(8∶00)11 nmol/L,均为不良反应的客观证据。综上,Naranjo关联性评价得分7分,可判定肾上腺皮质功能减退、甲状腺功能减退与信迪利单抗“很可能”相关(见表1)。
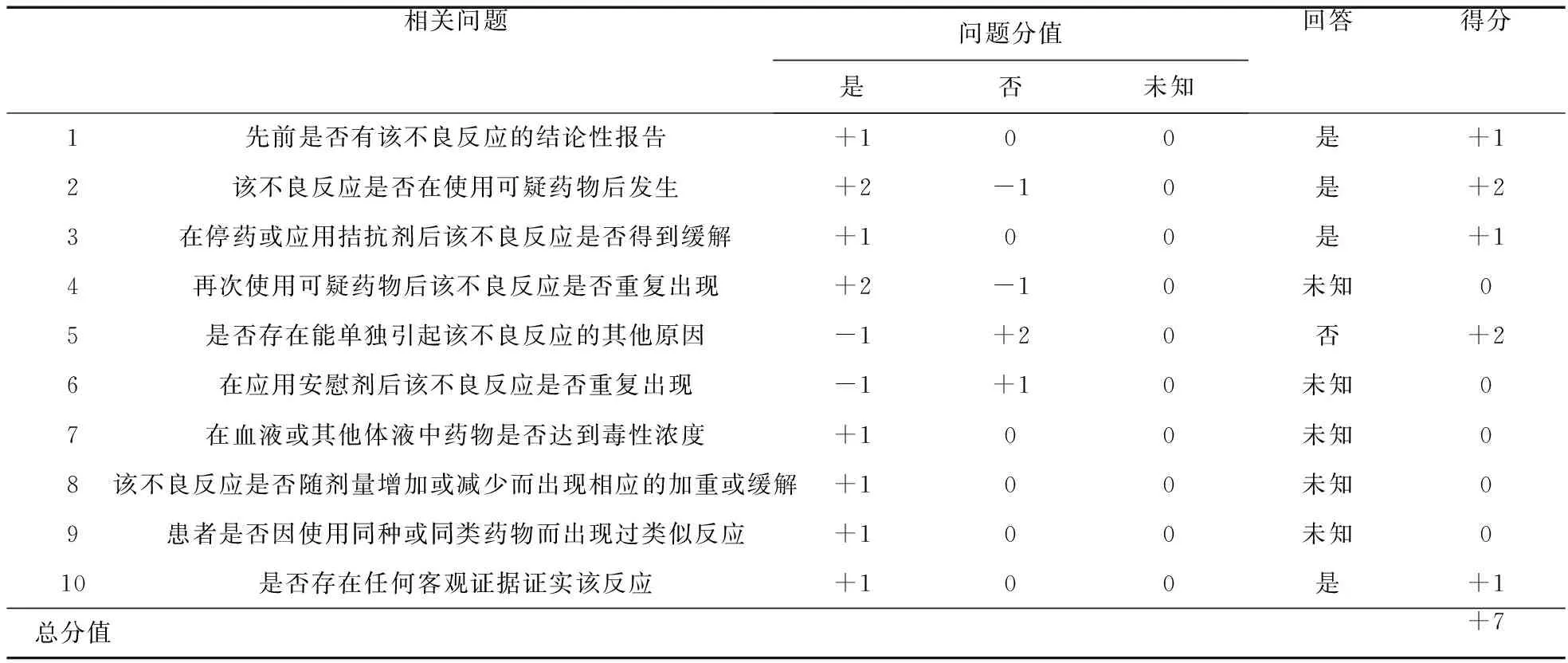
表1 Naranjo药物不良反应评估量表
2.2 继发性肾上腺垂体功能减退 PD-1 抑制剂引起肾上腺皮质功能减退分为原发性肾上腺皮质功能减退和继发性肾上腺皮质功能减退。原发性肾上腺皮质功能减退是由PD-1 抑制剂引起的肾上腺皮质自身免疫损伤,而继发性肾上腺皮质功能减退则是引起垂体损伤(垂体炎)导致ACTH分泌不足[8]。本例患者皮质醇与ACTH水平同时降低,继发性肾上腺功能减退诊断明确,是否合并原发性肾上腺皮质功能减退需行ACTH兴奋试验进行鉴别。由于缺乏诊断试剂不能直接判断,但依据患者醛固酮、血钾及血压水平正常,可间接排除原发性肾上腺皮质功能减退。因为原发性肾上腺皮质功能不全特有的临床表现是糖皮质激素和盐皮质激素均缺乏,而继发性肾上腺皮质功能减退仅有糖皮质激素缺乏表现[9]。因此,患者肾上腺皮质功能减退是由垂体病变引起,继发于垂体ACTH分泌不足。且本例患者仅表现为ACTH缺乏,LH、FSH、PRL未受影响,与Lin等[10]报道一致。国外报道PD-1/PD-L1抑制剂所致的垂体炎在临床上主要表现为垂体前叶功能减退,其中ACTH缺乏约占97%,FSH/LH缺乏占13%,TSH缺乏占4%[11],而PRL、生长激素异常以及垂体后叶功能受累较为罕见[12]。Levy等[13]的队列研究也证实这一观点,17例PD-1/PD-L1抑制剂引起的垂体炎患者全部表现为ACTH缺乏,2例合并TSH缺乏,3例合并促性腺激素(GnH)缺乏。由此可见,PD-1/PD-L1抑制剂引起的垂体损伤主要影响垂体ACTH分泌细胞,表现为孤立性ACTH缺乏症。然而,CTLA-4抑制剂诱导的垂体损伤几乎同时涉及ACTH、TSH、GnH分泌细胞[14]。此外,不同ICIs引起垂体炎的发生率各不相同,单药治疗时,CTLA-4抑制剂诱导垂体炎的发生率最高约为3.2%,PD-1抑制剂约为0.4%,PD-L1抑制剂则<0.1%[2]。CTLA-4抑制剂与PD-1抑制剂联合治疗时,垂体炎的发生风险显著增加,如:伊匹木单抗联合纳武利尤单抗时垂体炎发生率高达6.4%[15-16]。由此可见,使用ICIs治疗的患者,需警惕垂体炎的不良反应,尤其关注CTLA-4抑制剂治疗以及联合治疗的患者。
不同类别ICIs诱发的垂体炎具有不同的临床特征,提示CTLA-4与PD-1/PD-L1抑制剂介导的垂体损伤可能存在不同机制。CTLA-4抑制剂相关垂体毒性的病理机制可能与CTLA-4抗原在垂体内分泌细胞(主要为PRL和TSH分泌细胞)上异位表达相关[13]。在CTLA-4抑制剂相关垂体炎患者的垂体中观察到大量巨噬细胞、IgG2和补体C4d的表达,以及CD4+T细胞和CD20+B细胞浸润,提示CTLA-4抑制剂可诱发针对垂体的Ⅱ型超敏反应[17]。PD-1/PD-L1抑制剂引起垂体ACTH缺乏的发病机制尚不明确,一种假说基于脑垂体组织表达PD-1抗原,推测ACTH分泌细胞是PD-1表达水平最高的垂体细胞[14]。另一种假说认为PD-1/PD-L1诱导的孤立性ACTH缺乏可能与ACTH抗体有关[13,17]。这种机制类似于神经内分泌肺癌的副肿瘤综合征,肿瘤细胞异位表达ACTH,PD-1/PD-L1抑制剂引发对ACTH细胞的自身免疫,导致ACTH缺乏[18]。Fujita等[19]进一步支持了此观点,在58%的获得性孤立性ACTH缺乏症患者中,发现了抗ACTH抗体。总之,关于CTLA-4与PD-1/PD-L1抑制剂的生物学特性有待进一步研究。
2.3 原发性甲状腺功能减退 甲状腺功能异常是PD-1/PD-L1抑制剂治疗最常见的内分泌irAEs。根据美国纽约癌症数据中心报告,应用PD-1抑制剂后,甲状腺功能减退症的发生率约为5.9%[20]。原发性甲状腺功能减退表现为TSH升高及FT4或FT3下降;而腺垂体损伤引起的中枢性甲状腺功能减退表现为FT4或FT3下降,TSH正常或偏低。本例患者在抗PD-1治疗前,甲状腺功能正常,信迪利单抗治疗后,患者血清TSH水平升高,血清FT3、FT4水平降低,伴有明显乏力、疲劳,且口服左甲状腺素钠治疗后,症状缓解,根据《免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020)》,可确诊为信迪利单抗诱发的原发性甲状腺功能减退[2]。
PD-1/PD-L1抑制剂诱发的甲状腺损伤的发病机制可能同时涉及细胞免疫和体液免疫[21]。正常甲状腺组织表达PD-L1,应用PD-1抑制剂后产生的免疫应答导致甲状腺组织的破坏[22]。Kotwal等[23]通过甲状腺细针穿刺进行细胞学研究,结果显示,PD-1抑制剂诱发甲状腺炎患者甲状腺组织中,CD4+PD-1+T淋巴细胞和CD8+PD-1+T淋巴细胞增多。此外,PD-1抑制剂治疗后发生甲状腺功能减退的患者中,80%的患者甲状腺抗体(TGAb和/或TPOAb)检测阳性[24],表明PD-1抑制剂可调节体液免疫反应,产生甲状腺自身抗体,参与甲状腺损伤的发生。有报道,新发血清甲状腺球蛋白抗体(TGAb)与生存期延长有关[25],推测自身免疫抗体可能增加免疫毒性,同时也增加了抗肿瘤反应。
2.4 治疗与评估 根据美国国家癌症研究所颁布的不良反应通用术语标准(Common Terminology Criteria for Adverse Events,CTCAE)分级[26],患者肾上腺皮质功能减退为4级,甲状腺功能减退为3级。临床停用信迪利单抗,予静滴氢化可的松联合口服左甲状腺素替代治疗,患者症状缓解,出院后长期口服泼尼松和左甲状腺素。由于患者依从性差,服药不规律,患者替代治疗欠合理。对于该患者的激素替代治疗,临床药师建议根据患者自身感受(如体重、乏力的改善情况),结合临床(血压、血钠、心率、FT3、FT4等)评估替代治疗的合理性,以避免替代不足或替代过量。此外,临床药师更要做好患者宣教,告知患者治疗原发病的同时,应定期内分泌科门诊随访,规律用药,尤其在感染、手术、创伤等应激状况下及时就诊。
3 小结
孤立性ACTH缺乏症临床症状不典型,目前缺乏早期诊断的生物标志物。有学者提出,低血钠[27]、嗜酸性粒细胞增多[28]、低血糖[29]可作为孤立性ACTH缺乏症早期预警的潜在指标。采用ICIs治疗的患者如出现持续乏力伴低血钠、嗜酸性粒细胞增多或低血糖,应行肾上腺轴激素水平测定,以免漏诊而发展为肾上腺危象。
ICIs引起的垂体、甲状腺等内分泌腺体损伤多数为不可逆,需要终身治疗及随访。能否恰当地管理垂体、肾上腺及甲状腺损伤直接影响患者预后,因此,尽早诊断、及时监测并给予相应干预治疗尤为重要。发生内分泌系统irAEs后,肿瘤医师、内分泌医师及临床药师应提高警惕、加强合作、共同管理,加强患者教育、定期随诊,从而改善患者生存质量。

