STAT4在急性髓系白血病患者中的表达特征及其临床意义*
焦一帆, 王 昊, 刘宇辰, 谷振阳, 温亚男, 王莉莉, 窦立萍
中国人民解放军总医院第五医学中心血液病医学部,北京 100071
急性髓系白血病(acute myeloid leukemia,AML)是一种以髓系原始细胞克隆性增殖为主,具有高度异质性的血液系统恶性疾病[1-2]。AML是我国十大高发恶性肿瘤之一,其发病率在过去的几十年间持续上升[3-4],AML患者的生存期在各类急性白血病患者中最短,五年生存率不足30%[5-6]。“7+3”方案、异基因造血干细胞移植及针对相关基因突变和表观遗传学异常的分子靶向药物能够改善患者临床预后,延长患者的生存期,但AML发病机制的复杂性,使这种改善仍存在一定的局限性。因此寻找和发现新的AML分子靶点,加深对AML的认识,构建针对分子靶点的新疗法,对突破这一局限性,进一步提高患者治愈率、生存率有极大帮助。
JAK/STAT通路是由激酶Janus(Janus kinase)和信号转导和转录激活子STAT(signal transducer and activator of transcription)共同构成的信号通路,该通路中有用于传递抗凋亡、增殖和分化信号的受体,它们参与调节造血和造血干细胞的增殖、存活及自我更新[7-8]。此外,该通路的激活在多种癌细胞的发育、增殖、分化和存活中起到关键作用[9-10]。有研究表明,JAK/STAT通路激活参与AML发病,促进白血病细胞的增殖,增加AML患者对化疗药物耐药及复发的风险[11-15]。
本研究整合4个涵盖AML患者信息的独立研究队列,通过对这些队列中患者的基因表达信息、临床信息、预后信息进行综合分析,发现在AML患者中,JAK/STAT通路处于激活状态。STAT家族中,STAT4基因的表达上调与AML患者不良预后相关,可以将其视为AML潜在靶标,为临床预后评估和新疗法的构建提供帮助。
1 材料和方法
1.1 AML数据来源
本研究中患者信息来源于不同公共数据库的4个AML独立研究队列,这些信息均可通过网络下载。
从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov)中,选取163例接受转录组测序的非M3型初治AML患者,下载其基因表达数据和相对应的临床信息。该163例患者均采用阿糖胞苷7 d联合去甲氧柔红霉素或柔红霉素3 d的“7+3”方案进行诱导缓解,诱导缓解后以4~6个疗程的化疗或造血干细胞移植进行巩固治疗。
从基因表达综合(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/)获取基于GPL96平台的GSE9476(n=64)、GSE1159(n=121)、GSE6891(n=403)芯片数据与临床信息,除去预后良好的M3型AML患者数据后,做差异表达基因(differentially expressed genes,DEGs)分析与生存分析。
1.2 差异表达基因分析
用GEO2R工具(https://www.ncbi.nlm.nih.gov/geo/geo2r/)分析26例AML患者和38例健康人之间的差异表达基因(differentially expressed genes,DEGs),根据P值与差异倍数(fold change,FC)进行筛选,选出Padj≤0.05且FC的对数,|log2FC|≥0.5的基因视为DEGs。利用OmicShare在线工具(http://www.omicshare.com/tools)对DEGs进行KEGG信号通路富集分析,筛选可能参与AML致病的信号通路。
1.3 生存分析
为评价特定基因的预后价值,将患者按TCGA和GEO数据库中该基因表达的中位数或上四分位数分为两组(高表达组与低表达组)。利用Kaplan-Meier法和Log-rank检验,以总生存期(overall survival,OS)和无事件生存期(event-free survival,EFS)为指标,在数据库中评价某特定基因对AML患者预后的影响。
1.4 统计学方法
运用SPSS 22.0(SPSS,美国)、GraphPad Prism 5(GraphPad公司,美国)或R软件(V3.6.3)进行统计分析。以STAT4基因表达量的中位数为界,将研究队列分为高/低表达组,采用Fisher’s精确检验和Wilcoxon秩和检验进行假设检验,使用Kaplan-Meier法和Log-rank检验进行生存分析。在所有统计结果中,以P<0.05为差异具有统计学意义。
2 结果
2.1 AML患者与健康人差异表达基因分析
为寻找AML患者与健康个体间存在表达差异的基因,本研究对26例急性髓系白血病患者和38例健康人,外周血或骨髓样本的基因芯片表达结果进行对比分析,经过GEO2R预处理,鉴定出1266个具有显著表达差异的基因(Padj≤0.05,|log2FC|≥0.5),其中有426个基因在AML患者中显著上调,840个基因在AML患者中显著下调(图1A)。对这1266个DEGs进行KEGG信号通路富集,发现这些基因主要富集在HTLV-Ⅰ感染、MAPK信号通路、急性髓系白血病、铂类药物耐药、FOXO信号通路、JAK-STAT信号通路等69条通路上(均P<0.05,图1B)。
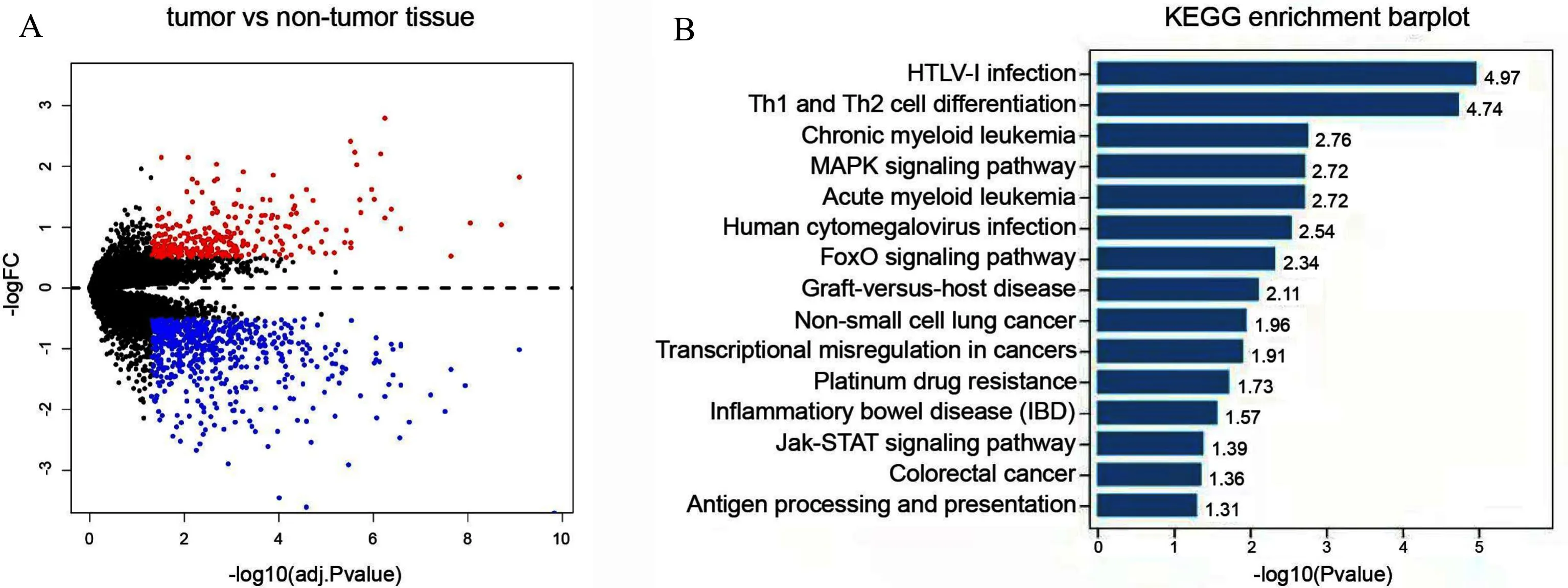
A:差异表达基因的火山图;B:差异表达基因的KEGG通路富集
2.2 AML患者JAK家族和STAT家族基因mRNA表达水平与健康人之间存在差异
分析GSE1159队列基因芯片数据,对比AML患者与健康人之间JAKs和STATs基因表达水平,发现AML患者JAK1(P=0.019)、JAK2(P=0.047)和STAT4(P<0.01)基因表达水平高于健康人,STAT5A(P=0.028)和STAT6(P=0.022)基因表达水平低于健康人(图2A)。以各基因表达量中位数为界,将队列分为高/低表达组,对每个基因的高、低表达组进行对比可以发现,所有基因的mRNA表达水平均存在差异(P<0.05;图2B)。

A:GSE1159队列中JAK/STAT通路关键基因的表达在AML患者与健康人间存在明显差异;B:JAK/STAT通路关键基因的mRNA表达水平在GSE1159队列中均存在差异;*P≤0.05,**P≤0.01,*** P≤0.001,****P≤ 0.0001,#P> 0.05
2.3 STAT4基因高表达的AML患者预后不良
为评估JAKs和STATs基因对AML患者预后的影响,以这些基因表达量中位数/上四分位数为界,将TCGA/GSE6891队列中的AML患者分为高/低表达组。经单因素生存分析,发现TCGA数据库中,STAT4高表达组患者较低表达组患者有更短的EFS(图3A,P=0.01)和OS(图3B,P=0.02);GSE6891队列中,STAT4高表达组患者的EFS(图3C,P=0.078)和OS(图3D,P=0.044)也较低表达组患者短。

A:TCGA数据库患者的EFS;B:TCGA数据库患者的OS;C:GSE6891队列患者的EFS;D:GSE6891队列患者的OS
由此我们认为STAT4高表达与AML患者较差的预后正相关,而相较于STAT4,其他JAKs与STATs的mRNA表达水平与AML患者生存期无关(表1和表2)。

表1 TCGA数据库中AML患者JAK/STAT通路相关基因表达水平的单因素生存分析

表2 GSE6891队列中AML患者JAK/STAT通路相关基因表达水平的单因素生存分析
2.4 AML患者临床基线数据信息
将163例急性髓系白血病患者以STAT4表达中位数为界,分为STAT4低表达组(n=82)和高表达组(n=81),两组患者的临床基线资料如表3所示。与低表达组相比,STAT4高表达组患者年龄更大(P=0.005),60岁以上老年人的STAT4表达更高(P=0.023);STAT4低表达组则具有更高的白细胞计数(P=0.006)、外周血原始细胞比例(P=0.003)和骨髓原始细胞比例(P=0.011)。在FAB分型中,STAT4在M5型AML患者中的表达更低(P=0.011),其余FAB分型、年龄及两组间化疗方案等无明显差异。对比两组患者间的融合基因与突变基因发现,高表达组中FLT3-ITD(P=0.044),TP53(P<0.001)的出现率显著增加,低表达组中FLT3-TKD(P<0.001),NPM1(P=0.044),NPM1Mut/FLT3-ITDWT(P=0.002)的出现率明显增加(表3)。对比两组基因表达谱可以发现,在高表达组患者中,ERG(P=0.006),BAALC(P=0.034),MN1(P=0.015),LEF1(P<0.001),DNMT3B(P=0.006),ATP1B1(P=0.034),TCF4(P=0.002),MECOM(P=0.006),P2RY14(P=0.002),TET1(P=0.006),ITGA3(P<0.001)这些基因拥有高表达的可能性增加,与之相对的低表达组中INSR(P<0.01)基因的高表达概率增加(表3)。根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中AML预后危险度分级标准(http://www.nccn.org)对163例患者进行危险度分级发现,STAT4在高危组中有更高表达水平(P=0.014),而在低危组中,STAT4的表达水平相对较低(P=0.015)。
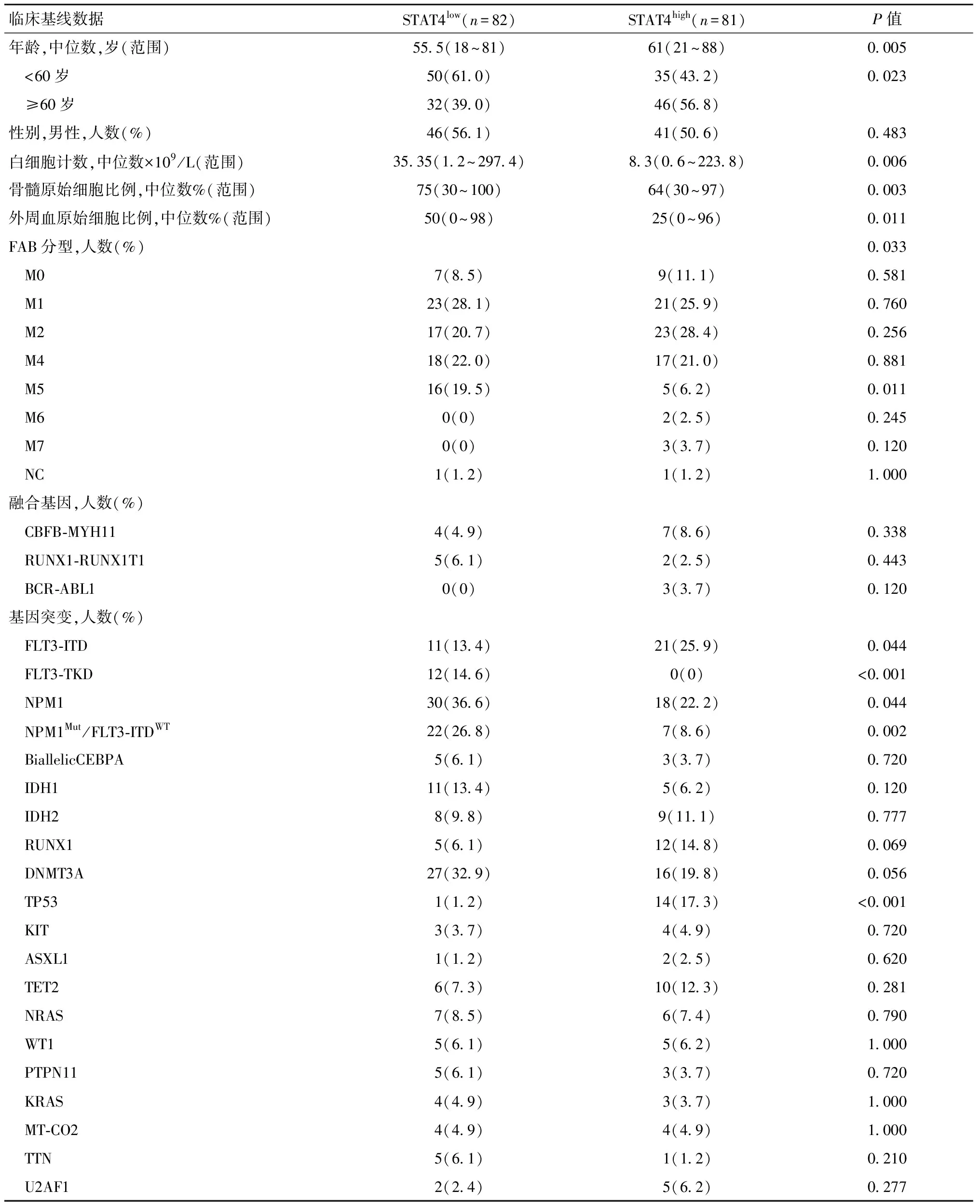
表3 AML患者临床信息在STAT4高、低表达组间存在差异
2.5 STAT4高表达与不同预后分组AML患者的关系
为进一步讨论STAT4高表达在不同预后风险组的作用,以NCCN指南AML危险度分级标准,将患者分为预后良好(n=44)、预后中等(n=54)和预后不良(n=65)组。单因素生存分析提示,预后良好组中,STAT4高表达组较STAT4低表达组患者有更短的EFS(P=0.014)。在预后中等和预后不良组中,STAT4高、低表达组患者的EFS(P=0.751;P=0.459)和OS(P=0.886;P=0.147)无明显差异,见图4。

A:预后良好组患者的EFS;B:预后良好组患者的OS;C:预后中等组患者的EFS;D:预后中等组患者的OS;E:预后不良组患者的EFS;F:预后不良组患者的OS
2.6 STAT4表达水平对预后影响的多因素分析
为进一步评估STAT4在AML患者中的预后意义,选取STAT4表达水平、STAT5B表达水平、年龄、白细胞计数、骨髓原始细胞比例、NCCN指南危险度分级、FLT3-ITD突变、DNMT3A突变、TP53突变、MECOM表达水平这些变量构建多因素Cox回归模型。结果提示,STAT4高表达与较短的EFS(HR=1.958,P=0.002)和OS(HR=1.556,P=0.036)显著相关。高龄(EFS:HR=1.762,P=0.001;OS:HR=2.008,P<0.001)、高白细胞计数(EFS:HR=2.265,P<0.001)、危险度分级为高危组(OS:HR=1.845,P=0.006)、DNMT3A突变(EFS:HR=1.740,P=0.007;OS:HR=1.734,P=0.007)、TP53突变(EFS:HR=2.085,P=0.025;OS:HR=2.338,P=0.012)为预后不良因素。STAT5B高表达(OS:HR=0.664,P=0.027)、危险度分级为低危组(EFS:HR=0.598,P=0.043)与较好的预后相关(表4)。
3 讨论
AML是一种常见的成人急性白血病,随着新一代高通量测序技术的进步,越来越多基因变异和表观遗传学修饰改变的发现让我们对AML发病机理有了新认识,基于新靶点开发的肿瘤药物显著改善了患者预后。但是AML患者目前的5年生存率仍不足30%[5-6]。为改变这一现状,我们仍需发掘新的分子靶点,探索发病机制以改善患者预后生存。本研究发现在AML患者中,JAK/STAT通路处于激活状态,AML患者体内STAT4 mRNA水平明显高于健康人群,而STAT4高表达提示患者拥有较短的总生存、无事件生存;在NCCN危险度分级为预后良好的患者中,高表达STAT4同样提示患者预后不良。
JAK/STAT通路是真核生物中普遍存在的细胞内信号转导通路[16],该通路与AML密切相关。JAK/STAT通路可引起G0/G1期阻滞并抑制AML细胞的增殖[17],阻断JAK/STAT磷酸化可以抑制体内外AML细胞的增殖[18-20]。JAK/STAT通路主要由细胞因子受体、JAKs和STATs组成。JAKs激酶是细胞内非受体酪氨酸激酶家族,由JAK1、JAK2、JAK3和TYK2组成[21],JAK1、JAK2和TYK2普遍表达,而JAK3主要在造血细胞中表达[22]。JAKs的过度激活和突变在恶性血液病的发生发展中具有关键作用。现有研究发现,AML细胞中JAK2磷酸化水平增加[23]。AF10融合基因可通过JAK1激活JAK/STAT通路导致AML的发生[12]。JAK1突变(JAK1V658F)使FLT3-ITD阳性AML对FLT3抑制剂产生抵抗[11],在T-ALL中JAK1突变是常见事件[24]。JAK3突变(JAK3A572V)与M7型AML相关[25],而JAK2突变(JAK2V617F)多见于骨髓增生性肿瘤患者。
STATs是一种核内转录因子,该家族由STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6组成[21],参与调节细胞增殖、分化和凋亡[26]。STATs的高表达和持续激活,常与肿瘤恶性转化有关。现有研究已证实,抑制STAT1可减少AML细胞增殖,抑制肿瘤生长[27]。AML细胞中STAT3处于激活状态[28-29],选择性抑制STAT3,可在不损害正常造血细胞的情况下导致AML干/祖细胞死亡[30-31]。而STAT5可同时参与髓系和淋巴系恶性肿瘤的发展[32-33]。STAT4是Th1辅助细胞的主要转录因子,参与固有免疫与适应性免疫应答[34-35]。其在淋巴细胞、髓系细胞中均有表达,但表达水平在不同分化水平的细胞系中存在差异,具有相对成熟表型的髓系细胞系中未检测到STAT4转录产物[34]。现有报道指出,GATA3可能通过诱导STAT4过表达,激活JAK/STAT通路参与急性B淋巴细胞白血病的发生[36-37]。另有文献指出,CML干细胞可通过磷酸化激活STAT4与STAT5促进PIM2的表达致病[38]。目前关于STAT4与髓系白血病之间关系的研究较少,本研究发现AML患者体内STAT4 mRNA水平明显高于健康人群,而STAT4高表达提示患者拥有较短的总生存、无事件生存。STAT3/4/5在髓系细胞不同发育阶段存在表达差异,在不同类型的恶性血液病中也具有表达差异[32-39],但不可否认的是,在某些疾病,如CML中,STATs因子在疾病致病过程中存在协同作用。
本研究分析AML患者与健康人群之间的差异表达基因,发现在AML患者中JAK/STAT通路处于激活状态,AML患者JAK1、JAK2和STAT4基因表达水平高于健康人群,STAT5A和STAT6基因表达水平低于健康人群。利用单因素和多因素分析模型评估单个JAK基因和单个STAT基因与AML患者总生存及无事件生存间的关系,发现STAT4基因高表达提示AML患者预后不良,STAT4高表达是AML患者预后的独立危险因素。在不同亚组中进一步分析,发现经NCCN危险度分级定义的预后良好组STAT4高表达患者,较低表达患者拥有更短的EFS。下一步将招募AML患者与同期健康供者各30人,采集患者及健康供者的骨髓或外周血,提取单个核细胞后进行qRT-PCR、Western blot,分析患者与健康供者间STAT家族的表达差异、磷酸化STAT的变化,追踪患者预后信息,以验证文中结论。此外仍需探寻下游通路,寻找靶基因,对STAT4异常表达对AML发病及影响预后的作用机制展开进一步研究。
综上所述,本研究对4个独立队列中患者的基因表达信息、临床信息、预后信息进行综合分析,证实在AML患者中,JAK/STAT通路处于激活状态,JAKs和STATs在AML患者中存在表达差异。本研究还发现STAT家族中,STAT4基因的表达上调提示AML患者预后不良,可能是预测AML预后的潜在生物标志物,这些结果为进一步研究STAT4基因的功能奠定了基础。

