着丝粒蛋白-F在胰腺导管腺癌中的表达及临床意义*
李宇阳, 傅培铃, 钟国栋, 卢 梅, 王鹏程, 卢辉楠, 陈林莺△
1福建医科大学附属第一医院病理科,福州 350005 2福建医科大学附属第一医院滨海院区国家区域医疗中心病理科,福州 350212 3福建中医药大学附属第二人民医院病理科,福州 350003 4福建医科大学附属福清市医院病理科,福清 350399
胰腺导管腺癌(pancreatic ductual adenocarcinoma,PDAC)是一种恶性程度高、预后差的消化系统常见肿瘤[1]。在美国,胰腺导管腺癌致死率居肿瘤中居第4位[2],在中国,胰腺导管腺癌死亡率居第6位,较过去十年增加了9%[3]。由于早期胰腺导管腺癌患者起病隐匿,临床症状不典型,许多患者在确诊时已经发展为中、晚期,错过了最佳治疗时机[4]。因此加强对胰腺导管腺癌发展进程的研究,寻找新的有效的预防和治疗途径,可能是降低患者死亡率、提高生存率的关键。
着丝粒蛋白F(centromere protein F,CENPF)是一种分子量为367 kD的核定位蛋白,是着丝粒蛋白家族中最大的成员,在人类自身免疫系统疾病患者的血清中首次被发现[5]。CENPF可参与细胞周期的调控,在G0/G1期表达水平较低,在S期核基质中逐渐积累,在G2/M期表达最多,达到峰值,最后在有丝分裂期完成降解[6]。CENPF缺失会影响动粒的功能,阻碍有丝分裂的完成[7]。现有研究表明,CENPF与多种肿瘤发生发展密切相关,例如在肾细胞癌[8]、胃癌[9]、甲状腺乳头状癌[10]、恶性黑色素瘤[11]中均存在高表达现象,但CENPF在胰腺导管腺癌中的具体作用尚不清楚。
因此,为探索CENPF在胰腺导管腺癌肿瘤细胞的作用,本研究应用生物信息学和免疫组织化学染色的方法,从信使核糖核酸(messenger RNA)层面以及组织蛋白层面分析CENPF在胰腺导管腺癌中的表达,探讨其与PDAC临床病理特征及预后的关系,为PDAC的防治研究提供更多理论依据。
1 材料与方法
1.1 临床病例资料
收集2007~2021年间经福建医科大学附属第一医院病理科确诊的胰腺导管腺癌手术标本121例,纳入标准:①病理诊断为PDAC;②同时获得成对的癌组织和癌旁组织;③根治性胰十二指肠切除术(保留或不保留幽门)。排除标准:①接受新辅助化疗;②无法获得病理标本。诊断和分期基于美国癌症联合委员会(AJCC)第8版。该研究获得福建医科大学附属第一医院伦理委员会批准。
1.2 目的基因筛选
通过美国国家生物信息中心(National Center for Biotechnology Information,NCBI)的微阵列/基因谱的公共数据库(Gene Expression Omnibus,GEO),筛选高质量PDAC数据集芯片,运用GEO2R软件筛选出差异基因(differentially expressed genes,DEGs)数据集(logFC>1或logFC<-1,且P<0.05),利用维恩软件筛选出表达一致的差异基因(log FC>0的DEG被认为是上调基因,而log FC<0的DEG被认为是下调基因),运用Cytoscape软件中的STRING软件构建表达一致的差异基因蛋白相互作用网络模块(protein-protein interactions,PPI),并进行可视化分析,运用Cytoscape软件中的MCODE应用工具,获得关键PPI聚类模块(MCODE评分>5分的模块)。通过GEPIA(Gene Expression Profiling Interactive Analysis,GEPIA)对关键PPI聚类模块中的基因在胰腺导管腺癌中的表达差异进行分析,综合对比关键基因差异性表达量,联合中外胰腺导管腺癌基因研究现状及PPI聚类模块中的节点值,选出目的基因。
1.3 目的基因在生物信息学中的表达及预后
基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)及基因型组织表达数据库(The Genotype-Tissue Expression,GTEx),通过NCBI网络、GEPIA、Ualcan及Oncomine软件[THRESHOLD(P-value)<1E-10,THRESHOLD(fold change)> 2]分别分析CENPF在不同癌症中肿瘤与正常组织表达差异性,;运用Ualcan分析CENPF在胰腺肿瘤与正常组织表达差异性;运用TIMER生物信息分析工具及Kaplan-Meier在线生存分析工具,评估目的基因与PDAC间的生存预后相关性。
1.4 目的基因在组织蛋白中的表达及预后
利用甲醛溶液固定癌组织和癌旁组织,制作组织蜡块,按4 μm的厚度连续切片,目的基因CENPF抗体购自Abcam公司,兔单克隆抗体,克隆号:AB223847(EPR20406),按1∶500稀释后孵育,操作按说明书进行,采用EnVision两步法检测。采用Kaplan-Meier分析法分析目的基因在胰腺导管腺癌中总生存情况(P<0.05),并运用Cox回归分析法分析肿瘤的独立预后危险因素(P<0.05)。
1.5 目的基因通路及免疫浸润分析
运用DAVID数据库软件,对PDAC中与目的基因相关的上调及下调基因进行基因本体论(gene ontology,GO)分析,包括分子功能(molecular function,MF)、细胞成分(cellular constituent,CC)、生物过程(biological process,BP)等。在TCGA数据库中,按照目的基因在胰腺导管腺癌中的表达量中位数值划分为高表达组和低表达组(FDR-q值<0.05且FWER-P值<0.05),进行相关信号通路分析。运用TIMER生物信息分析工具分析目的基因在胰腺导管腺癌中与免疫浸润的关系。
1.6 免疫组化结果判读
根据阳性细胞染色强度得分(无0分,弱阳1分,中等强度2分,强阳3分)及阳性细胞百分比得分(无阳性细胞记0分,<1%记1分,1%~记2分,11%~记3分,34%~记4分,≥67%记5分),将两得分相加,总得分0判读为阴性,1~8分判断为阳性(1~4分判读为低表达,5~8分判读为高表达)。每组实验都附有阳性对照,所有免疫组化结果均由两名高年资病理医师评估后作出判断。
1.7 统计学方法
应用SPSS 21.0软件进行数据分析。目的基因在胰腺导管腺癌中的表达与临床病理特征的关系,及其在胰腺导管腺癌与癌旁组织中的表达情况,采用χ2检验或者Fisher’s精确概率法检验,总生存期采用Kaplan-Meier分析法,单因素分析及多因素分析采用Cox回归分析法,以P<0.05为差异具有统计学意义。
2 结果
2.1 目的基因筛选
为了筛选目的基因,我们首先通过(GEO)公共数据库筛选出3个芯片数据集(GSE15471、GSE16515和GSE28735),运用GEO2R软件联合维恩图软件计算出3个数据集中表达一致的差异基因:上调基因共同表达197个,下调基因共同表达66个(图1A)。再运用Cytoscape软件中的STRING应用工具构建出DEGs的蛋白相互作用网络PPI图(图1B),并导入Cytoscape软件中的MCODE应用工具,对PPI网络进行聚类分析,共获得2个关键聚类模块(图1C),共32个基因。最后运用GEPIA对这些基因在胰腺导管腺癌中的表达差异进行分析,联合PPI聚类模块中的节点值及中外胰腺导管腺癌基因研究现状,筛选出目的基因CENPF:该基因属于DESs中的上调基因,在PPI关键聚类模块得分5.2分,且在胰腺导管腺癌和正常胰腺组织中表达存在差异(P<0.05)(图1D)。

A:维恩图显示上调一致基因、下调一致基因;B:表达一致的上调基因与下调基因PPI交互作用图;C:PPI交互作用关键模块MCODE得分5.7及5.2分;D:GEPIA软件显示CENPF在胰腺导管腺癌与正常胰腺组织中存在表达差异,N(正常)=171例,T(肿瘤)=179例,*P<0.05
2.2 CENPF的表达在不同癌种中存在差异
为了验证目的基因在肿瘤中的表达是否存在差异,我们运用生物信息学检测了CENPF在泛癌种中的表达情况。NCBI显示CENPF在27种人体组织中表达,其中在正常胰腺组织中表达极低(数据来自BioProject,PRJEB4337)(图2A),GEPIA、Ualcan及Oncomine在线分析工具显示CENPF在多种肿瘤癌与非癌组系中的表达存在差异(图2B~2D),其中均包括PDAC。
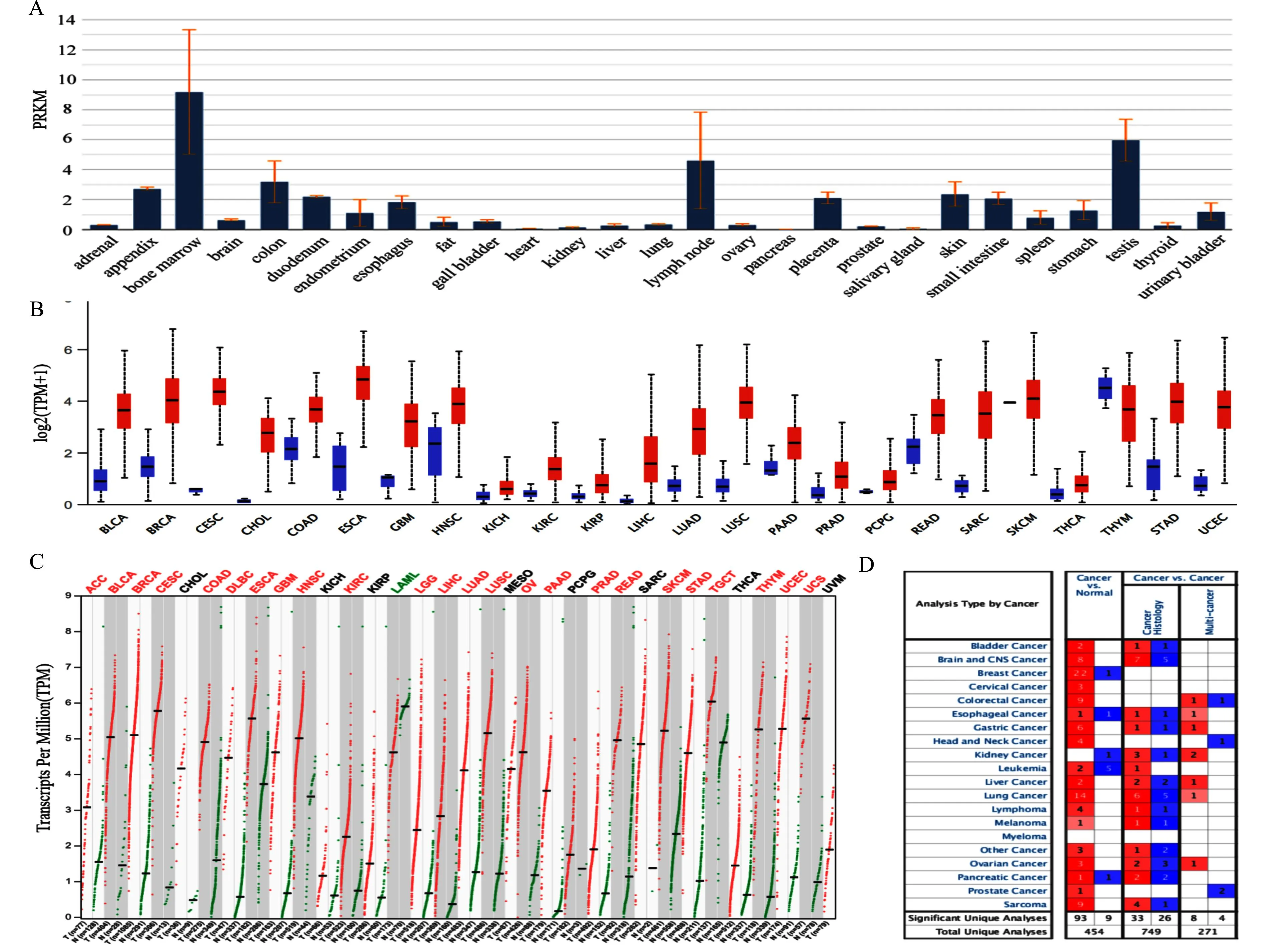
A:NCBI显示CENPF在27种人体组织的正常胰腺组织中表达极低(BioProject:PRJEB4337);B:Ualcan显示CENPF在不同肿瘤中表达不同,红色代表CENPF在肿瘤组织中的表达,蓝色代表在正常组织中的表达;C:CENPF在GEPIA中的表达,红色字体代表CENPF在肿瘤组织中的高表达,绿色字体代表其低表达;D:Oncomine显示CENPF在不同肿瘤中的表达,红色方块代表CENPF在肿瘤组织中的高表达,而蓝色方块代表其低表达,数字代表相关数据集的数量
2.3 CENPF的表达在癌组织及癌旁组织中存在差异且与不良预后显著相关
为进一步证实目的基因筛选的可靠性,我们从mRNA层面运用多个生物信息学方法探究其在PADC中的表达及与预后的相关性。Ualcan软件(按照目的基因在胰腺导管腺癌中表达量最佳截点值划分为高表达组和低表达组)分析显示CENPF的表达与PDAC分级存在相关性(P<0.05),并与其不良预后有关(P=0.0038)(图3A、3B),TCGA数据库也证实CENPF高表达是患者预后不良的因素(P<0.05)(图3C),TIMER数据库表明CENPF高表达与PDAC患者较差的总生存期(OS)相关(P=0.0088)(图3D),GEPIA显示CENPF与患者的OS及无疾病进展生存期(DFS)相关(P=0.013、P=0.027)(图3E、3F)。Kaplan-Meier生存分析结果也显示CENPF高表达状态与患者OS以及DFS相关(P=0.00014、P=0.0043)(图3G、3H)。

A~B:Ualcan分析中CENPF的过表达与分级存在相关性(P<0.05)并与不良预后有关(P=0.00038);C:TCGA数据库显示在胰腺癌中高表达与低表达预后存在统计学意义(P<0.05);D:TIMER数据库表明高CENPF表达与PDAC患者较差OS相关(P=0.0088);E~F:GEPIA显示CENPF与患者的OS以及DFS相关(P=0.013、P=0.0027);G~H:Kaplan-Meier生存分析结果也显示CENPF高表达状态与患者OS以及DFS相关(P=0.00014、P=0.0043)
2.4 CENPF的表达与临床病理特征的相关性
为进一步验证CENPF表达失调与PDAC表达存在相关性,通过免疫组织化学法染色,发现CENPF阳性染色定位于肿瘤细胞核,在正常胰腺腺泡上皮和胰腺导管上皮中多呈弱或无阳性着色,且随着胰腺导管腺癌分化程度的降低,免疫组化显色度越强且表达阳性细胞数量越多(图4A~4D)。结合患者临床资料,经过统计学软件分析发现:CENPF表达与出现神经侵犯(P=0.036)、更高的TNM分期(P=0.041)、更多的淋巴结转移(P=0.023)及更差的肿瘤分化(P=0.020)有关;而CENPF在胰腺导管腺癌中的表达与患者性别、年龄、部位、肿瘤直径、脉管侵犯无关(表1,图4E~4G)。

表1 CENPF蛋白表达与胰腺导管腺癌临床病理特征的关系(例)

A:正常胰腺导管上皮表达阴性;B:高分化胰腺导管腺癌;C:中分化胰腺导管腺癌;D:低分化胰腺导管腺癌;E~F:CENPF在淋巴结转移和伴有神经侵犯的患者中表达更高;G:CENPF与患者总体生存预后关系
2.5 CENPF的表达与PDAC患者预后
为了分析CENPF表达失调与PDAC预后存在相关性,我们运用Kaplan-Meier法分析发现,CENPF高表达的患者预后较差,低表达CENPF组和高表达CENPF组的中位生存时间分别为21个月和9个月(Logrank=18.608,P=0.000016)。单因素分析表明,较差的OS患者与CENPF高表达状态(P<0.01)、分化程度(P<0.01)、肿瘤部位(P=0.035)、TNM分期(P=0.038)有关。我们将单因素分析P<0.05的指标及卡方检验P<0.05的指标纳入Cox多变量分析模型,结果显示:CENPF表达量、TNM分期及分化程度是PDAC患者预后的独立危险因素(分别为P=0.004、P=0.003和P<0.001),高表达患者的死亡风险是低表达患者的2.65倍(表2)。
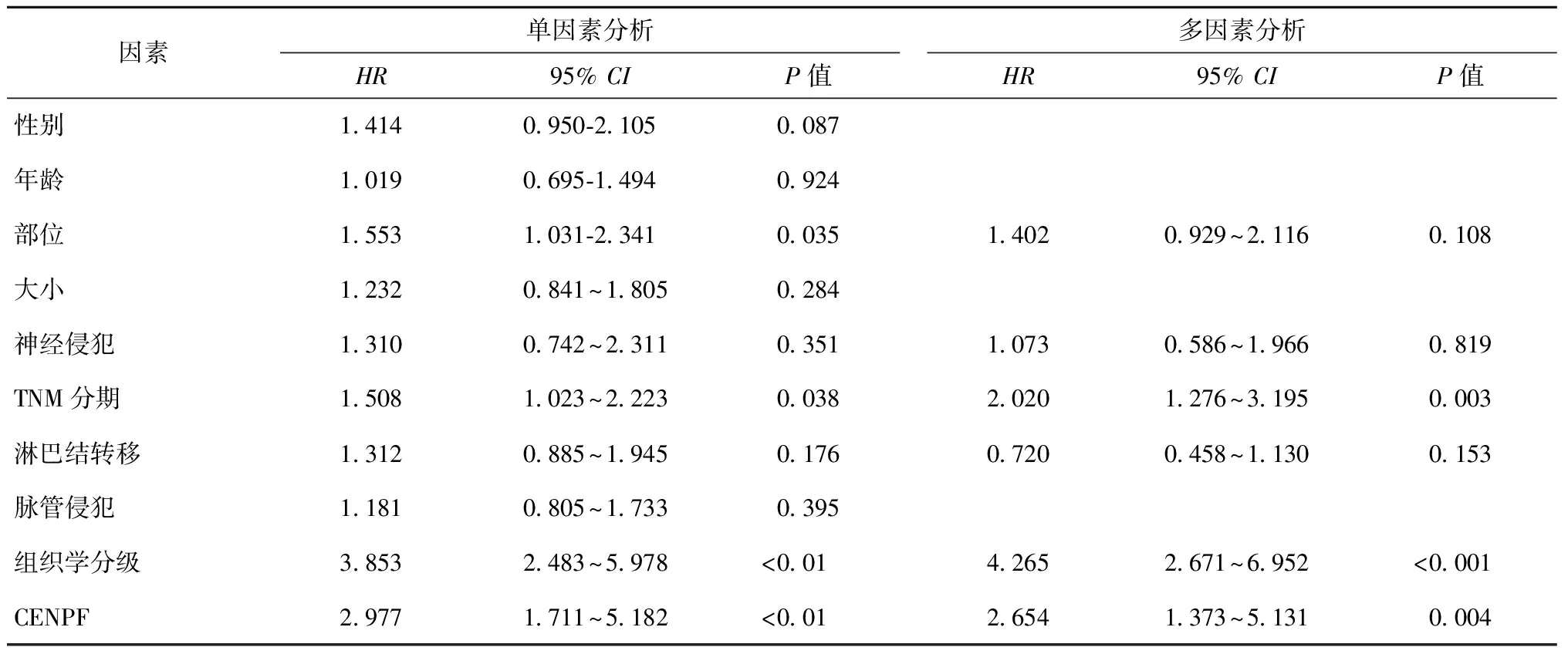
表2 胰腺导管腺癌患者总生存率的多因素及单因素Cox分析
2.6 目的基因通路分析及免疫浸润
为了探究目的基因在PDAC疾病发展中的作用,我们运用DAVID数据库软件分析发现CENPF与所在关键模块基因在胰腺导管腺癌中的相互作用,在细胞成分(CC)上,主要富集于外泌体、细胞外基质、细胞质膜、细胞中间体等;在分子功能(MF)上,主要与丝氨酸内肽酶活性、金属肽链内切酶活性、蛋白质同源二聚化活性有关;在生物过程(BP)上,体现在细胞外基质分解抗体、蛋白质水解、半桥粒组装、细胞粘附等(图5A)。KEGG富集软件发现CENPF在胰腺导管腺癌中与细胞周期、P53通路、泛素介导的蛋白水解通路、错配修复通路以及核苷酸切除修复通路等密切相关(图5B)。运用TIMER软件分析发现CENPF与P53呈正相关(P<0.01),与MDM2蛋白呈正相关(P<0.01)(图5C),并且MDM2在PDAC及正常组织中的表达存在显著差异(P<0.01)。

A:DAVID分析CENPF与其所在关键模块基因本体论(GO)结果;B:KEGG分析CENPF在胰腺导管腺癌中的作用通路;C:CENPF与P53、MDM2在PDAC中的表达存在相关性;D:TIMER数据库显示在PDAC中CENPF与浸润免疫细胞之间的相关性,CENPF表达与CD4+T细胞(P=0.000204)、树突细胞(P=0.045)的浸润密切相关
由于上述研究发现CENPF与所在关键模块基因在PDAC中的作用可能与细胞外基质有关,而细胞外基质与免疫浸润细胞密不可分[12],我们进一步分析了CNPFF在PDAC中与免疫浸润细胞的关系。TIMER数据库分析显示CENPF表达与CD4+T细胞呈负相关(P=0.000204)、与树突细胞呈正相关(P=0.045),但与B细胞、CD8+T细胞和巨噬细胞、中性粒细胞无关(图5D)。
3 讨论
胰腺导管腺癌的发病机理是一个复杂的过程[13],Long等[14]综合运用二代测序、转录组Meta分析、免疫组织化学及TCGA微阵列数据方法,发现有23种基因标志物可能用于胰腺癌的诊断和管理。Zhou等[15]对36例胰腺肿瘤进行共表达分析,结果显示10种枢纽基因可能存在异常表达,其中包括CENPF,由此可见,胰腺导管腺癌是多种因素导致的异质性疾病。本研究基于生物信息学技术,在RNA层面通过微列阵/基因谱数据库(GEO)筛选出目标基因CENPF。
我们通过NCBI、GEPIA、Ualcan及Oncomine生物信息学分析发现CENPF可在不同类型肿瘤中表达,且在癌与正常组织的表达存在差异,并且Ualcan分析显示CENPF过表达与PDAC分级存在相关性。截至目前也有众多学者证实CENPF高表达现象在其他肿瘤中的作用:在肺癌中,CENPF表达上调与患者的预后呈反比,并且敲低CENPF可以抑制肺癌细胞的增殖并促进了其凋亡[16];在肝细胞癌中,CENPF异常表达与有无家族病史、饮酒史、肿瘤分期、是否感染过肝炎病毒等有关[17];在蛋白水平上,我们通过收集121例胰腺癌患者标本,发现CENPF在PDAC表达量显著多于正常胰腺组,并且随着PDAC分化程度的降低,免疫组化显色度越强且表达阳性细胞数量越多。经过统计学分析显示CENPF的表达与PDAC的TNM分期成正比,与肿瘤分化程度成反比,并且CENPF高表达状态更易发生神经侵犯以及淋巴结转移,以上说明CENPF在PDAC的发生发展有关键作用,其过表达状态极有可能影响肿瘤细胞增殖,加速局部扩散,加快恶变进程。
为了更好的认识CENPF过表达在PDAC中的作用,我们进一步探究其对预后的影响,发现CENPF过表达与预后不良有关,并且增加了复发风险,TCGA数据显示CENPF是患者预后不良的因素,TIMER分析表明高CENPF表达与PDAC患者较差OS相关,GEPIA数据及Kaplan-Meier生存分析结果均显示CENPF不仅与患者的OS相关,并且是PDAC中DFS的负面因素。我们的组织蛋白实验数据也显示CENPF高表达的患者预后较差,低CENPF组和高CENPF组的中位生存时间分别为21个月和9个月,CENPF是PDAC患者预后的独立危险因素。因此,我们认为CENPF可能有助于预测PDAC患者的预后,是影响PDAC患者的高危风险因素之一,CENPF或许可用作评估风险分层的指标。
近年来,已有学者证实胰腺导管腺癌部分致病通路,比如CDK1基因通过在G2/M期刺激细胞周期进程,导致潜在致瘤突变细胞增殖,并促进癌症干细胞的发展,从而导致胰腺导管腺癌的发生[18];SMAD4基因突变可以通过诱导糖酵解酶PGK1的上调从而破坏糖酵解水平,导致胰腺导管腺癌的发生等[19]。但CENPF表达失调在胰腺导管腺癌中的致病机制尚未明确。在我们的研究中,发现CENPF所在的关键模块基因在胰腺导管腺癌相互协同作用,主要出现在细胞外机制、外泌体等,与丝氨酸型肽酶活性、丝氨酸水解酶活性、蛋白质同源二聚化活性有关;并且在细胞外基质分解抗体、蛋白质水解等过程中发挥作用。而CENPF在PDAC中的作用通路,主要参与了细胞周期、P53、泛素介导的蛋白水解等通路过程,研究表明CENPF作为着丝粒蛋白家族最大的基因,能调控细胞周期和改变细胞增殖能力,在有丝分裂过程中表达异常会影响动粒的功能,阻碍有丝分裂的完成。现有研究已证实在肾上腺皮质癌[20],CENPF的高表达水平与患者OS和PFS的恶化密切相关,可能是通过调节有丝分裂细胞的G2/M期的染色体分离来发挥作用。我们通过TIMER数据库还发现CENPF的表达与P53、MDM2蛋白均呈正相关,并且MDM2在PDAC及正常组织中的表达存在显著差异,P53是一种抑癌基因,可在50%以上的肿瘤中发生突变,大多数突变位于DNA结合结构域内,通过降低转录活性,导致细胞周期停滞或细胞凋亡[21]。已知P53信号转导途径参与调控的基因超过160种,其中报道最多的是MDM2蛋白,MDM2蛋白作为一种环指蛋白,是P53的转录靶点,可通过抑制转录共激活因子与P53结合影响转录活性,从而产生调节DNA修复和细胞增殖的相反反应[22]。所以CENPF过表达在PDAC中的作用,可能与P53-MDM2通路有关,但其精准调节作用,仍需更多实验进一步证实。
近年来,癌症与免疫系统的关系受到广泛关注。CD4+细胞是一种T淋巴细胞表面糖蛋白,可与HLA-Ⅱ分子结合,表达于抗原呈递细胞(antigen-presenting cells,APC)表面,可被激活为辅助性T细胞识别外源性抗原。已有研究表明[23]在癌症患者中,CD4+T细胞可能具有更广泛的抗肿瘤反应调节,在免疫监视中起到关键作用,高密度的肿瘤浸润CD4+T细胞与许多癌症类型的良好预后相关。树突状细胞(dendritic cell,DC)被认为是有效的APC,在先天性和适应性免疫应答的诱导和调节中起关键作用。Kohli等[24]发现浆细胞样DC(plasmacytoid dendritic cell,pDC)具有持续合成、泛素化和翻转MHCⅡ-肽复合物的潜力,可诱导调节性T细胞(regulatory cell,Treg)产生外周耐受,并导致同源CD4+T细胞的增殖失败。Liu等[25]的实验发现胃癌患者的pDC细胞数量增加,并且在晚期和淋巴结转移的患者中显著富集。本文运用TIMER数据库也发现CENPF过表达与CD4+T细胞呈负相关,与DC细胞呈正相关,在前期的蛋白实验中我们已证实CENPF过表达与PDAC低分化、高TNM分期及淋巴结转移有关,说明在PDAC中,CENPF的表达联合免疫细胞浸润可能促进肿瘤细胞的进展和转移:CENPF过表达可能抑制CD4+T细胞的表达,产生免疫逃逸,导致其无法或减弱对肿瘤特异性抗原的识别,并且促进了DC的合成,通过募集更多的Treg细胞来促进PDAC的免疫抑制,反向作用于自身免疫系统,并进一步抑制CD4+T细胞的增殖,导致肿瘤恶化。目前,部分PDAC患者会对化疗药物产生抗药性,因此针对肿瘤免疫浸润细胞寻找有效的治疗靶点,提供更多的治疗方案,有望提高PDAC患者的疗效。
综上所述,CENPF基因在胰腺导管腺癌组织中表达增高,可能与PDAC疾病进展进程有关,携带CENPF过表达的患者预后差。寻找胰腺导管腺癌诊断及预后生物学标记物是胰腺癌防治研究的关键,通过本项目的研究有望为临床胰腺导管腺癌的诊断提供了新的思路,也为胰腺导管腺癌的防治提供更多实验基础。

