莱菔硫烷对糖尿病视网膜病变Nrf2通路和NLRP3炎性小体的影响①
王樱銮,宿星杰,张 剑,齐艳秀
(佳木斯大学附属第一医院眼科,黑龙江 佳木斯 154003)
糖尿病视网膜病变(diabetic retinopathy,DR)的发病机制复杂,慢性炎症是DR的病理学基础,研究[1]显示,在糖尿病动物的视网膜和玻璃体中,均检测到炎症相关因子如白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-18(IL-18)等异常增加。核苷酸结合寡聚化结构棫样受体3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)通过介导caspase-1催化激活,裂解和释放IL-1β和IL-18诱导炎症,高糖状态下ROS表达增加,激活caspase-1及NLRP3炎性小体,进而使IL-1β活化[2]。核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)是在氧化应激和炎症相关组织损伤中具有重要作用的氧化还原敏感转录因子,是维持细胞氧化还原平衡的重要因子,Nrf2敲除的糖尿病鼠ROS显著增加,谷胱甘肽(glutathione,GSH)显著减少,早发血-视网膜屏障功能障碍,视觉障碍加重[3]。莱菔硫烷(sulforaphane,SFN)是可使用的异硫氰酸盐,在缺血再灌注动物模型的研究显示,SFN可快速上调Nrf及受其调控的抗氧化基因酶表达,但SFN是否可通过Nrf/NLRP3/IL-1β途径调控DR的进程目前较少见报道[4]。本研究观察SFN对糖尿病大鼠Nrf/NLRP3/IL-1β通路的影响,现报道如下。
1 材料与方法
1.1 实验动物
SPF级雄性健康SD大鼠72只,体质量200~250g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK-京-2019-0087,动物在标准条件下置于塑料笼中饲养,光/暗循环12h,温度21℃,湿度控制在55%,自由摄食和饮水。
1.2 主要试剂
高脂饲料购于上海睿安生物科技有限公司;链脲佐菌素(STZ)购于上海如吉生物科技发展有限公司;SFN购于上海瀚香生物科技有限公司;羟苯磺酸钙购于江苏万高药业股份有限公司,国药准字H20080288,规格:0.25g;HE染色试剂盒购于北京酷来搏科技有限公司;IL-1β、IL-18酶联免疫吸附法试剂盒购于北京华夏远洋科技有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购于碧云天;Tirzol购于上海源叶生物科技有限公司;逆转录试剂盒购于美国GeneCopoeia;Nrf2、血红素加氧酶1(heme oxygenase 1,HO-1)、NLRP3、凋亡相关点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase-1)、硫氧还蛋白互作蛋白(thioredoxin interacting protein,TXNIP)一抗购于Abcam中国。
1.3 动物分组和干预
随机抽取12只SD大鼠作为空白对照组(blank control group, BC组),剩余60只SD大鼠用于动物造模。造模组大鼠高脂饲料喂养2周后腹腔注射35mg·kg-1的STZ,3d后,禁食不禁水12h检测空腹血糖(FPG)>11.1mmol/L即为造模成功。共52组造模成功的大鼠随机分为模型组(model group,M组)、阳性对照组(positive contorl group, PC组)、SFN低剂量组(SFN low dose group, SLD组)和SFN高剂量组(SFN high dose group,SHD组),每组13只。SLD组给予SFN 25mg/kg腹腔注射,SHD组给予SFN 50mg/kg腹腔注射,PC组给予羟苯磺酸钙溶液1.0/kg腹腔灌注,BC组和M组给予等量生理盐水腹腔注射。连续治疗6周。
1.4 HE染色观察大鼠视网膜组织形态表现
实验结束后,分离得到大鼠视网膜,部分视网膜固定于4%多聚甲醛中,HE染色后镜下观察大鼠视网膜组织形态 。
1.5 检测大鼠视网膜组织炎性因子和氧化还原指标水平
实验结束后,取部分视网膜组织,制作组织匀浆,采用酶联免疫吸附法检测各组大鼠IL-1β、TNF-α水平,采用硫代巴比妥酸法检测MDA水平,采用黄嘌呤氧化酶法检测SOD水平。
1.6 采用qRT-PCR法检测大鼠视网膜中Nrf2-2、HO-1mRNA水平表达
实验结束后,取大鼠视网膜组织,机械匀浆后,用Trizol提取总RNA,参照逆转录试剂盒说明书以RNA为模板逆转录合成cDNA,采用CFX96 real-time PCR Detetion System对cDNA进行PCR扩增,反应条件:95℃30s,95℃5s,60℃30s,共39个循环,以β-actin为内参,采用2-ΔΔCT法对Nrf-2、HO-1mRNA检测结果进行定量分析。引物序列:Nrf2:上游:5’-TTTGGGAATGTGGGCAAC-3’,下游:5’-GAGAATTCCTCCCAATTCAGC-3’;HO-1:上游:5’-AGCGAAACAAGCAGAACCCA-3’,下游:5’-GCCACCAGCAGCTCAGGATG-3’。
1.7 采用Wester blot法检测蛋白表达水平
取部分视网膜组织,加入裂解液提取总蛋白,进行蛋白浓度检测后,进行SDS-PAGE蛋白电泳分离蛋白,转膜,洗涤3次,加脱脂牛奶封闭1h,加入Nrf2(1:1000)、HO-1(1:1000)、NLRP3(1:1000)、ASC(1:1000)、caspase-1(1:1000)、TXNIP(1:1000)一抗,室温孵育过夜,次日采用TBST洗涤3次后加入相应的二抗,室温下孵育1h,应用TBST进行3次洗膜,ECL发光进行显影并采集图像,以β-actin为内参,计算相应蛋白的相对表达量。
1.8 统计学方法

2 结果
2.1 HE染色观察视网膜组织形态表现
光镜检查结果显示,BC组大鼠视网膜组织结构清晰,未见明显病理改变;M组大鼠视网膜细胞排列疏松,内外核层抛离紊乱,细胞水肿明显;PC组、SLD和SHD组视网膜结构较M组清晰,细胞水肿明显减少;SHD组改善较PC组和SLD组更为明显,见图1。

图1 HE染色观察视网膜组织形态表现(×200,A:BC组,B:M组,C:PC组,D:SLD组,E:SHD组)
2.2 各组大鼠视网膜炎症因子和氧化应激指标相比较
M组MDA、IL-1β、TNF-α水平显著高于BC组(P<0.05),SOD水平低于BC组(P<0.05);PC组和SLD组MDA、IL-1β、TNF-α水平低于M组(P<0.05),SOD水平高于M组(P<0.05);SHD组MDA、IL-1β、TNF-α水平低于M组、PC组和SLD组(P<0.05),SOD水平高于M组、PC组和SLD组(P<0.05),见表1。
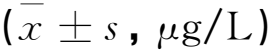
表1 各组大鼠视网膜炎症因子和氧化应激指标相比较
2.3 各组大鼠视网膜Nrf2和HO-1 mRNA表达水平相比较
M组Nrf2和HO-1 mRNA表达水平低于BC组(P<0.05),PC组和SLD组Nrf2和HO-1mRNA表达水平高于M组(P<0.05),SHD组Nrf2和HO-1mRNA表达水平高于PC组和SLD组(P<0.05),见表2。
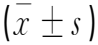
表2 各组大鼠视网膜Nrf2和HO-1 mRNA表达水平相比较
2.4 各组大鼠视网膜Nrf2、HO-1和NLRP3相关蛋白表达水平相比较
M组大鼠视网膜Nrf2、HO-1水平低于BC组(P<0.05),NLRP3、ASC、caspase-1、TXNIP水平高于BC组(P<0.05);PC组和SLD组Nrf2、HO-1水平高于M组,NLRP3、ASC、caspase-1、TXNIP水平低于M组(P<0.05);SHD组Nrf2、HO-1水平高于PC组和SLD组(P<0.05),NLRP3、ASC、caspase-1、TXNIP水平低于PC组和SLD组(P<0.05),见表3和图2。
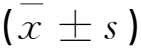
表3 各组大鼠视网膜Nrf2、HO-1和NLRP3相关蛋白表达水平相比较

图2 各组大鼠视网膜Nrf2、HO-1和NLRP3相关蛋白表达水平
3 讨论
随着糖尿病人群的增加和人均预期寿命的延长,糖尿病并发症发病率和发病人数逐年增加[1]。预计到2030年,全球糖尿病患者总数将从2000年的1.71亿增加到3.66亿,成为全球健康的主要威胁之一。是糖尿病最常见和最严重的并发症之一,初级阶段患者可无明显症状,一旦视觉出现问题,其进程几乎不可逆转,是导致失明的常见原因[2]。研究[3]显示,中国糖尿病人群DR患病率达43%,其中6.3%的患者视力受到威胁,增殖性DR对视力危害尤其严重,5年内未经正规治疗的DR患者约一半发展为永久视力丧失。几乎所有的1型糖尿病和超过60%的2型糖尿病在20年后均会发生不同程度的DR,其中发生增殖改变者约为18%,致盲者占20%,近年来随着糖尿病患者的数量激增,DR发病率快速增长[8]。本研究中组织学结果显示SFN对DR具有保护作用。
为进一步探讨SFN的保护作用机制,本研究首先关注了SFN对炎性通路的影响。DR的特点主要是视网膜微血管进行性损害、血管通透性增加、新生血管形成,其病理改变涉及到代谢酶、炎症、信号传导等多种机制变化,多数学者就炎症反应是糖尿病视网膜病变的重要过程达成共识[9]。本研究结果显示,M组大鼠视网膜中NLRP3、ASC、caspase-1、IL-1β、IL-18等NLRP3/IL-1β因子表达均显著升高,组织学检查显示视网膜破坏严重,结果提示,高糖诱导NLRP3/IL-1β通路表达上调,导致视网膜病变。相关研究结果提示[10],糖尿病大鼠早期即可检测到血-视网膜屏障破坏,同时检测到高表达的NLRP3、caspase-1、IL-1β和IL-18,沉默NLRP3表达,可降低IL-1β、IL-18等炎性因子和血管通透性。高糖培养的人视网膜微血管内皮细胞中同样观察到NLRP3炎症小体相关成分及细胞凋亡增加,沉默NLRP3可增强培养细胞对高糖的耐受性和减少细胞凋亡[11]。NLRP3和IL-1β在增殖性糖尿病视网膜病变组织中表达显著升高,且患者玻璃体中IL-1β和IL-18浓度显著升高[12]。这些研究均提示NLRP3炎症小体是高糖诱导视网膜细胞病变炎症及反应的关键启动因子,NLRP3炎症效应器是DR炎症进展的重要决定因素。本研究结果与上述研究一致。
本研究结果显示,M组大鼠视网膜MDA和TXNIP表达水平均显著高于BC组,SOD水平低于BC组,结果提示高糖诱导的氧化应激失衡和TXNIP表达水平升高是导致NLRP3的重要因素。既往研究[13]显示,高血糖可诱导ROS产生,高血糖诱导的ROS生成是糖尿病微血管病四种经典致病途径中常见的事件。而ROS的产生对NLRP3激活至关重要,ROS的产生是NLRP3激活的重要条件,几乎所有NLRP3激动剂都会导致ROS生成增加,通过ROS敏感的TXNIP蛋白激活NLRP3炎症小体[14]。高糖诱导的ROS可促使TXNIP从硫氧还蛋白解离,改变TXNIP从硫氧还蛋白阻遏物到NRLP3炎性激动剂的功能,敲除TXNIP基因可抑制NLRP3炎症小体激活,细胞凋亡[15]。在体外高糖环境下培养的人视网膜血管内皮细胞ROS水平升高,TXNIP表达水平升高,NLRP3炎症小体被大量激活,抑制ROS生成或沉默TXNIP表达均可阻止炎症小体组装,抑制炎症因子表达[16]。其中MDA是脂质过氧化物的最终产物,可反映ROS的活性。本研究结果进一步提示氧化应激在DR的病因子发挥重要因素。
Nrf2是抑制氧化应激和炎症反应的转录因子,Nrf2信号通路的激活在保护细胞抵抗氧化应激、羰基化合物和人体中的亲电剂方面发挥重要作用[17]。研究[18]显示,高糖状态下,激活视网膜细胞Nrf2,可减轻氧化应激对视网膜的损害,敲除Nrf2基因可导致抗氧化酶生成减少,炎症反应增强和视网膜破坏增加。因此有学者[19]建议在DR的早期激活Nrf2是防止氧化应激损伤和DR进展的关键。HO-1是一种应激反应酶,在病理条件下维持体内平衡[20]。SFN是异硫氰酸盐类化合物,具有抗氧化、心血管保护等作用,其本身不具有直接参与抗氧化反应的功能,可通过间接途径激活Nrf2,诱导产生一系列二相酶和抗氧化酶实现抗氧化作用[21]。研究[22]显示,SFN在转录水平激活Nrf2/HO-1途径增强人脐静脉的抗氧化损伤作用。本研究结果显示,SFN治疗可增加Nrf2后Nrf2、HO-1水平升高,TXNIP、NLRP3、caspase-1、ASC、IL-1β、IL-18水平降低,且SHD组改变较SLD组更为明显,结果提示,SFN可能通过激活Nrf2信号通路,降低氧化应激和TXNIP水平,从而降低NLRP3信号通路的激活,从而对DR产生保护作用。

