盐酸司来吉兰片原辅料相容性研究
唐嘉悦, 黄德见
(安徽贝克生物制药有限公司, 安徽 合肥 230000)
药用辅料是药品的重要组成部分,影响其安全性、有效性及稳定性。是决定产品质量重要的一环。制剂中的药用辅料可能与药物中的活性成分发生各种化学反应(如缩合[1]、水解[2]、氧化[3]等),从而产生新的化学成分或杂质[4,5]。 因此,研究药用辅料与药物的相容性问题可为提高药品质量、优化处方工艺提供必要支持[6]。
盐酸司来吉兰(selegiline hydrochloride),化学名为(R)-N,α-二甲基-N-(2-丙炔基) 苯乙胺盐酸盐,于1989 年经美国FDA 批准上市,临床可单独用于治疗帕金森病,近年来亦有研究表明其与美多芭等药物联用,治疗帕金森病临床效果佳[7-9]。 其结构式与相关杂质见图1。
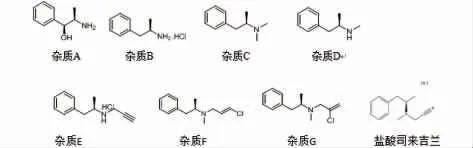
图1 盐酸司来吉兰及相关杂质结构式
根据参比制剂(商品名“咪多吡”)说明书记载,本品辅料有甘露醇,玉米淀粉,微晶纤维素,聚维酮K30,乙醇(在生产工艺中去除)和硬脂酸镁,选择与参比制剂相同的辅料种类与盐酸司来吉兰原料进行原辅料相容性试验。将原料与辅料按照一定比例混合,分别放置于高温(60℃)、高湿(75%±5%RH和92.5%±5%RH)、光照(光照试验的总照度不低于1.2×106Lux·hr、 近紫外能量不低于200w·hr/m2)中放置10、30 天考察性状和有关物质的变化情况。
1 仪器与试药
1.1 仪器
Agilent 1260 型高效液相色谱仪(安捷伦科技(中国)有限公司);BT25S 电子天平(赛多利斯科学仪器(北京)有限公司)
1.2 试药及试剂
盐酸司来吉兰原料 (批号:210201,99.8%,自制)、杂质A 对照品(批号:100217-200303,中检院,100%)、 杂质B 对照品(批号:190101, 自制,99.48%)、 杂质C 对照品 (批号:181202, 自制,97.2%)、杂质D 对照品(批号:171212-201605,中检院,99.9%)、杂质E 对照品(批号:181201,自制,99.40%)、 杂质F 对照品 (批号:190101, 自制,99.48%)、 杂质G 对照品 (批号:181201, 自制,95.4%)、 盐酸司来吉兰对照品 (批号:R046WO,USP,99.80%)、甘露醇(批号:TF84220301,湖南九典宏阳制药有限公司), 玉米淀粉 (批号:E4869,RoquetteFreres 罗盖特管理(上海)有限公司),微晶纤维素(批号:2173862486,DuPont Nutrition USA,Inc),聚维酮K30(批号:PK30-230301F21,衢州建华南杭药业有限公司),硬脂酸镁(批号:220814,安徽山河药用辅料股份有限公司)乙腈(色谱纯)、水(超纯水)、磷酸二氢铵(分析纯)、磷酸(分析纯)。
2 方法与结果
2.1 色谱条件
参考《中国药典》2020 年版二部盐酸司来吉兰项下有关物质方法, 确定液相色谱条件如下:C18色谱柱或效能相当的色谱柱; 流动相为0.1M 磷酸二氢铵溶液(用磷酸调pH 值至3.1);乙腈(80:20);流速1.0ml/min;检测波长205nm;运行时间40min;进样量20μL。
2.2 原辅料相容性样品制备
依据《化学药物制剂研究基本技术指导原则》[10]以及相关文献中的要求,分别称取盐酸司来吉兰原料与各辅料按照不同比例充分混匀后 (比例见表1),分别放置于高温(60℃)、高湿(75%±5%RH)、光照(光照试验的总照度不低于1.2×106Lux·hr、近紫外能量不低于200w·hr/m2)中10 和30 天后,观察性状和有关物质的变化情况,并与原料、各辅料进行平行对照研究[11-16]。

表1 原辅料相容性试验样品
2.3 溶液的制备
2.3.1 系统适用性溶液的配制
取杂质A 对照品、杂质B 对照品、杂质C 对照品、盐酸司来吉兰对照品、杂质D 对照品、杂质E对照品、杂质F 对照品和杂质G 对照品各适量,加流动相溶解并稀释制成每1mL 中各约含杂质A、杂质B、杂质C、杂质D、杂质E、杂质F、和杂质G 5μg 和盐酸司来吉兰1mg 的混合溶液,摇匀。
2.3.2 供试品溶液的配制
按上述表2 取本品细粉适量,精密称定,加流动相溶解并定量稀释制成每1mL 中含盐酸司来吉兰1㎎的溶液,摇匀,滤过,取续滤液。 另称取相对应的辅料适量,置10mL 量瓶中,加流动相振摇,滤过,取续滤液作为辅料溶液。
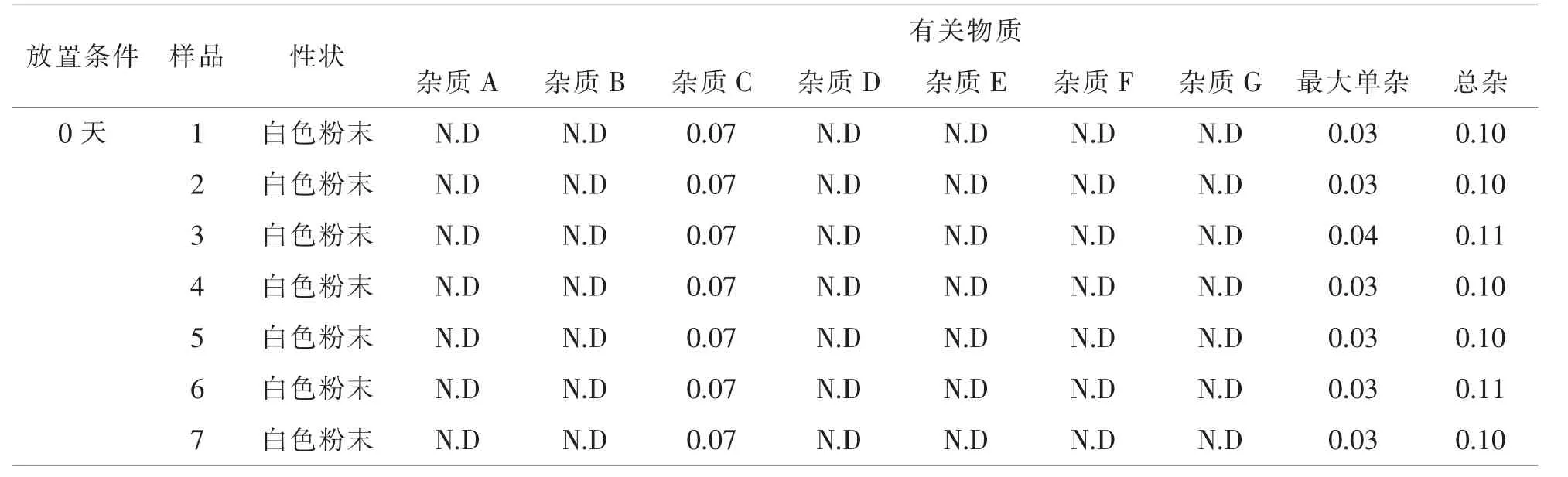
表2 原辅料相容性实验结果
2.4 系统适用性试验
取2.3.1 项下系统适用性溶液20μL,注入液相色谱仪,记录色谱图。系统适用性溶液色谱图、盐酸司来吉兰原料及混合辅料的色谱图如图2 所示。结果各峰之间分离度均大于1.5, 说明色谱系统适用性符合要求。
图2A 系统适用性色谱图
2.5 原辅料相容性实验结果
对产品外观性状进行观察,并计算其有关物质结果,试验结果见表2,结果表明,在高温、高湿、光照条件下,各样品性状均未产生变化,均未产生杂质A、杂质B、杂质G。 高温30 天样品各杂质均有少量增加。高湿条件下,样品5 杂质C、杂质D 有少量增加。 光照条件下,样品5 杂质C 有少量增加。其余样品未见明显变化。但新产生的杂质的限度均符合盐酸司来吉兰片质量标准限度要求和ICH Q3限度要求。因此说明盐酸司来吉兰与所选用的辅料相容性良好。
3 结论
从研究结果看,盐酸司来吉兰片原辅料相容性试验各辅料和原料在高温、高湿、光照条件下,各样品性状均未产生变化,均未产生杂质A、杂质B、杂质G;在高温条件下,各样品杂质均有少量增加,提示高温条件下,杂质降解速度加快,对样品稳定性可产生一定影响,但新产生的杂质的量均符合盐酸司来吉兰片质量标准要求和ICH Q3 标准要求,整体变化尚在可控范围内;在高湿条件下和光照条件下,仅样品5 的杂质量有增加,说明盐酸司来吉兰与所选用的辅料整体相容性良好。仅在处方筛选过程中需关注聚维酮K30 的用量。
自我国于2017 年加入ICH 以来,我国的药品注册及产品研发等均需要遵守ICH 的基本原则。其中Q3B(R2)和Q8(R2)均对原辅料相容性研究做出了明确的规定。而仿制药辅料的筛选应遵循尽量与原研药的辅料种类和用量一致的处方的原则,同时,所选用的辅料不应与主成分发生不良相互作用,不应影响主成分的含量及有关物质含量。 而相容性实验, 可研究药物与辅料之间是否发生反应,对处方的筛选指导意义重大,为仿制药一致性评价工作提供重要的参考依据。

