3D结核球模型的构建及特性验证:基于人髓系THP-1细胞与卡介苗
郭佳俊,邱 燕,胡 璨,李岱容,杜永洪
重庆医科大学1生物医学工程学院,2 超声医学工程国家重点实验室,3附属第一医院呼吸与危重症医学科,重庆400016
结核病(TB)是由结核分枝杆菌(MTB)引起的一种慢性传染病,是世界上最致命的传染病之一[1,2]。其发病过程中形成的结核性肉芽肿是结核病灶的中心和关键病理结构。肉芽肿为研究对MTB感染的免疫反应和拓宽我们对其的理解提供了完美的环境;然而,人类肉芽肿难以获得,体内动物模型成本高昂,并不能完全地模拟人类免疫[3]。因此,体外构建肉芽肿模型的方法需要开发和验证。
结核性肉芽肿主要以成熟的巨噬细胞为核心,是一个有组织且含有多种细胞的细胞聚集体[4]。由于细胞堆积所形成三维结构限制了氧气和营养物质等不能有效运输到肉芽肿内部,造成了肉芽肿内部的缺氧和坏死等一系列病变。过去文献报道的体外构建人结核性肉芽肿模型的方法主要在二维平面进行,如以MTB感染人外周血单个核细胞(PBMC)[5],形成的体外模型由于缺乏三维结构和扩散限制不能反应体内肉芽肿真实情况。三维模型培养揭示了单层模型所缺乏的特征,例如随着PH值、氧气和代谢梯度的发展,细胞与细胞之间复杂性的高级网络分层——成熟球体以及形成的次级坏死核心和增殖区[6]。近年来,器官芯片、类器官、细胞球等三维细胞模型技术的发展为体外构建3D模型提供了便利条件[7-9]。最新有研究报道了在3D细胞培养板中模拟肉芽肿建立了体外结核球模型,其建立简单、可扩展、单孔内形成大量球体,超过了当前体外TB模型的产量[10]。但尚未有研究探索有关结核球在三维空间形成后在微环境、药物渗透等一系列与肉芽肿相关特性方面报道。
牛减毒分枝杆菌-卡介苗(BCG)具有与MTB相似的生长特性和高度的基因同源性,同时具有很高的生物安全性,因此常常代替MTB被用于实验研究中[11]。本研究利用BCG感染人单核-巨噬细胞在3D细胞培养板中建立体外3D模型,旨在确定其在三维空间形成后的系列特征。
1 材料和方法
1.1 材料
1.1.1 实验细胞 人髓系白血病单核细胞THP-1购自上海富衡生物科技公司,BCG购自成都生物产品研究所(S20013057)。
1.1.2 主要试剂和仪器RPMI 1640 培养基,胎牛血清(富衡生物);PBS 缓冲液,青霉素-链霉素溶液(BioChannel);H2O2检测试剂盒(碧云天生物);防水型PH计(阿拉丁);7H9肉汤培养基,吐温-80,甘油,OADC增菌液(Sigma);3D 细胞培养平板和抗黏附冲洗液(STEMCELL科技);PMA,利福平(陶术);IBA-1抗体(NOVUS);二级抗体FITC 标记山羊抗兔IgG(H+L)(EARTHOX);SYTO 9/PI 荧光染色试剂盒BacLight Bacterial Viability Kit(L7012)(赛默飞);Image-iT™红色缺氧监测试剂(Thermofisher);钙黄绿素(Calcein-AM)/碘化丙啶(PI)溶液,Triton X-100(碧云天生物);左氧氟沙星(索莱宝);Middlebrok 7H10琼脂(海博生物);多功能酶标记仪器(ThermoFisher),激光共聚焦显微镜(Nikon);透射电镜(基因有限公司);ImageJ软件(美国国立卫生研究院)。
1.2 方法
1.2.1 细胞培养 THP-1细胞使用含10%胎牛血清和1%链霉素/青霉素的RPMI 1640培养基,在37 ℃恒温、5%CO2的细胞培养箱中培养至细胞到对数生长期进行实验。
1.2.2 细菌培养 将冻存的BCG 菌液接种于含10%OADC 增菌液,0.2%甘油及0.05%吐温-80的7H9 肉汤培养基中,置于37 ℃摇床中以180 r/min的转速培养至BCG 菌液的OD600=1.0 后进行实验。
1.2.3 3D结核球模型的构建 THP-1细胞通过血球计数法调整细胞浓度,BCG菌通过平板菌落计数法调整其浓度。抗黏附冲洗液处理3D细胞平板后,将细胞和细菌以感染复数(MOI)5混合后以细胞1×106每孔加入到3D细胞培养板,然后将细菌-细胞悬浮液(总体积为1000µL/孔)在1000 r/min下离心5 min后在100 ng/mL佛波酯(PMA)下培养24 h,然后更换到不含PMA的标准RPMI培养基中继续培养2 d,每天用标准的培养基进行半换液,以维持结核球的生长。3 d后将培养基溶液轻轻地移出孔中,用移液枪缓慢将球体从微孔中移出,然后用移液管取出收集到1.5 mL EP管中。在重力作用下使球体沉降30 min,轻轻移除培养基,并将球体用PBS洗涤两次,将球体进行荧光染色观察。
单纯不含BCG菌的细胞球的培养除不加入BCG菌外其余操作同上。
1.2.4 观察3D结核球内BCG菌分布 首先用SYTO 9染液对BCG进行染色。从-20 ℃冰箱取出BCG菌,菌液在10 000 r/min下离心5 min,弃去上清液,加入1 mL PBS和10 μL SYTO 9 染液,与细菌混匀,在37 ℃的恒温培养箱中孵育30 min,使得细菌标记为绿色。然后离心,将细菌沉淀重悬到1 mL标准RPMI中,后续建模时加入经SYTO 9染液标记的BCG以形成结核球,利用激光共聚焦显微镜观察结核球的大小形态和内部BCG菌的分布情况。
1.2.5 3D结核球内细胞活性检测 在BCG与THP-1细胞共培养的第3天,吸出培养板孔中培养基,加入PBS洗涤2次后将结核球体转移到细胞培养皿中,加入Calcein-AM/PI 染液,在37 ℃的恒温培养箱中孵育30 min后用激光共聚焦显微镜观察结核球内细胞存活情况。
1.2.6 结核球内单核细胞转变巨噬细胞检测 单核细胞不能表达IBA-1抗体而巨噬细胞表达,我们使用IBA-1抗体检测结核球内单核细胞向巨噬细胞转变情况。首先吸出3D培养板中培养基用PBS洗涤2次,加入4%多聚甲醛固定30 min后PBS洗涤2次,用0.1%Triton X-100 孵育30 min 后加入1%山羊血清封闭1 h 后加入IBA-1抗体孵育2 h,PBS洗涤3次后加入FITC标记二级抗体孵育1 h,PBS洗涤2次后加入DAPI染色15 min后收集结核球到细胞培养皿中用激光共聚焦显微镜观察。
1.2.7 结核球内部微观结构观察 将培养好的结核球收集到1.5 mL EP管,1500 r/min离心10 min将悬浮球体聚集后,弃去上清液,加入4%戊二醛4 ℃固定2 h,进行常规电镜样品固定、脱水和包埋,超薄切片后用于透射电镜观察。
1.2.8 结核球与细胞球微环境检测 使用Image-iT™红色缺氧探针、H2O2检测试剂盒和防水笔形PH计检测3D结核球和细胞球分别在缺氧程度,H2O2含量以及酸碱度的差异。将5µmol/LImage-iT™红色缺氧探针添加到生长培养基中,并在37 ℃下孵育60 min将样品用PBS洗涤3次后用激光共聚焦显微镜观察,同时使用Image J软件来分析和测量各实验组的荧光强度。按照H2O2检测试剂盒说明先使用H2O2检测裂解液将球体进行裂解后加入H2O2检测液反应30 min后使用酶标仪检测560 nm处的吸光度,通过H2O2标准曲线计算出其浓度。防水PH笔按照制造商说明先使用PH 7和PH 4标准液进行校正后,将电极置入结核球与细胞球培养基中并搅拌,使显示值稳定后记录其数值此即为检测液的酸碱值。
1.2.9 结核球与细胞球药物渗透检测 使用红色荧光标记的纳米粒检测3D结核球与细胞球在药物渗透情况上的差异。在实验中,待结核球和细胞球发育成形后,加入等量的红色荧光标记的纳米粒共孵育2 h,然后用PBS洗涤3次后,将球体收集到细胞培养皿中,利用激光共聚焦显微镜观察球体内纳米粒的渗透情况,并使用Image J软件来分析和测量各实验组中红色荧光强度。
1.2.10 菌落计数检测结核球评估抗菌药物抑菌能力结核球成形后加入4 μg/mL 的左氧氟沙星或利福平反应24 h后将结核球悬浮在0.05%Triton X-100裂解溶液中并在37 ℃下孵育5 min后将悬液收集在离心管中。然后将悬液在室温下以10 000 r/min离心5 min,并将其沉淀重悬在1 mL PBS中。在PBS中进行连续稀释,并在Middlebrok 7H10琼脂平板上一式3份点样100µL样品。在37 ℃恒温箱中孵育待其菌落生成后进行计数。
1.3 统计学分析
应用GraphPad Prism 9.0统计软件,计量资料以均数±标准差表示,两组比较采用t检验。P<0.05时认为差异具有统计学意义。
2 结果
2.1 体外3D结核球模型形成过程观察
利用倒置荧光显微镜每天观察结核球的形成情况,在混合接种后立刻观察到微孔中大量细胞开始聚集(图1 A),随着培养时间延长到24 h时细胞开始聚集形成球样结构(图1B),继续延长培养时间到48 h时形成的球体更加紧密但球体边缘还能观察到少量散在细胞(图1C),随着培养时间延长到72 h时观察到紧密的球体,球体边缘未见散在细胞(图1D)。
2.2 3D结核球内BCG分布情况
CLSM观察显示明场条件下能观察到由细胞堆积形成的结核球呈类圆形散分布,直径大小在50~200 μm(图2A),经SYTO 9染色后的BCG感染整个结核球,分布于细胞内部(图2B)。
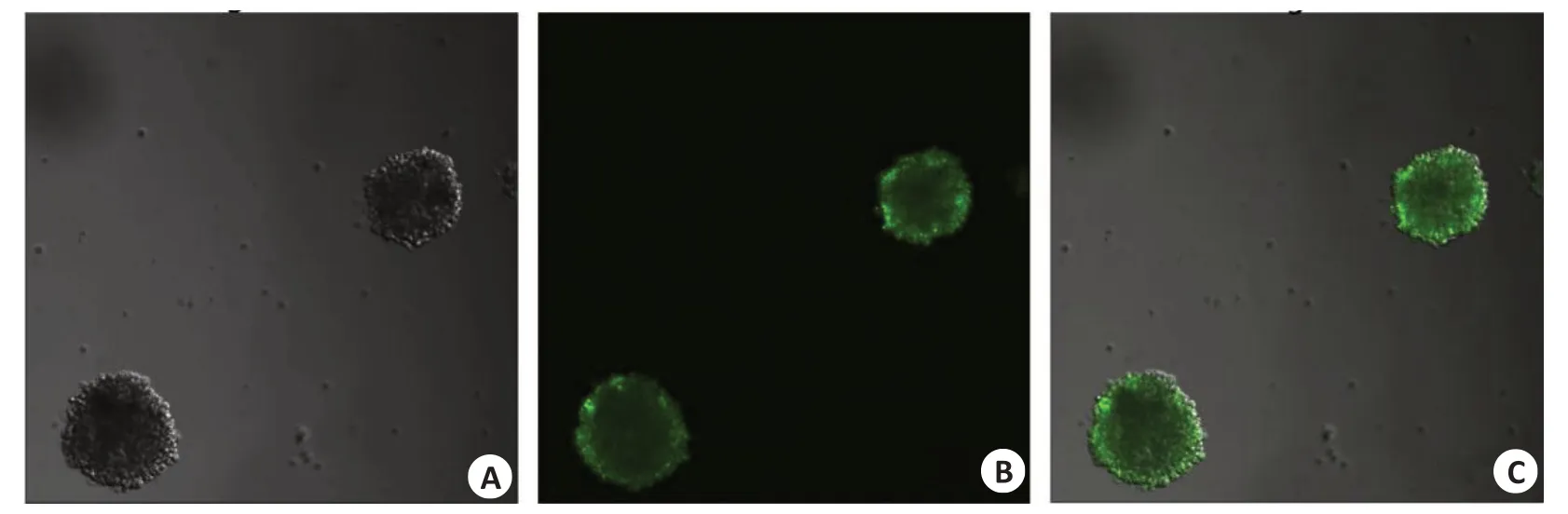
图2 3D结核球内BCG菌分布Fig.2 Distribution of BCG in 3D tuberculous spheroids.A: Diagram of a bright field of 3D tuberculous spheroids.B: Distribution of BCG in 3D tuberculous spheroids stained with SYTO 9 (laser confocal microscopy).C:Merged image ofA and B.Scale bar:100 μm.
2.3 结核球细胞活性染色观察
CLSM观察可见由于BCG感染和三维培养的限制球体内部部分细胞出现坏死显示红色荧光(图3B),另一部分细胞仍然存活显示绿色荧光(图3A),两者紧密黏附形成3D结核球。
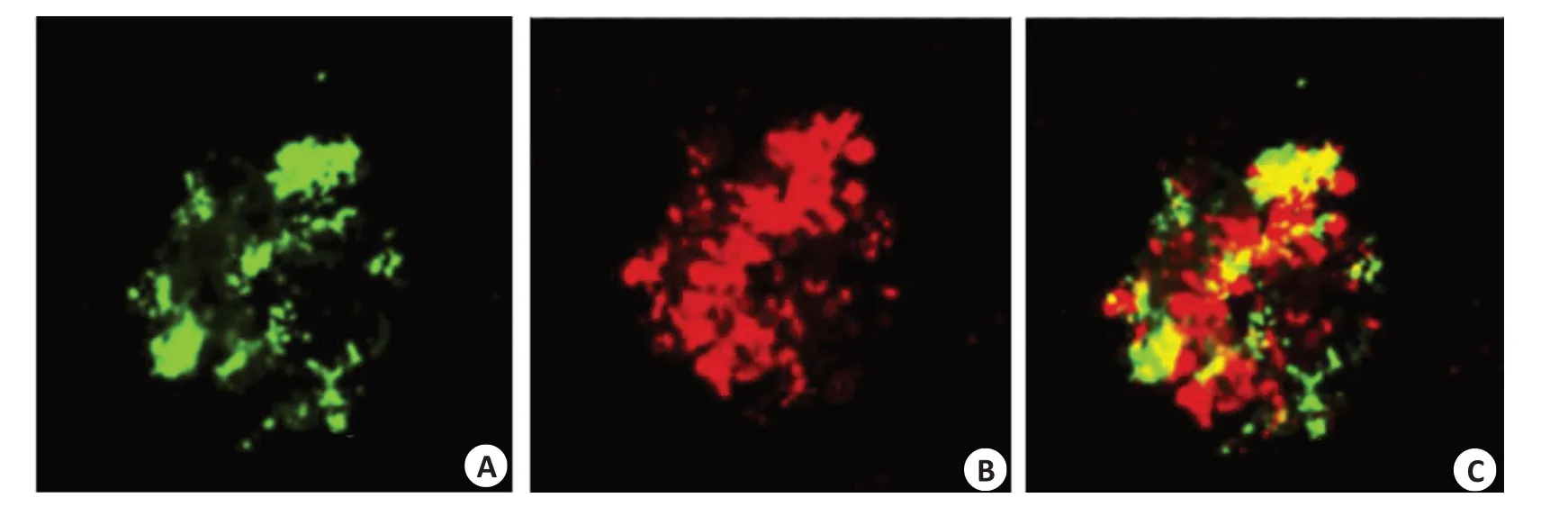
图3 3D结核球内细胞活性Fig.3 Cell viability in 3D tuberculous spheroids.A:Living Cells in 3D tuberculous spheroids.B:Dead cells in 3D tuberculous spheroids.C:Merged image ofAand B.Scale bar:100 μm.
2.4 DAPI/IBA-1免疫荧光染色观察3D结核球内单核细胞向巨噬细胞转变情况
CLSM观察显示细胞聚集形成球体,DAPI染色细胞核显示蓝色荧光(图4A),其内大部分单核细胞分化为巨噬细胞表达IBA-1抗体显示绿色荧光(图4B)。结核球模型和体内肉芽肿一致,都是以巨噬细胞为中心的细胞聚集体。
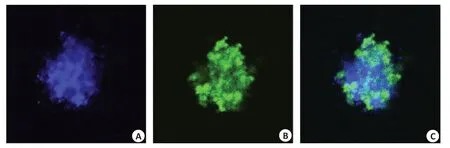
图4 3D结核球内单核细胞向巨噬细胞转变Fig.4 Transformation of monocytes into macrophages in 3D tuberculous spheroids.A: Graph of DAPI labelled cells in TB spheres.B:IBA-1 staining of macrophages in 3D TB spheroids.C:Merged image of A and B.Scale bar:100 μm.
2.5 透射电镜观察3D结核球微观结构
在透射电子显微镜下观察,细胞出现不同程度的坏死,如图5A红色箭头所指正在坏死的巨噬细胞,细胞内部大量细胞器被破坏,细胞膜开始逐渐溶解,图5A黄色箭头所指为被巨噬细胞吞噬的BCG,蓝色线框内为细胞核。图5B黑色箭头所指为严重坏死的巨噬细胞,绿色箭头所指为完全坏死的巨噬细胞,细胞完全坏死后出现大量脂滴(蓝色箭头),红色线框内是被破坏的细胞核。
2.6 3D结核球与细胞球微环境检测
CLSM观察显示,对比未受BCG感染细胞球,在结核球内Image-iT™缺氧探针显示更加强烈的红色荧光且以中心区域为主(图6A)。通过Image J软件半定量分析细胞球和结核球内红色荧光强度,结核球内中心区域红色荧光强度显著增加(P<0.01)。过氧化氢检测试剂盒,防水性PH计检测结果显示,结核球内H2O2含量显著高于细胞球(P<0.01),PH值有明显下降(P<0.05)。
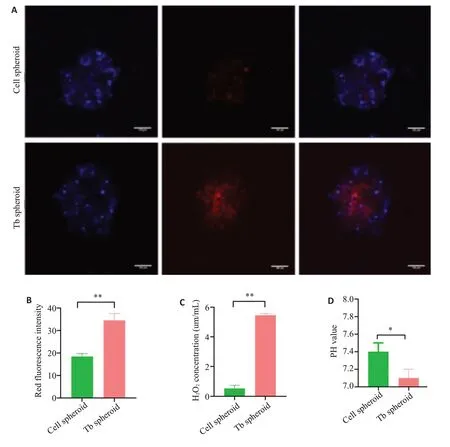
图6 3D细胞球与3D结核球内微环境Fig.6 Microenvironment within 3D cell spheroids and 3D tuberculous spheroids.A: Image-iTTM hypoxia probe detected hypoxia in 3D cell spheroids and 3D TB spheroids.Scale bar:100 μm.B:Image J Semi-quantitative analysis of the intensity of red fluorescence within 3D cell spheroids and 3D TB spheroids.C: Detection of hydrogen peroxide in 3D cell spheroids and 3D tuberculous spheroids.D:PH of 3D cell spheroids and 3D tuberculous spheroids,*P<0.05,**P<0.01.
2.7 3D结核球与细胞球药物渗透检测
CLSM观察显示在细胞球中间层面有较强的红色荧光,被红色荧光标记纳米粒难以渗透到达结核球内部(图7A)。通过Image J软件半定量分析细胞球和结核球中间层面内红色荧光强度,细胞球明显高于结核球(P<0.05,图7B)。
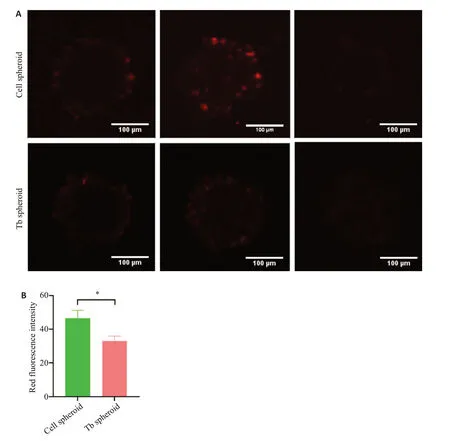
图7 3D细胞球与3D结核球内药物渗透Fig.7 Drug penetration in the 3D cell spheroids and 3D tuberculous spheroids.A: Distribution of red fluorescencelabeled nanoparticles at different levels of 3D cell spheroids and 3D tuberculous spheroids observed by laser confocal microscopy(Scale bar:100 μm).B:ImageJ semi-quantitative analysis of the intensity of red fluorescence in the middle of 3D cell spheroids and 3D tuberculous spheroids.*P<0.05.
2.8 结核球评估不同抗菌药物抑菌能力
菌落计数结果显示与未加药物组相比加入抗菌药物组菌落计数有明显差异(图8A~C)。即使在同一低浓度条件下一线抗结核药物利福平也显示更强抑菌效果,涂平板生长菌落数明显少于左氧氟沙星组(P<0.05,图8D)。

图8 平板菌落计数检测抗菌药物对3D结核球抑菌能力Fig.8 Detection of antimicrobial ability of the drugs to inhibit 3D tuberculous spheroids by plate colony counting,in which the 3D tuberculous spheroids were incubated with coated plates in the presence of RMPI medium(A),levofloxacin(B),and rifampicin(C)for 24 h.D:Plate colony count statistics,*P<0.05.
3 讨论
结核性肉芽肿是宿主免疫细胞和MTB相互作用最直接和最集中的部位,从一定程度上讲,结核性肉芽肿的发展和转归决定着TB的病程和感染结果[12,13]。由于TB的高传染性和难以获得新鲜的人类结核肉芽肿性肺组织,在患者肉芽肿水平上研究MTB发病机制的进展缓慢。目前,对MTB的免疫反应主要在原代宿主免疫细胞中进行评估,这些细胞作为传统的细胞培养物在体外培养,主要在平坦、坚硬的塑料上进行二维培养,被均匀暴露于病原体/免疫介质的传统细胞培养物已成为研究宿主免疫细胞与分枝杆菌相互作用的重要工具[3]。然而,这些非生理条件不能涵盖复杂组织微环境中细胞的关键要素,包括细胞浓度、细胞类型、细胞运动性、多细胞相互作用、细胞扩张、时空动力学和几何结构[14,15]。这些差异对疫苗开发、药物疗效和预防感染研究结果的解释和翻译构成障碍,限制了结核病研究对人类健康的影响[3]。
与传统的二维培养相比,3D培养有助于弥补体外细胞培养和体内反应之间的差距,通过更紧密地模拟自然体内环境、形状、组织硬度、应力和细胞反应,同时克服动物模型的费用和伦理忧虑等缺点[16-18],近年来该领域已成为许多学者研究的重点,如使用3D细胞培养物模拟肠道细菌感染[19];建立3D乳腺肿瘤球模型研究药物渗透[20]。最新有研究报道了在3D细胞平板中建立3D结核球模型[10],但关于其形成后的系列特征如微环境变化、药物渗透能力等仍未有任何报道。本文成功建立了结核球模型并探究了结核球形成后的系列特性。
本研究验证了通过将BCG和单核-巨噬细胞纳入3D细胞平板中能形成稳定的结核球,观察到了细胞从缓慢聚集到发育成球的过程。通过SYTO 9、Calcein-AM/PI、IBA-1染色后通过CLSM观察到了BCG对于结核球的感染、球内细胞坏死和单核细胞向巨噬细胞的分化,形成了以巨噬细胞为主的细胞聚集体,并通过透射电镜观察了球内细胞微观结构的变化和BCG被吞噬于细胞内部。已有研究报道了结核性肉芽肿主要是以巨噬细胞为中心的细胞聚集体[4],MTB主要感染巨噬细胞被吞噬于巨噬细胞内部[21]。
肉芽肿微环境异常和有效抗结核药物能否渗透到达肉芽肿中心是抗结核治疗失败的关键。本研究验证了相比于单纯细胞球,被BCG感染的结核球缺氧进一步加重并以中心缺氧为主,其内含更多的H2O2,PH有一定程度下降,药物难以渗透到达结核球内部。以往的研究表明分枝杆菌疾病和缺氧密切相关,结核性肉芽肿伴有缺氧[22],在豚鼠、兔和非人灵长类动物中形成的结核性肉芽肿中均发现了缺氧现象[23]。肉芽肿内酸化与肉芽肿内高细菌负荷相关。已有研究报道抗结核药物在肉芽肿每个微环境隔间中的渗透程度不同,且渗透性差,从而降低了药物的可获得性[24-26],本研究中建立的结核球复制了结核性肉芽肿内酸化和药物难以渗透等特性。
为研究结核球能否评估药物抗菌能力,本研究通过选用不同级别抗结核药物与结核球反应。研究结果表明相较于二线抗结核药物左氧氟沙星一线抗结核药物利福平能更好抑制结核球内分枝杆菌,结核球有评估抗结核药物强弱作用。近年来研究报道了各种球体形成技术用于中高通量药物测试应用[27,28]。我国最新发布的《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》已明确将3D 细胞模型纳入评估药物有效性和安全性的候选模型[29]。
综上所述,本研究在成功建立结核球的基础上研究了结核球形成后的一系列特征,验证了体外3D结核球在一些特性上与肉芽肿有较高一致性,为3D模型的开发和TB的研究提供新思路。本研究未能考察抗结核药物对结核球内分枝杆菌抑菌机制作用,计划在下一阶段实验深入研究。

