3种不同添加物对凡纳滨对虾生长、非特异免疫和抗病力的影响*
田相利, 秦光彩, 罗 凯, 汪仕爽, 刘 杨, 魏 聪, 王明阳, 董双林, 刘清兵
(1. 海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003; 2. 崂山实验室, 山东 青岛 266237; 3. 青岛瑞滋集团有限公司, 山东 青岛 266408)
凡纳滨对虾(Litopenaeusvannamei)俗称南美白对虾,自20世纪80年代末期引进中国以来,已成为我国最主要的养殖对虾种类之一[1]。中国凡纳滨对虾养殖业从沿海发展到内陆,从土塘发展到工厂集约化,已经形成了跨地域、跨时间、高度集中的产业模式。然而,随着对虾养殖业的规模化、集约化发展,对虾病害也频繁爆发,给对虾养殖业带来了严重损失,这成为对虾养殖业可持续发展的主要制约因素[2]。益生菌作为一种控制多种水生动物疾病的饲料添加剂,通过促进水生动物生长、提高免疫反应、提高饲料利用率和消化酶活性、改善水质等来发挥益生作用,益生菌在水产养殖中具有广泛的应用前景[3-4]。
丁酸梭菌(Clostridiumbutyricum)是目前研究较多的产丁酸细菌之一,是一种厌氧革兰氏阳性梭状芽孢杆菌[5]。作为一种广受关注的水产益生菌,丁酸梭菌被证实具有提高肠道消化酶活性和抗应激能力、调节肠道菌群组成、拮抗病原菌等作用[6-7]。丁酸梭菌的主要代谢物丁酸是水产养殖中研究较多的短链脂肪酸之一。研究表明,丁酸不仅能够有效促进动物生长[8],同时在保护动物肠道屏障,提高肠道免疫功能,调控肠道微生态环境及维持肠道微生态平衡等方面也发挥着重要的作用[9]。不过,由于丁酸易挥发、气味酸臭、动物适口性较差等问题,其在水产饲料中一般以丁酸盐或丁酸酯的形式添加[10],例如丁酸钠,其在肠道中水解后产生丁酸。研究表明,丁酸钠能够调节肠道健康、促进营养物质吸收、提高饲料利用率和养殖动物的生长[11]。聚β-羟基丁酸酯(Poly-β-hydroxybutyrate, PHB),为短链脂肪酸β-羟基丁酸的聚合物,在动物肠道中可被降解为水溶性的β-羟基丁酸单体,从而发挥短链脂肪酸作用[12]。研究表明,PHB可促进水生动物的生长、提高存活率、增强抗病力、调控水质等[13]。尽管益生菌的作用与功效在水产养殖业中已得到广泛认可,但在一些特定条件下,作为活菌形式使用的益生菌却存在一定的不便或难度。例如,在对虾饲料生产中,由于高温和膨化等生产条件,直接添加丁酸梭菌活菌在技术上难度较大。因此,在使用益生菌的同时,近年来人们也在寻求在饲料生产中添加丁酸盐及相关化合物等更容易使用的添加物以替代丁酸梭菌活菌。
迄今为止,关于饲料中添加丁酸梭菌、聚β-羟基丁酸酯和丁酸钠对凡纳滨对虾影响的比较研究尚少见报道。本研究参考前人的相关研究,设计了向对虾饲料中分别添加1×1011cfu·kg-1丁酸梭菌CBG01活菌、3%聚β-羟基丁酸酯和1%丁酸钠,对比了这3种添加物对凡纳滨对虾的生长性能、非特异性免疫指标和抗病力的影响,本研究不仅可为3种添加物在凡纳滨对虾养殖中的合理应用提供参考,也可有助于益生菌作用机理的深入解析。
1 材料与方法
1.1 实验菌株与实验设计
丁酸梭菌(C.butyricum)CBG01由中国海洋大学水产养殖生态实验室微生物保种中心提供。养殖实验开始前,把丁酸梭菌CBG01接种至加强培养基(葡萄糖1 g、酵母提取物0.5 g、胰蛋白胨1 g、牛肉浸膏0.5 g、硫酸铵0.1 g、硫酸镁0.05 g、磷酸二氢钾0.4 g、硫酸锰0.02 g、氯化钠0.2 g、碳酸钙0.1 g和蒸馏水100 mL)中,置于厌氧培养箱中37 ℃条件下活化培养24 h;其次将培养物在10 000 r·min-1(4 ℃)条件下离心20 min,菌体用无菌生理盐水配制成1×1010cells·mL-1的菌悬液备用;最后参考Li等[14]的实验结果设计丁酸梭菌活菌菌体的使用剂量。
聚β-羟基丁酸酯(PHB)购自宁波天安生物材料有限公司(中国宁波),有效成分为98%,PHB的使用剂量参照Duan等[15]和张月[16]的研究结果。
丁酸钠购自青岛根源生物技术有限公司(中国青岛),有效成分为98%,丁酸钠的使用剂量参照张晓晓等[17]的实验结果。
本实验共设计3个处理组(1×1011cfu·kg-1丁酸梭菌活菌,CB;3%聚β-羟基丁酸酯,PHB;1%丁酸钠,BS)和1个对照组(DZ),每个组设置5个重复。
1.2 饲料制备
基础饲料为购自青岛正大农业发展有限公司(中国青岛)的商品饲料,主要成份如表1所示。实验饲料分为丁酸梭菌添加组(CB组,基础饲料中添加1×1011cfu·kg-1丁酸梭菌CBG01活菌),PHB添加组(PHB组,基础饲料中添加3% PHB),丁酸钠添加组(BS组,基础饲料中添加1%丁酸钠)和对照组(DZ组,基础饲料)。分别将丁酸梭菌、聚β-羟基丁酸酯、丁酸钠均匀喷洒在对虾饲料上,之后用鱼油和海藻酸钠溶液混合包裹[14],对照组饲料则直接将海藻酸钠和鱼油包裹在添加等量无菌生理盐水的商品饲料表面,置于通风处阴干,4 ℃保存备用。为保证饲料中活菌的含量以及活菌的活力,所有饲料在制备后的2 h内完成投喂。
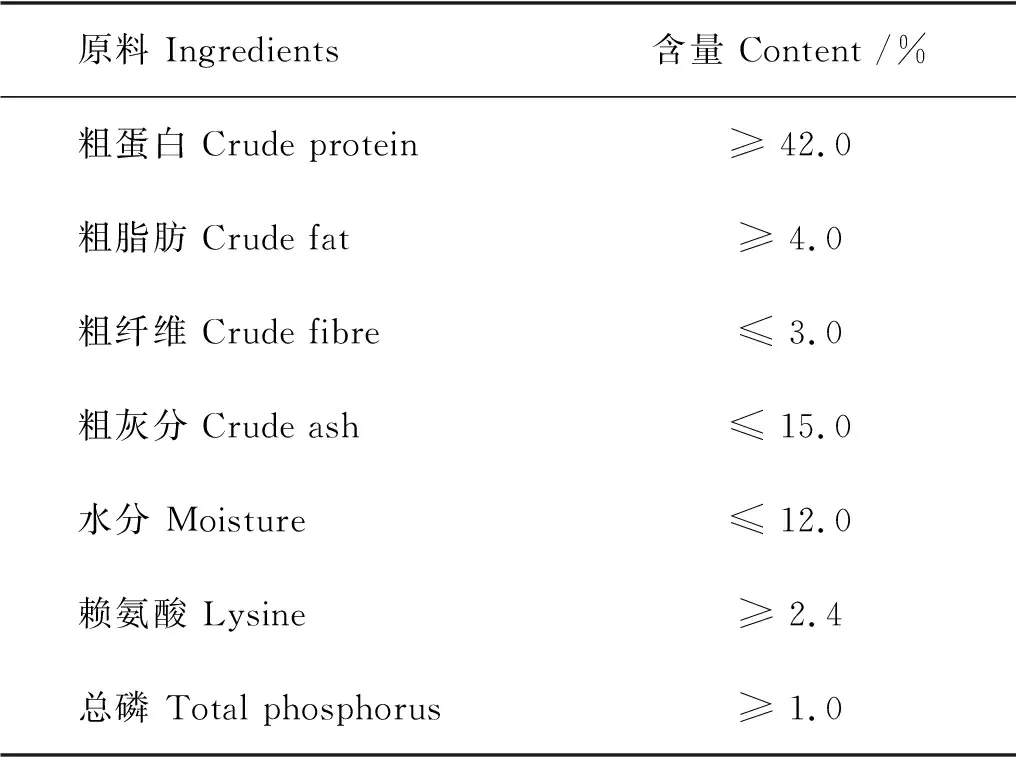
表1 基础饲料的营养成分
1.3 实验对虾与养殖实验
实验所用凡纳滨对虾来自青岛正大农业发展有限公司(中国青岛)。由于原养殖场养殖对虾的海水盐度为23,而本实验所用海水盐度为31,因而在暂养期间将养殖海水盐度每日升高2,直至升到31,并继续暂养14 d, 每天以虾体体质量5%的比例饲喂基础饲料(见表1)。暂养与驯化结束后,对虾饥饿24 h,随后挑选健康、规格整齐的凡纳滨对虾300尾(平均体长(5.92±0.21) cm,平均体质量(3.02±0.13) g),随机均匀分配到20个水族箱(53 cm× 28 cm× 34 cm,50 L)中。对虾养殖实验在青岛瑞滋集团有限公司的养殖场进行,养殖周期为6周。
对虾养殖期间,每天8:00、12:00、16:00和20:00进行投喂。每日总投喂量为对虾体质量的8%。每次喂食1 h后用虹吸管收集残饵和粪便,且在每次投喂和换水之前都要再次收集,收集后用水冲洗2~3次,60 ℃烘干并称重。每日上午换水1次,每次换水量为1/3。对虾养殖期间水质条件设置如下:温度25~28 ℃,盐度28~31,pH 7.8~8.0,溶氧量>5 mg·L-1。
1.4 样品采集
养殖结束后,将各组所有的凡纳滨对虾统一进行饥饿处理24 h并进行称重记录。从每个水族箱中随机抽取6尾对虾,每个处理组共抽取30尾虾,采集对虾的血液和肝胰腺。用无菌注射器采集血液并置于2 mL的灭菌离心管中,4 ℃保存24 h后以3 000 r·min-1转速离心10 min,收集血清,-80 ℃保存。用消毒的剪刀和镊子采集对虾肝胰腺样品,样品剪碎后置于含有RNA保护液的灭菌离心管中,4 ℃静置12 h后,转到-80 ℃冰箱保存。
1.5 指标测定
1.5.1 对虾生长指标 对虾饥饿处理1 d后,将每个水族箱中对虾的初末体质量进行称重记录。计算对虾的成活率、特定生长率及饲料效率的公式[18-21]如下:
成活率(SR)=(Nt/N0)×100%;
特定生长率(SGR)=[(lnWt- lnW0)/T] × 100%;
饲料效率(FER)=(Wt-W0)/WF× 100%。
式中:N0和Nt分别表示凡纳滨对虾初始数量和终末数量(尾);W0和Wt分别表示凡纳滨对虾的初始体质量和终末体质量(g);T为养殖实验周期(d);WF表示养殖实验期间饲料投喂量(g)。
1.5.2 血清非特异性免疫参数和抗氧化能力 使用南京建成生物工程研究所(中国南京)的商业检测试剂盒测定以下免疫参数:对虾血清中的碱性磷酸酶(Alkaline phosphatase, AKP)、酸性磷酸酶(Acid phosphatase, ACP)、总一氧化氮合酶(Total nitric oxide synthase, T-NOS)、溶菌酶(Lysozyme, LZM)、过氧化物酶(Peroxidase, POD)、超氧化物歧化酶(Superoxide dismutase, SOD)活性、总抗氧化能力(Total antioxidant capacity, T-AOC)和酚氧化酶(Phenoloxidase, PO)含量[18-21]。
1.5.3 肝胰腺中免疫相关基因 使用Trizol试剂从对虾肝胰腺中提取总RNA,利用PrimeScriptTMRT试剂盒(Takara, 日本)将总RNA反转录为cDNA,然后使用QuantStudioTM5 Real-time PCR系统(应用生物系统公司,美国)进行实时定量RT-qPCR检测免疫相关基因的相对表达量。具体指标包括超氧化物歧化酶基因、酚氧化酶原基因、溶菌酶基因、热休克蛋白70基因、β-1,3-葡聚糖结合蛋白基因(LGBP)、Toll、Relish、免疫缺陷(Imd)基因、雷帕霉素靶蛋白基因(TOR)、真核翻译起始因子4E基因(eIF4E)及其结合蛋白基因(4E-BP)。根据Luo等[19]的PCR扩增程序与引物序列进行qPCR扩增,采用2-ΔΔCt相对定量法,计算饲粮中添加丁酸梭菌、PHB和丁酸钠后对虾肝胰腺中免疫相关基因的相对表达水平。
1.5.4 攻毒实验 样品采集完毕后,以正常饲养条件继续饲喂剩余的凡纳滨对虾5 d,随后用副溶血弧菌(Vibrioparahaemolyticus)进行攻毒。副溶血弧菌由中国海洋大学水产养殖生态实验室微生物保种中心提供,活化培养参考王明阳等[21]的方法。根据预实验结果,第14天的LC50(半数致死浓度)为8.3×108cfu·mL-1,即为副溶血弧菌的注射浓度。每个处理组随机挑选21尾凡纳滨对虾进行攻毒实验。每个实验组设置3个重复,每个重复放置7尾对虾。14 d攻毒实验后,统计对虾的累积死亡率。
1.6 数据统计与分析
使用SPSS 22.0软件进行统计学分析。经正态性、同质性和独立性检验后,所有数据均采用单因素方差分析(one-way ANOVA)分析和Tukey’s多重比较分析。用平均值±标准误(Mean±S.E.)展示统计结果,P<0.05表示组间存在显著性差异。
2 结果
2.1 对虾生长性能
饲料中添加丁酸梭菌活菌(CB)、聚β-羟基丁酸酯(PHB)和丁酸钠(BS)对凡纳滨对虾生长性能的影响如表2所示。CB组对虾末体质量和特定生长率均最高,显著高于BS组和DZ组(P<0.05),与PHB组间差异不显著(P>0.05)。PHB组对虾末体质量和特定生长率均显著高于DZ组(P<0.05),与BS组间不存在显著差异(P>0.05),BS组与DZ组间的末体质量和特定生长率差异也不显著(P>0.05)。CB组、PHB组和BS组对虾成活率和饲料效率均显著高于DZ组(P<0.05),其中,CB组饲料效率最高,BS组成活率最高。
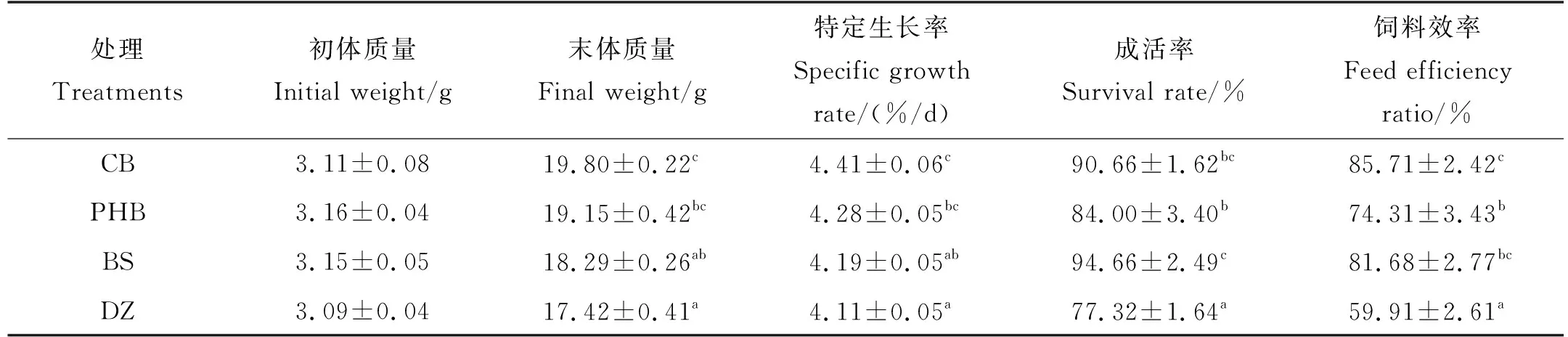
表2 凡纳滨对虾的生长情况和存活率
2.2 对虾血清非特异性免疫指标
饲料中添加丁酸梭菌活菌(CB)、聚β-羟基丁酸酯(PHB)和丁酸钠(BS)对凡纳滨对虾血清非特异性免疫指标的影响如图1所示。
CB组对虾血清中碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性,酚氧化酶(PO)含量以及总抗氧化能力(T-AOC)均显著高于DZ组(P<0.05),其中,AKP和SOD活性显著高于其他3组(P<0.05)。
PHB组对虾血清中AKP、ACP、总一氧化氮合酶(T-NOS)、LZM、POD、SOD活性以及T-AOC均显著高于DZ组(P<0.05),其中,ACP活性显著高于其他3组(P<0.05)。
BS组对虾血清中ACP、LZM、POD、SOD活性以及T-AOC均显著高于DZ组(P<0.05),其中POD活性和T-AOC显著高于其他3组(P<0.05)。
2.3 SOD、LZM、proPO、LGBP和HSP70基因相对表达水平
饲料中添加丁酸梭菌活菌(CB)、聚β-羟基丁酸酯(PHB)和丁酸钠(BS)对凡纳滨对虾肝胰腺SOD、LZM、proPO、LGBP和HSP70基因相对表达水平的影响如表3所示。CB组、PHB组和BS组对虾肝胰腺中SOD、LZM、LGBP和HSP70基因相对表达量均显著高于DZ组(P<0.05),且各处理组间差异不显著(P>0.05)。CB组对虾肝胰腺中proPO基因相对表达量最高,显著高于BS组和DZ组(P<0.05),而与PHB组相比则不存在显著差异(P>0.05)。
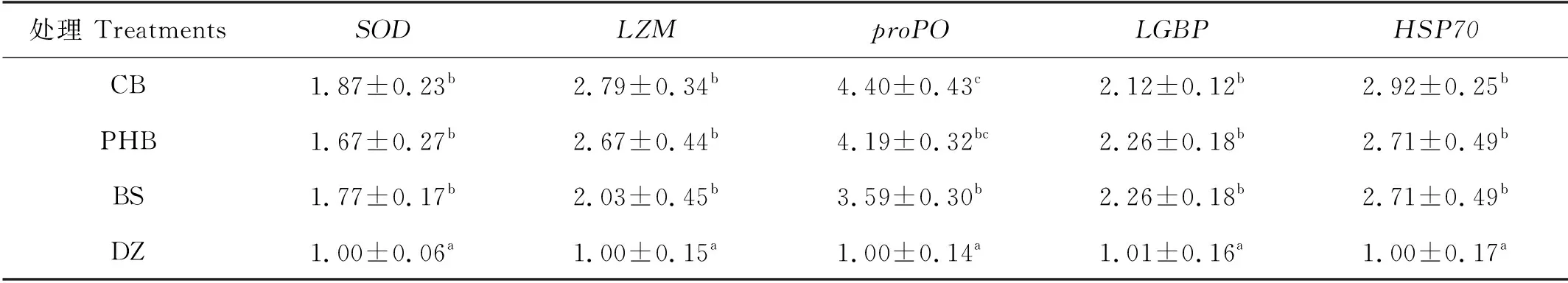
表3 凡纳滨对虾肝胰腺中SOD、LZM、proPO、LGBP和HSP70基因的相对表达量
2.4 Imd、Toll和Relish基因相对表达量
饲料中添加丁酸梭菌活菌(CB)、聚β-羟基丁酸酯(PHB)和丁酸钠(BS)对凡纳滨对虾肝胰腺Imd、Toll和Relish基因相对表达量的影响如图2所示。PHB组对虾肝胰腺中Imd基因相对表达量最高,显著高于BS组和DZ组(P<0.05),与CB组间差异不显著(P>0.05)。CB组对虾肝胰腺中Imd基因相对表达量显著高于DZ组(P<0.05),与BS组间差异不显著(P>0.05)。CB组对虾Toll基因相对表达量显著高于DZ组(P<0.05),但与其他两处理组间差异不显著(P>0.05),PHB组和BS组对虾肝胰腺中Toll基因相对表达量与DZ组间差异也不显著(P>0.05)。CB组和PHB组对虾肝胰腺中Relish基因相对表达量显著高于DZ组(P<0.05),而与BS组间不存在显著差异(P>0.05),BS组与DZ组间Relish基因相对表达量差异也不显著(P>0.05)。
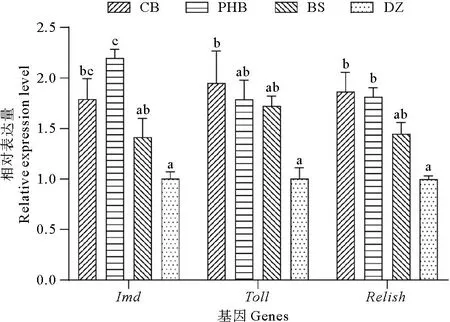
图2 凡纳滨对虾肝胰腺中Imd、Toll和Relish基因的相对表达量
2.5 mTOR信号通路相关基因的表达
饲料中添加丁酸梭菌活菌(CB)、聚β-羟基丁酸酯(PHB)和丁酸钠(BS)对凡纳滨对虾肝胰腺mTOR信号通路相关基因的表达的影响如图3所示。CB组、PHB组和BS组对虾肝胰腺中TOR、4E-BP和eIF4E1α基因相对表达量均显著高于DZ组(P<0.05),另外,PHB组对虾肝胰腺中TOR、4E-BP和eIF4E1α基因相对表达量显著高于BS组(P<0.05)。CB组对虾TOR基因相对表达量显著高于BS组(P<0.05),而4E-BP、eIF4E1α和eIF4E2基因相对表达量与BS组间差异不显著(P>0.05)。CB组和PHB组对虾肝胰腺中eIF4E2基因相对表达量显著高于DZ组(P<0.05),而BS组与DZ组间差异不显著(P>0.05)。
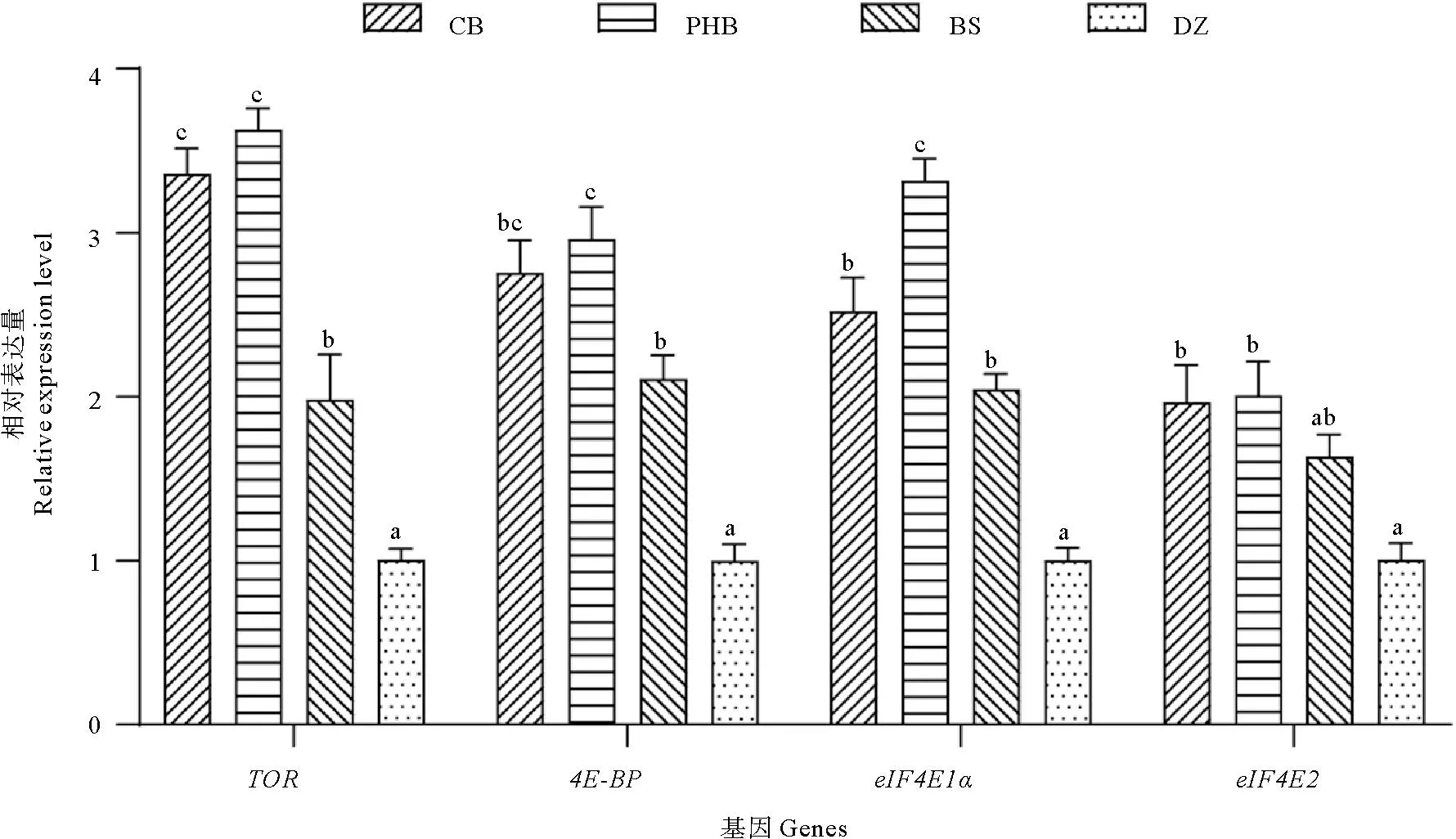
图3 凡纳滨对虾肝胰腺中mTOR信号通路相关基因的相对表达量
2.6 抗病力
如图4所示,经副溶血弧菌攻毒后,对照组对虾累计死亡率显著高于CB组、PHB组和BS组(P<0.05),而3处理组间差异不显著(P>0.05)。
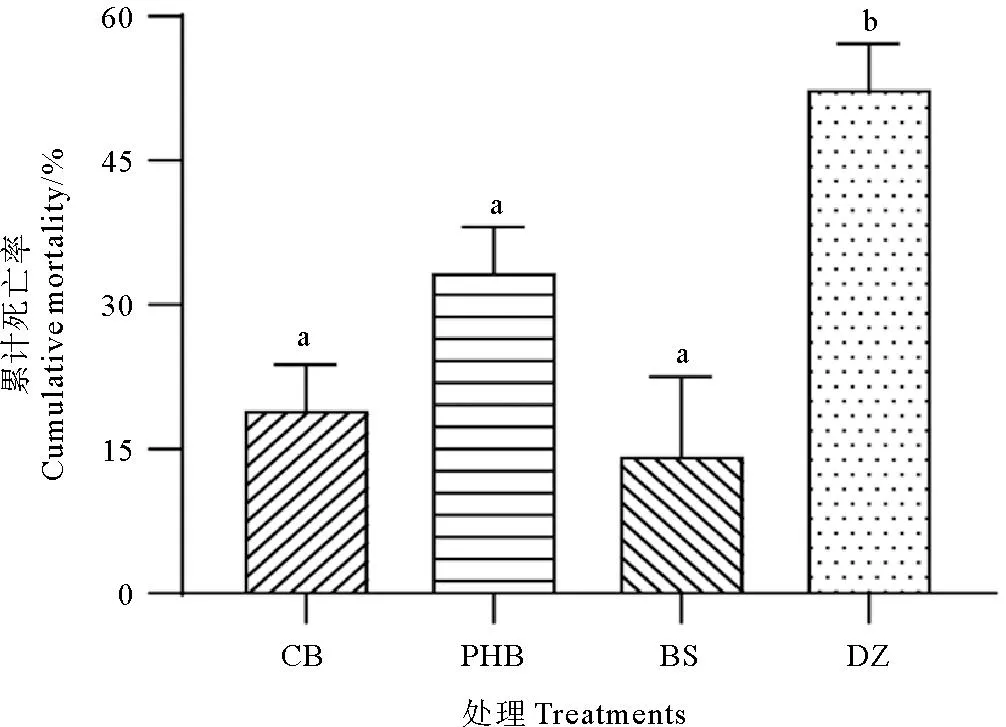
图4 饲料中添加丁酸梭菌活菌、3%聚β-羟基丁酸酯和1%丁酸钠对副溶血弧菌感染后凡纳滨对虾累计死亡率的影响
3 讨论
3.1 生长指标
近年来,作为一类效果优良、绿色环保的饲料添加剂,益生菌日益受到广泛关注。益生菌不仅可提高养殖对象的生长性能,具有调控养殖水体水质和提高宿主免疫力及抗病力的潜力[22-23],还可通过与致病菌竞争生存环境等机制来抑制致病菌的繁殖,从而提高水产动物的成活率[24]。进一步研究表明,益生菌能通过影响肠道细菌群落的种间相互作用促进宿主肠道菌群的稳态,进而提高肠道的营养消化能力[25]。在种类繁多的益生菌中,丁酸梭菌对水生动物生长和健康的有益作用已得到验证与认可。相关研究发现,饲料中添加适宜浓度的丁酸梭菌可有效促进部分养殖动物的生长,涉及的种类包括凡纳滨对虾[26]、吉富罗非鱼(Oreochromisniloticus)[5]、日本囊对虾(Marsupenaeusjaponicus)[27]等。与此同时,国内外对于与丁酸梭菌主要的代谢产物丁酸相关的丁酸盐、丁酸酯及丁酸聚合物等作为抗生素替代的环保型饲料添加剂的功能与作用也进行了较多研究,例如丁酸钠、三丁酸酯和聚β-羟基丁酸酯等[28-32]。有研究表明,聚β-羟基丁酸酯和丁酸钠单独使用或者与其他丁酸衍生物联合使用可有效提高梭鱼(Lizahaematocheila)[28]、中华绒蝥蟹(Eriocheirsinensis)[29]、西伯利亚鲟(Acipenserbaerii)[30]、黄颡鱼(Pelteobagrusfulvidraco)[31]、草鱼(Ctenopharyngodonidellus)[32]等水生动物的生长和饲料利用率。不过目前为止,关于丁酸梭菌、丁酸钠和聚β-羟基丁酸酯3种添加物对凡纳滨对虾生长性能影响的比较研究尚未见报道。在本研究中,饲料中添加丁酸梭菌和PHB后凡纳滨对虾的末体质量、特定生长率和饲料效率均显著高于对照组,但添加丁酸钠组对虾的末体质量和特定生长率与对照组相比未见显著差异。这一结果表明,添加丁酸梭菌对凡纳滨对虾生长促进作用要明显优于添加丁酸钠,但与添加PHB的效果基本相当。
3.2 血清非特异性免疫酶活性
一般认为,对虾多依靠其非特异性免疫系统来抵御外来病原微生物的入侵[33]。当受到入侵时,对虾的模式识别蛋白或受体(PRPs)与病原体相关分子模式(PAMPs)识别并结合,如肽聚糖(PG)、脂多糖(LPS)和β-1, 3-葡聚糖(βG),然后激活各种免疫反应[34]。对虾体内会产生一些免疫分子如抗菌肽、酚氧化酶、氧化酶和Toll受体等[35]。其中,酚氧化酶执行黑化作用,并由酚氧化酶原(proPO)级联控制,在无脊椎动物免疫系统中发挥重要作用,使其能够对病原体感染做出快速反应,而β-1,3-葡聚糖结合蛋白(LGBPs)则是 proPO级联的模式识别蛋白(PRPs)[36]。其他免疫成分,如碱性磷酸酶(AKP)和酸性磷酸酶(ACP)是溶酶体中的主要水解酶,在甲壳类动物的免疫系统中也起着至关重要的作用,是先天免疫的第一道防线[37]。此外,对虾中的抗氧化酶系统(如超氧化物歧化酶(SOD)、过氧化物酶(POD)和谷胱甘肽等)可以保护细胞免受氧化应激的影响[37-38]。总抗氧化能力(T-AOC)被认为是评估抗氧化酶系统抗氧化状态的重要指标[39]。由于具有较高的氧化能力,NO可以激活机体的免疫功能,而NO的产生依赖一氧化氮合酶(NOS)的作用,NO和NOS活性在对虾的防御系统中起着重要作用[40-41]。本研究中,与对照组相比,添加丁酸梭菌处理组的对虾血清中AKP、ACP、LZM、POD、SOD活性、T-AOC和PO含量均显著提高,添加PHB处理组的对虾血清中AKP、ACP、T-NOS、LZM、POD、SOD活性以及T-AOC有所升高,丁酸钠处理组中ACP、LZM、POD、SOD活性和T-AOC也有所提高。这与以往的研究相似,例如,饲料中添加适宜浓度的丁酸梭菌可提高凡纳滨对虾中LZM、AKP、ACP、SOD等活性和T-AOC[42];添加3%PHB显著提高了凡纳滨对虾中T-AOC和诱导型一氧化氮合酶(iNOS)等酶活性,而添加1%、3%和5%PHB均可显著提高对虾中NO含量[15];饲料中添加适宜浓度的丁酸钠可提高凡纳滨对虾的AKP活性和PO含量[43]。在本研究中,与对照组相比,3个处理组的POD、SOD活性和T-AOC均显著提高,说明3种添加物均可在一定程度上提高凡纳滨对虾的抗氧化能力。但3种添加物间相比较,其作用效果存在一定的差异。丁酸梭菌处理组的对虾血清AKP和SOD活性及PO含量最高;而添加PHB处理组的ACP、T-NOS和LZM活性最高,丁酸钠处理组则是POD活性和T-AOC最高。总体而言,3种添加物均可一定程度提高凡纳滨对虾非特异免疫相关酶活性,其中添加丁酸梭菌和PHB效果优于添加丁酸钠,更有助于对虾抗应激能力的提升。
3.3 肝胰腺组织免疫相关基因表达水平
甲壳动物主要依靠先天免疫系统进行自身防御,主要包括细胞免疫和体液免疫两大类[44-45]。体液免疫包括对微生物的识别、信号转导(如Toll通路、IMD通路、JAK/STAT通路)以及免疫效应物的产生[46]。Toll通路和IMD通路是调控抗菌肽基因表达的重要信号通路。其中,Toll通路在对革兰氏阳性细菌和真菌的反应中发挥关键作用,而IMD信号优先介导对革兰氏阴性菌的先天免疫[46-47]。信号通路激活导致核转录因子NF-κB进入细胞核,最终诱导免疫效应分子如抗菌肽的表达,Relish则是NF-κB家族成员之一[48-49]。另外,mTOR(mechanistic target of rapamycin)信号通路在营养调节和细胞发育中发挥着重要作用,并广泛存在于真核生物、食物摄入和环境应激等过程中[47]。其中,mTORC1(mechanistic target of rapamycin complex 1)是代谢的主要调节因子,通过真核翻译起始因子4E(eIF4E)结合蛋白1(4E-BP1)和S6激酶的磷酸化促进翻译[50]。eIF4E蛋白家族由eIF4E1, eIF4E2和eIF4E3组成[51],其活性受4E-BPs的调控[52]。本研究中,添加丁酸梭菌后对虾肝胰腺所有的免疫相关基因(SOD、LZM、LGBP、HSP70、Imd、Toll、Relish、TOR、4E-BP、eIF4E1α、eIF4E2)的相对表达量均显著上调。相比较,PHB添加组中的对虾肝胰腺Toll基因与丁酸钠添加组中的Imd、Toll、Relish、eIF4E2基因的表达水平与对照组相比未见显著差异。综合比较发现,添加丁酸梭菌和PHB均对凡纳滨对虾免疫相关基因的表达有较好的促进作用,饲料中添加丁酸梭菌和PHB可以有效诱导免疫相关基因的表达,进而提高凡纳滨对虾的免疫能力。添加丁酸钠也可以促进免疫相关基因的上调,但其作用效果在一定程度上要弱于添加丁酸梭菌和PHB。当然,关于三者对凡纳滨对虾免疫相关基因表达的影响差异的原因还值得进一步研究。
3.4 抗病力
随着水产养殖业的快速发展,各种细菌、病毒、真菌和寄生虫性疾病不断出现,造成了严重的经济损失[53]。其中,细菌性疾病被认为是水产养殖动物最主要的致病因素之一[54],而弧菌则是海水养殖动物主要的条件性致病菌,包括副溶血弧菌(V.parahaemolyticus)、哈维氏弧菌(V.harveyi)、创伤弧菌(V.vulnificus)等[55-56]。尤其副溶血弧菌,可引起急性肝胰腺坏死综合征(AHPNS)或早期死亡综合征(EMS),对对虾具有较高致死率[57]。益生菌可通过与病原菌竞争结合位点和营养物质、产生抑菌物质、调节免疫指标等方式来提高宿主的抗病力[24]。因此,通过合理添加益生菌,提高对虾免疫力和抵抗力,是目前对虾健康养殖管理的主要对策之一。研究表明,饲料中添加适宜浓度的丁酸梭菌或PHB可提高养殖动物对副溶血弧菌[14]、维氏气单胞菌(Aeromonasveronii)[58]、爱德华氏菌(Edwardsiellaictaluri)[59]、鳗弧菌(V.anguillarum)[29]等病原菌的抗病力。丁酸钠也可以在一定程度上降低养殖动物被白斑综合症病毒(WSSV)感染后的死亡率[60]。在本研究中,添加丁酸梭菌、PHB和丁酸钠均显著降低了副溶血弧菌攻毒时凡纳滨对虾的死亡率,但在提高对虾对副溶血弧菌抵抗力效果上未见显著差异。
4 结论
饲料中添加丁酸梭菌、PHB和丁酸钠均可不同程度提高凡纳滨对虾的生长性能和非特异免疫能力,能够显著提高对虾对副溶血弧菌感染的抵抗力。综合比较,添加丁酸梭菌和PHB的作用效果基本相当,在一定程度上优于添加丁酸钠。因此,在饲料生产加工过程中难以添加丁酸梭菌活菌的情况下,建议适当添加聚β-羟基丁酸酯作为丁酸梭菌的替代品。
- 中国海洋大学学报(自然科学版)的其它文章
- 副溶血弧菌现场检测系统的研发及应用*
- 两类厄尔尼诺事件对次年山东夏季降水的影响研究*

