副溶血弧菌现场检测系统的研发及应用*
李 琪, 高 倩, 田 浩, 石 超**
(1. 青岛大学生命科学学院, 山东 青岛266071; 2. 青岛大学基础医学院, 山东 青岛 266071)
副溶血弧菌(Vibrioparahaemolyticus)是一种兼性厌氧型的革兰氏阴性嗜盐菌,于1950年首次被分离得到[1]。该菌在电子显微镜下呈现多种形态,如杆状、弧状[2],在不同的培养基上细菌的形态也会有所差异。副溶血弧菌能在含盐量3%的环境中生长,广泛分布于海洋环境中,其可以引起海水中的鱼类、贝类等快速死亡,造成严重的经济损失[3]。副溶血弧菌是海水养殖里常见的病原菌,也是常见的引起食源性疾病的主要病原菌之一。副溶血弧菌可以产生耐热直接溶血素(Thermpstable direct hemolysin, TDH)、不耐热溶血素(Thermolabile hemolysin, TLH)、耐热直接相关溶血素(TDH-related hemolysion, TRH)等毒素,其中TRH和TDH会引起宿主溶血、腹泻等症状[4-6]。近年来,食品安全事故频发,人们对食品安全越来越重视,亟需开发一种快速、准确、操作简单、成本低、可现场检测的食源性病原体检测系统,这对促进食品安全的发展具有深远的意义[7-9]。
为了满足现场快速检测副溶血弧菌的需求,本文研发了一种基于LAMP方法和电化学技术的副溶血弧菌检测系统,通过实时检测反应体系的pH变化,搭配高度集成的检测系统,自动分析实验数据,可以对样本中副溶血弧菌进行定性和定量分析,在30 min内得出检测结果。
1 材料与方法
1.1 材料和实验仪器
实验所用的副溶血弧菌为实验室保存菌种,引物由上海生工生物公司合成,Bst2.0 DNA聚合酶、SYBR Green、dNTP、DNA Loading Buffer购自NEB生物公司,细菌DNA提取试剂盒购自天根生化科技公司,丝网印刷电极(工作电极和对电极为碳,参比电极为Ag/AgCl)购自本地厂家,其余常见材料购自麦克林公司。
1.2 核酸提取
将副溶血弧菌菌株接种于LB固体培养基中,37 ℃培养14 h,挑出单菌落,接种在10 mL的LB液体培养基中,放置于37 ℃的恒温摇床中,转速为180 r/min,培养14 h。将菌液按照10倍梯度进行稀释,使用平板涂布法对菌液浓度进行检测,测得上述菌液浓度为1×108CFU/mL。将上述菌液用细菌DNA提取试剂盒进行DNA提取,得到副溶血弧菌的DNA溶液。
1.3 琼脂糖凝胶电泳
称取0.4 g的琼脂糖,加入锥形瓶中,缓慢加入20 mL的1×TAE溶液,轻轻摇晃锥形瓶。放置于微波炉中,加热3 min,直到溶液透明。在上述溶液中加入2 μL的核酸染料,轻轻摇匀后,倒入凝胶模具中,室温放置30~40 min,直到琼脂糖凝胶凝固。将DNA Loading Buffer和待测产物按照1∶5的体积比例混合后,加入琼脂糖凝胶中的点样孔中。电泳电压设置为100 V,时间设置为40 min。电泳结束后,使用凝胶成像仪观察结果。
1.4 LAMP荧光反应体系
LAMP荧光反应总体系[25]为25 μL,成分为:3 mmol/L的dNTP,1 mol/L的甜菜碱,2 mmol/L的MgSO4,50 mmol/L的KCl,3 μmol/L的FIP/BIP引物,0.4 μmol/L的F3/B3引物,0.8 μmol/L的Loop F/B引物,1×LAMP buffer(20 mmol/L Tris-HCl (pH=8.8),10 mmol/L KCl,10 mmol/L (NH4)2SO4,2 mmol/L MgSO4,1% Tween20),0.3 U/μL的Bst2.0聚合酶,1 μL的待测模板,加无菌无酶水至25 μL,反应温度为65 ℃。本实验检测副溶血弧菌的TLH基因,引物序列[26]如表1所示。
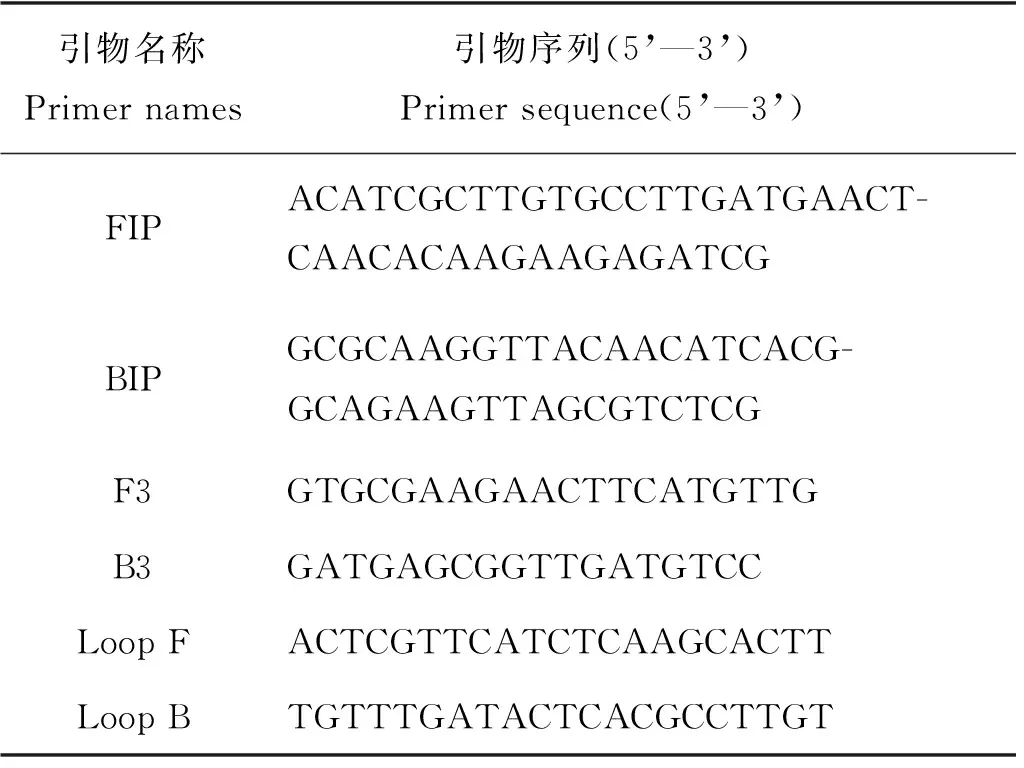
表1 实验所用LAMP引物
1.5 pH-LAMP反应体系
LAMP反应体系中一般包含能够使反应体系pH稳定的Tris-HCl缓冲体系,为了检测扩增过程中H+的产生量,必须调整缓冲体系的缓冲能力才可能检测到pH的变化,在保证DNA聚合酶活性的情况下,反应溶液的缓冲能力越弱,pH变化越明显。本文使用的pH-LAMP体系是丁盛等[25]提出的LAMP比色体系,将1.4小节中的LAMP荧光体系中的LAMP buffer里的Tris-HCl浓度改为5 mmol/L,以减少pH缓冲能力,且可以保证DNA聚合酶的活性,不会影响反应速率,反应温度为65 ℃。
1.6 pH敏感电极的制备
由于LAMP的反应温度为65 ℃,因此需要电极的基底具有良好的热稳定性。聚酰亚胺(Polyimide,PI)具有良好的热稳定性、较低的热膨胀率和不易于溶剂发生反应,目前被广泛应用于生物技术、微电子、液晶和航空航天等领域,因此本文选用聚酰亚胺作为电极基底。
聚苯胺(Polyaniline,PAni)是一种成分仅含有C、H、N的高分子化合物[27],结构模型如图1所示,其中,y表示聚苯胺的氧化还原程度。当y=1时,聚苯胺为全还原态;当y=0时,聚苯胺为全氧化态。聚苯胺具有合成原料简单、良好的热稳定性、可逆的掺杂性等优势。PAni的掺杂程度主要由H+浓度决定[28],当H+浓度变化时,PAni形态发生变化,平衡电压会发生变化。因此,可以通过监测PAni的平衡电压来判断反应液的pH变化。
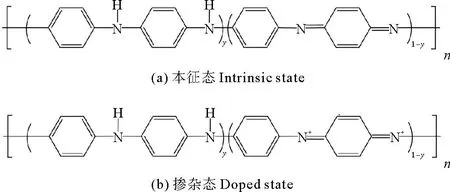
图1 聚苯胺结构图
使用循环伏安法(Cyclic voltammetr, CV)聚合聚苯胺,扫描速率为0.1 V/s,扫描电压范围为-0.2~1.0 V。取50 μL的0.1 mol/L苯胺溶液(溶剂为1 mol/L盐酸)于电化学电极上,循环扫描12次,然后除去电极上的液体,加入新的苯胺溶液,循环扫描12次,扫描结果如图2所示。

图2 PAni电沉积的循环伏安曲线
由图2可以看到象征PAni的特征氧化还原峰,且可以看到在工作电极上有一层绿色的材料,证明在工作电极上成功修饰了PAni[29]。将定制的PET管通过环氧树脂固定在电极上,形成一个反应腔室,注意环氧树脂不要覆盖到工作电极和参比电极,加入反应液后,工作电极和参比电极可以接触到反应液。
1.7 便携检测设备的研究与实现
为了满足现场检测的需求,研究并完成了可便携的检测设备,如图3所示,设备核心电路的尺寸仅为7 cm×4 cm,质量为30 g,便于携带。本系统使用的中央处理器(Microcontroller unit, MCU)是ST公司的STM32F103VET6,内部集成了3个12位模数转换器(Analog-to-digital converter,ADC)、11个计时器、串口等通用外设,能够满足本系统的功能需求。供电电源为5 V,可以使用便携式充电宝对该设备供电。5 V电源通过电压转换器IT3462,电压转换为-5 V,为检测电路提供负电源;5 V电源通过电压转换器BM1117,电压转换为3.3 V,为MCU和其他外设提供电源。电压检测电路采用芯片AD8066,可以将待检测电压放大到合适范围内,然后输入至ADC中,进行采集,精度为1 mV,因此该系统的pH精度为0.016个pH单位。该设备上有4个状态灯,可以显示实验进程和检测结果。本系统搭配蓝牙模块,可以实时传输数据到手机,便于用户存储和管理数据。

图3 便携式检测设备实物图
本研究设计的便携式检测设备中的硬件可以循环使用,每次检测只需要更换pH敏感电极,因此单次检测的成本较低,操作流程图如图4所示。将待测样本简单处理后,得到待检核酸,添加到核酸扩增体系后,将25 μL的反应体系加到pH敏感电极中,并使用PCR膜密封,防止气溶胶污染,然后将pH敏感芯片插入便携式设备和恒温模块中,用户在启动设备后,设备会自动进入核酸扩增和核酸检测步骤,内置程序实时分析数据和判断结果,检测结果通过LED灯显示,可以显示实验进程和检测结果;搭配蓝牙模块,可以实时传输数据到手机,便于用户存储和管理数据。
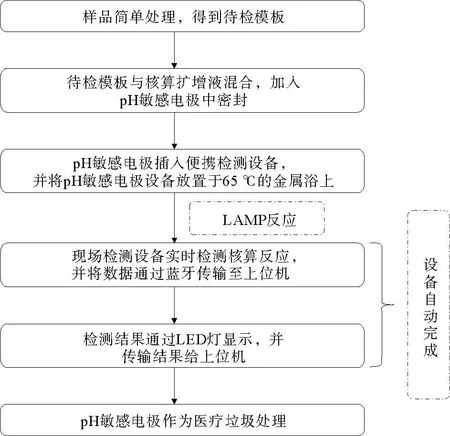
图4 系统操作流程图
2 结果与分析
2.1 沉积纳米金的阻抗变化
使用电化学阻抗谱(EIS)方法进行检测裸电极(裸电极为碳)和沉积纳米金后的电极阻抗,EIS响应如图5所示。电化学阻抗半径越小,表示电荷转移能力越强[20]。在沉积了纳米金后,显示出更小的半圆畴(曲线b),这是由于修饰了纳米金后的电极具有更大的比表面积,促进了电子的传递和转移,阻抗从1.6 kΩ降低到400 Ω,表明本研究构建的纳米金电极的阻抗低,具有良好的电荷转移能力,可加快生物传感器的电响应。
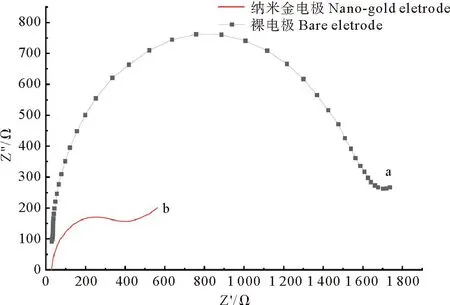
(Z′为阻抗的实部,Z″为阻抗的虚部。Z′ is the real part of the impedance, and Z″ is the imaginary part of the impedance.)
2.2 电极对不同pH溶液的响应
为了验证本文制备的pH敏感电极的灵敏度,使用不同pH(pH为6.0~8.5)的TE缓冲液进行测试电极的电压响应。将50 μL的缓冲液滴加在工作电极和参比电极上,使用电化学工作站检测工作电极相对于参比电极的开路电压,测试50 s。测试结束后,除去已测溶液,加入下一个缓冲液,重复上面操作,一共测试了pH分别为6.0、6.5、7.0、7.5、8.0、8.5的缓冲液,结果如图6(a)所示。使用3个pH敏感电极重复以上操作,结果如图6(b)所示。
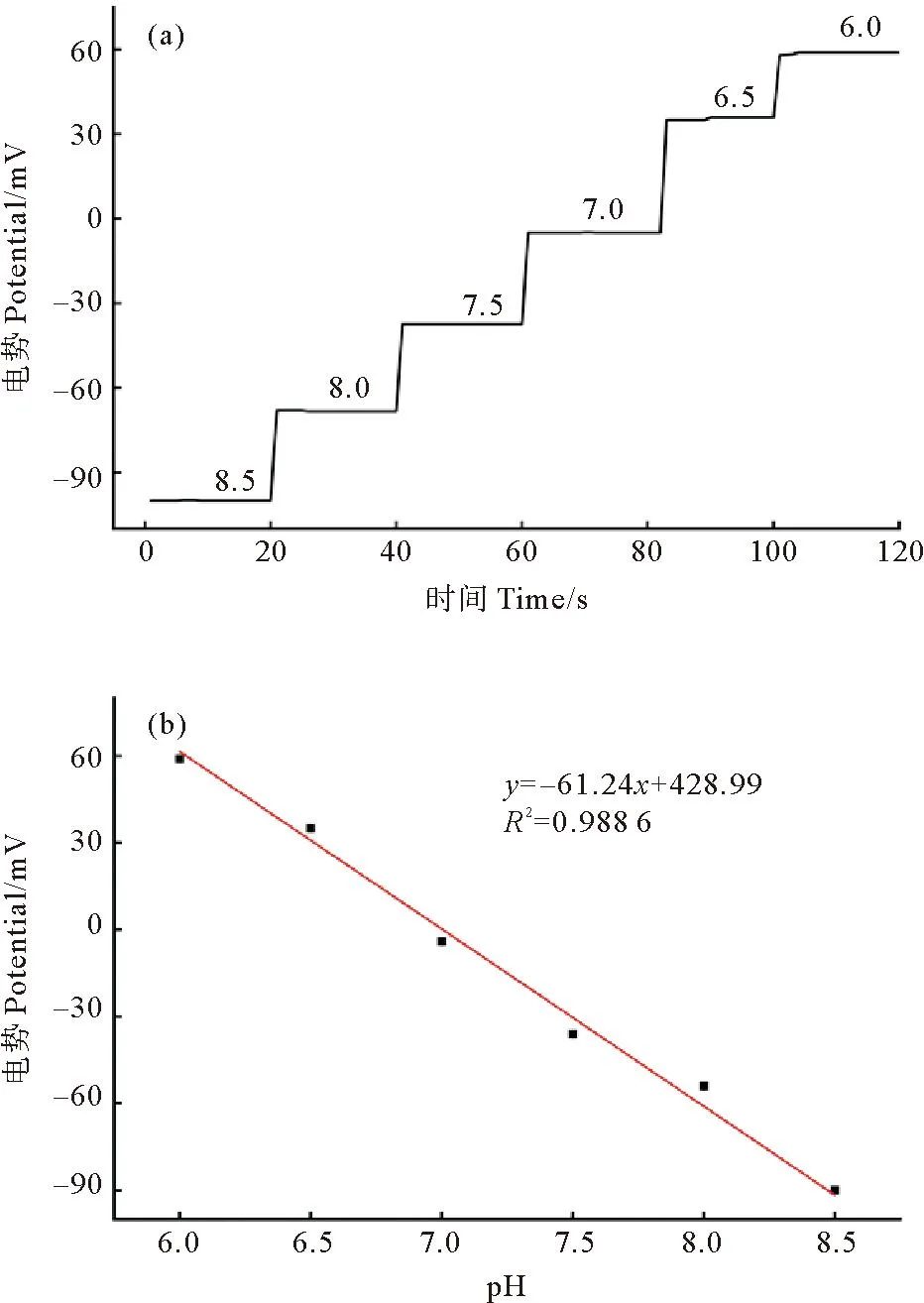
图6 pH敏感电极在6.0~8.5 pH范围内的电压响应
在pH为6.0~8.5范围内,1个pH单位的电极响应为(-61.24±3.27) mV。在此范围内,电极的电压响应与pH呈现显著的线性关系,相关系数(R2)高达0.988 6,证明了该电极优异的稳定性。
2.3 电极对不同菌的特异性响应
为了验证本文制备的pH敏感电极的特异性,使用副溶血弧菌、创伤弧菌、溶藻弧菌和弯曲弧菌进行电极的特异性检测。根据表1的副溶血弧菌引物,制备以上几种菌DNA的LAMP反应液,分别取50 μL缓冲液滴加在电极上,进行反应,实验结果如图7所示。
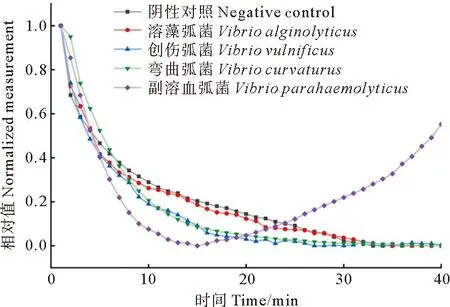
图7 现场检测系统的特异性检测
图7显示,只有含副溶血弧菌DNA的LAMP反应液产生了明显的电压变化,弯曲弧菌、溶藻弧菌和阴性对照的电压没有上升趋势,由此判断,我们构建的电极对于副溶血弧菌检测的特异性好,可以满足实时监测副溶血弧菌LAMP检测需求。
2.4 现场检测系统的灵敏度和检测时间实验
为了确定该系统的灵敏度和检测时间,将1.2节中制备的副溶血弧菌的DNA溶液稀释,得到浓度约为10~1×107CFU/mL的DNA溶液。将上述不同浓度的DNA溶液各取1 μL,分别加入到24 μL的核酸扩增液中,混合均匀后,加入到pH敏感电极中,用PCR膜密封。金属浴设置为65 ℃,加热pH敏感电极中的反应液,同时使用1.7节构建的便携设备进行检测,结果如图8(a)所示。将菌液浓度与现场检测系统的阈值时间(Threshold time,tT,为扩增过程中反应体系达到阈值线时的扩增时间)进行线性回归分析,结果见图8(b),结果证明该系统可以定量检测副溶血弧菌。
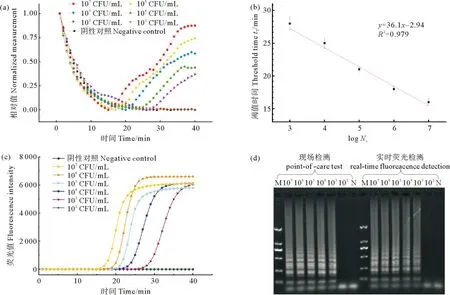
((a) 不同浓度的副溶血弧菌菌液的现场检测系统的检测结果;(b) 现场检测系统检测结果的tT值与菌液浓度的线性回归分析的结果,图(b)中横坐标log Nc表示靶标DNA浓度的对数值;(c)不同浓度的副溶血弧菌菌液的实时荧光检测系统的检测结果;(d)现场检测系统(左)和实时荧光检测(右)的扩增产物的琼脂糖凝胶电泳图,图(d)中M表示DNA make,N表示空白对照。(a) Detection results of point-of-care test system for Vibrio parahaemolyticus bacterial liquid with different concentrations; (b) Linear regression analysis results of tT of point-of-care test system and bacterial solution concentration. The abscissa log Nc of figure (b) represents the logarithmic value of the target DNA concentration.; (c) Detection results of real-time fluorescence detection system for Vibrio parahaemolyticus bacterial liquid with different concentrations; (d) Agarose gel electrophoresis of amplification products of the point-of-care test system (left) and real-time fluorescence (right). M of figure (d) is DNA maker, and N is no template control.)
同时使用相同靶标浓度进行实时荧光检测,检测结果如图8(c)所示。将荧光检测结果与本文设计系统的检测结果进行对比,结果如图8(d)所示。该系统的检测限与实时荧光检测一致,检出时间和荧光检测一致。通过琼脂糖凝胶电泳分析可知,荧光检测和使用该系统检测的产物条带亮度相同,条带一致,这证明该系统不会影响核酸扩增反应。
2.5 被副溶血弧菌感染的样品的检测实验
将从市场购买的新鲜海虾用三蒸水清洁干净,再泡在75%的乙醇中10 min,以消除背景微生物的干扰,然后用经高压过的三蒸水洗涤3次,以避免杂质影响后续的反应。将过夜培养的副溶血弧菌稀释至不同浓度,将处理好的虾样放入不同的副溶血弧菌稀释液孵育30 min,然后将其转移到培养板上,让细菌在室温下附着30 min。
使用一次性棉签尖部擦拭培养过的虾样,然后将棉签末端洗脱到250 μL无菌水中。将50 μL洗脱液在培养基中连续10倍稀释,将50 μL稀释液一式三份涂在固体LB平板上,然后在37 °C的细菌培养箱中过夜培养。计数菌落并计算细菌悬浮液的浓度,其余洗脱液(200 μL)用于通过RS5核酸快速提取的方法提取副溶血弧菌DNA,将提取的DNA作为LAMP扩增的模板。制备LAMP反应液,并将反应液加至芯片上,进行反应,结果如图9所示。

图9 加虾样品现场检测系统的灵敏度
图9显示,该检测系统检测到了不同浓度的加标虾样品,其检测限为3.6×103CFU/g,因此该检测系统可以很好的检测加标虾所含菌量,且为现场即时检测海鲜感染程度提供了一定的技术支持。
本研究构建了一种便携、快速的核酸现场检测系统,该系统特异性好,灵敏度和荧光检测一致,检出时间一致,但成本比实时荧光检测系统低,体积更小,适合于对海产品中的副溶血弧菌的现场快速检测;本系统可以通过阈值时间tT对副溶血弧菌进行定量分析,且该系统是实时检测和每分钟更新检测结果,这样可以大大节省检测时间,一般在30 min内可以出结果,阳性结果最快在16 min检出。对加标虾样品中副溶血弧菌进行检测,检测限低至3.6×103CFU/g,从采样到得到检测结果在40 min内完成。该检测系统还有望用于其他致病菌现场快速检测。
3 讨论
近年来,食品安全事故频发,因此亟需研发一种现场快速检测食品中病原体的系统。电化学检测方法具有快速、灵敏、易集成等优点,符合检测设备小型化的发展趋势,因此电化学检测是未来现场检测病原体核酸的趋势。
Zhang等[20]提出了一种用于核酸检测的无标记电化学电极,通过监测反应液的pH来判断核酸扩增过程。电极上修饰了对pH敏感的菲醌(Phenanthraquinone,PAQ)和对pH不敏感的二甲基二茂铁(Ferrocene,Fc),通过SWV扫描,比较PAQ和Fc的电位差来判断待测反应体系的pH,灵敏度为1个pH单位75 mV。如果需要对样本中的目的靶标进行定量分析,需要对扩增过程中的pH变化曲线求导,得到信号阈值时间tT,从而对样本中目的靶标进行估算。Xu等[30]设计了一种集成装置,整合了核酸的提取、扩增和检测,该装置可以在30 min内完成检测。Gosselin等[29]提出了一种用于检测核酸扩增的聚苯胺电极,反应结束后,需要将阴性实验的数据作为基线,数据校准后,才可以对样本中目的靶标进行定性和定量分析。以上提出的电化学方法,需要使用电化学工作站进行检测,设备笨重,且实验结果需要人工分析,无法自动判断结果。本文建立了一种现场检测系统,搭配便携设备,可以自动分析靶标浓度,且分析结果可视化。
聚碳酸酯(Polycarbonate,PC)常作为电化学电极的基底[31-32],通过实际测试发现,PC电极在长时间的加热后会发生形变,电压信号不稳定,会对结果判断造成困难。在本文研究中,采用PI作为电极基底,可以长时间加热,不易形变,电压信号更稳定,数据和结果更可靠。此外,Gosselin提出在反应初期,电压会下降,这与本文的研究结果一致,Gosselin认为可能是由于扩增体系中的酶带有负电荷,和聚苯胺形成静电吸附,造成开路电压降低[33]。聚苯胺的导电性和聚苯胺的掺杂程度相关,因此质子化程度较低的聚苯胺的阻抗较大,本研究在电极上修饰了纳米金粒子,可以降低阻抗,有利于电荷转移,响应速度更快。
在本研究中,使用的是副溶血弧菌引物,仅更换为其他病原体的引物,就可以检测其他病原体,该系统的适用范围更广。在本研究中,需要对样本进行处理,得到核酸后,配置核酸扩增体系,才可以进行检测。未来可以将微流控技术与本系统结合,自动完成核酸提取、核酸扩增和核酸检测,实现核酸一体化快速检测。
4 结语
本研究以副溶血弧菌为研究对象,建立了一种基于LAMP扩增和电化学检测技术的现场检测系统,该系统可在30 min内完成检测,且系统集成度高,适用于副溶血弧菌的即时检测。利用聚苯胺的质子掺杂原理,制备了pH敏感电极,在pH 6.0~8.5范围内电极的1个pH单位响应为(-61.24±3.27) mV,相关系数R2为0.988 6,灵敏度高,稳定性好,可以实时监测扩增体系的pH变化,搭配现场检测设备,内置程序可以自动分析实验数据,对样本中副溶血弧菌进行定性和定量分析。使用本系统对不同浓度的副溶血弧菌菌液进行检测,与实时荧光结果相比,检测限与荧光检测一致,可达103CFU/mL。使用系统对加标虾样品中副溶血弧菌进行检测,检测限低至3.6×103CFU/g。本设备核心电路的尺寸仅为7 cm×4 cm,质量为30 g,方便携带,检测数据通过蓝牙上传到手机,方便存储数据,为检测人员提供了智能化、规范化的工作平台,为自动化、一体化的核酸现场检测提供了参考。
- 中国海洋大学学报(自然科学版)的其它文章
- 两类厄尔尼诺事件对次年山东夏季降水的影响研究*
- 3种不同添加物对凡纳滨对虾生长、非特异免疫和抗病力的影响*

