微纳米塑料与细胞的相互作用的研究进展
刘元元,刘 杰,王海芳
(上海大学纳米化学与生物学研究所,上海 200444)
塑料的性能好、成本低、易于生产,因此用途广泛,应用在日常生活中的方方面面[1].2020年塑料的产量就已达到3.7亿吨,而新冠大流行对一次性塑料用品的极度需求使得塑料产量加速增长[2],相关组织预测塑料产量将继续增长,到2060年可能达到13亿吨[3].但是塑料的生物降解性极低,在使用后大多会变成垃圾,进入环境.环境中的塑料在自然降解、机械磨损等条件下,成为微纳米塑料(M/NP),即粒径小于5 mm的塑料碎片和粒子[4].此外,制造和使用塑料制品过程中也会产生M/NP,释放进入环境[5],涂料和化妆品等产品中加入的M/NP也会进入环境.M/NP来源多样,分布范围广泛,包括水体、土壤和空气[6],且其在生态系统中分散、迁移,并可能被不同物种吸收,从而有很大的产生负面影响的风险.研究发现M/NP能够进入体内[7],并能够抵抗化学降解并避免机体直接排除,从而在生物体内长期富集[8].
M/NP种类繁多,环境中最常见的是聚苯乙烯(PS)、聚乙烯(PE)、聚乙烯对苯二甲酸酯(PET)和聚丙烯(PP)[7].M/NP已经在饮用水和食物中被广泛检测到[9],更令人担忧的是它在人体的多个组织器官和排泄物中也被检测到[10].M/NP容易在生物体中长期蓄积,对人类健康具有潜在的危害[8].
目前的研究显示,M/NP可能通过多种途径进入人体,如经胃肠道吸收、呼吸道吸入和皮肤接触吸收.当M/NP进入生物体后,不可避免地与细胞相互作用,影响细胞的结构和功能,进而影响生物的健康[11-12].因此了解M/NP和细胞的作用及机制对评估M/NP的健康风险至关重要.本文在概述了M/NP的来源、暴露途径及对人体健康影响的基础上,重点总结归纳M/NP和细胞的相互作用,包括摄入、外排及毒性的最新研究进展,讨论了影响其相互作用的因素,并据此总结了今后应该关注的研究方向和内容.
1 微纳米塑料的来源、暴露途径及对人体健康的影响
1.1 微纳米塑料的来源
M/NP主要分为初级M/NP和次级M/NP[13].初级M/NP主要来自于塑料制品的生产、加工过程中的塑料粒子[11],包括使用过程中磨损、碎裂而产生的更小的塑料粒子.人造纤维、橡胶制品、化妆品和个人护理等产品的生产和使用过程中也会释放M/NP[14].此外,塑料制品在焚烧处理中也会释放M/NP[15],汽车排放[16]也会释放M/NP.次级M/NP则是指在环境中塑料制品经机械摩擦、紫外线辐射和生物降解而形成的M/NP[17],如汽车轮胎在行驶过程中、洗衣机和烘干机在清洗衣物过程中,都会产生M/NP[6];塑料袋、瓶子和包装盒(袋)在海洋中漂流时,它们也会逐渐分解成M/NP;一些微生物可以分解塑料,产生M/NP.总之,M/NP的来源非常广泛,这也是它在环境中普遍存在的原因之一.
1.2 人体的暴露途径
M/NP可通过呼吸吸入、消化道摄入和皮肤接触等多种途径进入人体[18-19].空气中存在大量各种来源的M/NP[16],浓度大约在9.8~500粒/m3[20].职业暴露也是人们通过呼吸摄入M/NP的一种途径,如塑料制品生产、清洁剂制造和建筑工作[21-23,25].Wieland等人估计,人类每天可能吸入超过48 000粒M/NP[21],空气中微塑料(MP)颗粒数含量可达到1 583±1 180粒/m3[24].小于10 μm、未被黏液清除的M/NP可沿着呼吸道进入肺深处,与肺细胞作用或穿过肺部屏障,进入血液并分散到全身[26].研究者已在人肺中发现微塑料纤维[18].滞留在肺部的M/NP可能导致肺机能的改变;许多因素会影响肺泡中M/NP的吸收和排出,从而加剧其对肺的损伤程度[27].聚苯乙烯(PS)被认为是空气中M/NP的主要组成[28].因此,形貌相对均一且在体系中分散较好的PS常被作为M/NP模型,目前大部分关于M/NP的生物效应的工作都是用各种PS作为模型完成的.
Schwabl等人[29]在8个国家的人粪便中检测到9种不同的M/NP,证实了其在人体肠道中的存在.人们主要通过进食、饮水和吸烟等方式经胃肠道摄入M/NP[23,30-32].据估计,人类每年通过胃肠道摄入的M/NP为40 000~50 000粒/人[23].此外,牙科和口腔保健产品,例如含塑料粒子的牙膏、漱口水和牙齿美白剂等,也是胃肠道摄入M/NP的重要来源[32].
M/NP还可以通过皮肤接触进入人体.护肤品和化妆品常常会添加不同化学成分、形状和尺寸的M/NP以达到某种功能,其中最常用的也是PS[33].例如女性每天使用的磨砂膏,含有约1千到1.8万个M/NP/毫升[34].空气和水中的M/NP也可能接触皮肤.这些M/NP可能通过毛孔吸收、经过角质层、汗腺分泌或破损的皮肤进入皮肤,并进一步进入体内循环系统[32].
1.3 对人体健康的影响
通过呼吸和胃肠道,大约每人每年摄入7.4~12.1万个M/NP[23].大多数摄入的M/NP会从体内直接排出,但仍有少量会滞留体内[35].已有分析显示,人血液中检出平均含量为1.6 μg/mL的M/NP[10];在人肝脏、脾脏、淋巴结、肺部和胎盘都发现有M/NP[9-10,36].这些证明了M/NP能够穿越屏障,进入血液循环系统并在全身分布.绝大多数M/NP的生物可降解性很差,若无法被及时排出体外,可能引发局部炎症,导致组织结构改变和功能紊乱,长期存在甚至可能产生遗传毒性[37],以及改变机体行为的神经毒性,从而影响人体的正常生理功能.例如,M/NP在胃肠道中积聚会导致肠道炎症和肠道菌群失调等问题[11];Yan等人也报告了人粪便中MP的数量与炎症性肠病状态之间呈正相关[12].
多项研究报道在人体的肺组织中检测到M/NP,包括PS、PP和聚氯乙烯(PVC)粒子.这些粒子在肺部积聚会导致呼吸系统的损伤[27].吸入的PS还可能引起肺部炎症或穿过血脑屏障进入中枢神经系统[38].M/NP会引起氧化应激和炎症,可能破坏免疫和神经系统[39].研究者在生产合成纤维的工人中就观察到有下气道弥漫性间质或肉芽肿性病变、间质纤维化(哮喘样综合征,外源性过敏性肺泡炎,慢性支气管炎,气胸和慢性肺炎)[21-22,25].Burkhart等人[25]发现,尽管可吸入颗粒物浓度为2.2 mg/m3,低于美国国家职业安全卫生研究所针对有害粉尘设定的许可标准,但从事尼龙植绒工作的工人患间质性肺病与其吸入可吸入颗粒物有关.这些相关的和初步的研究工作提示我们亟需评估M/NP的健康风险.
2 细胞对微纳米塑料的摄入及外排
2.1 细胞对微纳米塑料的摄入
M/NP与细胞的相互作用是其生物效应的基础,因此随着人们对M/NP的关注,有关其细胞摄取的研究大幅度增加.M/NP的细胞摄取依赖于M/NP的物化性质,以及细胞种类和暴露条件.虽然在高浓度(50 μg/mL)下观察到人结肠上皮细胞CCD841CON和小肠上皮细胞HIEC-6可以摄入5 μm的PS[40],但粒径大于1 000 nm的很难被非吞噬性细胞摄取,粒径越小越容易进入细胞.例如,相较于1 000 nm的PS,结肠腺癌细胞Caco-2更易摄入20 nm的PS[41].Wang等人[42]也发现,与40 nm的PS相比,150 nm PS进入HeLa细胞的速度较慢.我们发现肺细胞A549和BEAS-2B对50 nm PS的摄入量均高于100 nm PS;但在高剂量和长时间暴露条件下两种细胞则摄取更多的100 nm PS而不是50 nm PS[43].可见不同的粒径和细胞导致不同的细胞摄取结果.
一般来说,随着时间增加,细胞摄入M/NP会逐渐增加,到最大值后会维持不变,或因细胞分裂等原因而降低.如0.1 mM的PS与HeLa细胞共培养后,细胞对40 nm PS的摄入在24小时后都没有达到峰值,而对150 nm的PS的摄入在4小时就达到了峰值[42].但我们在肺细胞A549和BEAS-2B上的研究结果不同,剂量为20 μg/mL时,两种细胞对50 nm 和100 nm的PS的摄入在24小时内持续增加,均未达到峰值[43].
粒子的细胞内化开始于与细胞膜的黏附,随后,黏附的粒子可能通过被动渗透或主动内吞进入细胞[44].M/NP可通过内吞和被动渗入等方式进入细胞.一般来说,大于200 nm的粒子主要通过吞噬作用被摄入,较小的粒子(大于10 nm小于200 nm)通过胞饮作用被摄入(包括大胞饮作用、网格蛋白和小窝蛋白介导的内吞作用),多数情况下是多种路径共存[42],而且也受细胞类型等的影响.Zhang等人报道70 nm的PS主要是通过网格蛋白和小窝蛋白介导的内吞作用进入肺细胞A549和人结肠腺癌细胞CaCo-2,而吞噬作用是200 nm和500 nm的PS进入细胞的唯一途径[40].同样地,Kuhn等人报道40 nm的PS通过网格蛋白介导和小窝蛋白介导的内吞作用被A549细胞摄入[45].但也有研究发现40 nm的PS只通过网格蛋白介导的方式进入HeLa细胞[42];20、120和190 nm的PS通过网格蛋白介导的途径进入犬肾细胞MDCK-II和肺细胞A549[46].200 nm常常被认为是网格蛋白介导的内吞作用的尺寸上限.然而,Guarnieri等人[47]发现49 nm和100 nm PS可能是通过大胞饮作用进入猪主动脉内皮细胞PAE,并不涉及网格蛋白和小窝蛋白介导的途径;Reinholz等人[48]也报道Caco-2细胞通过大胞饮作用摄入100 nm PS.这可能和PS在体系中的分散性有关.还有研究发现M/NP可以通过被动渗入进入细胞.如Liu等人发现50 nm和500 nm的PS进入大鼠嗜碱性白血病细胞RBL-2H3的内吞途径不同,但都有一部分是通过被动渗入进入细胞的[49].我们的研究表明不同细胞对同样的M/NP的摄取路径可能不同.50 nm的PS进入A549细胞依赖于网格蛋白和小窝蛋白介导的内吞作用和大胞饮作用,进入BEAS-2B细胞则主要依赖于小窝蛋白介导的内吞途径,但100 nm的PS进入这两种细胞均依赖于三种路径即大胞饮作用、网格蛋白和小窝蛋白介导的内吞作用[43].尺寸大于1 μm的MP很难被非吞噬细胞摄取,但可以通过吞噬作用被巨噬细胞吞噬.Kuhn等人发现A549细胞不能摄入1 μm的PS,而J774A.1细胞则可通过吞噬作用摄入[45].
M/NP通过内吞途径进入细胞后,主要进入溶酶体,但也有部分能进入线粒体等细胞器;被动渗入的一般分布在细胞质.M/NP在细胞内的分布也受M/NP性质、细胞类型和暴露条件的影响.Ekkapongpisit等人[50]发现30 nm羧基化的PS积聚在人卵巢癌细胞NIH-OVCAR3的循环内体中.Thubagere和Reinhard[51]观察到羧基化(20 nm和40 nm)和氨基化(40 nm)的PS分布在CaCo-2细胞的细胞质.而Liu等人报道,50 nm和500 nm的PS主要分布在RBL-2H3细胞的溶酶体中,少量分布在细胞质中[49].我们的研究也发现50 nm和100 nm的PS主要分布在A549和BEAS-2B细胞的溶酶体中,但在BEAS-2B细胞中100 nm的PS还分布在线粒体中[43](图1).
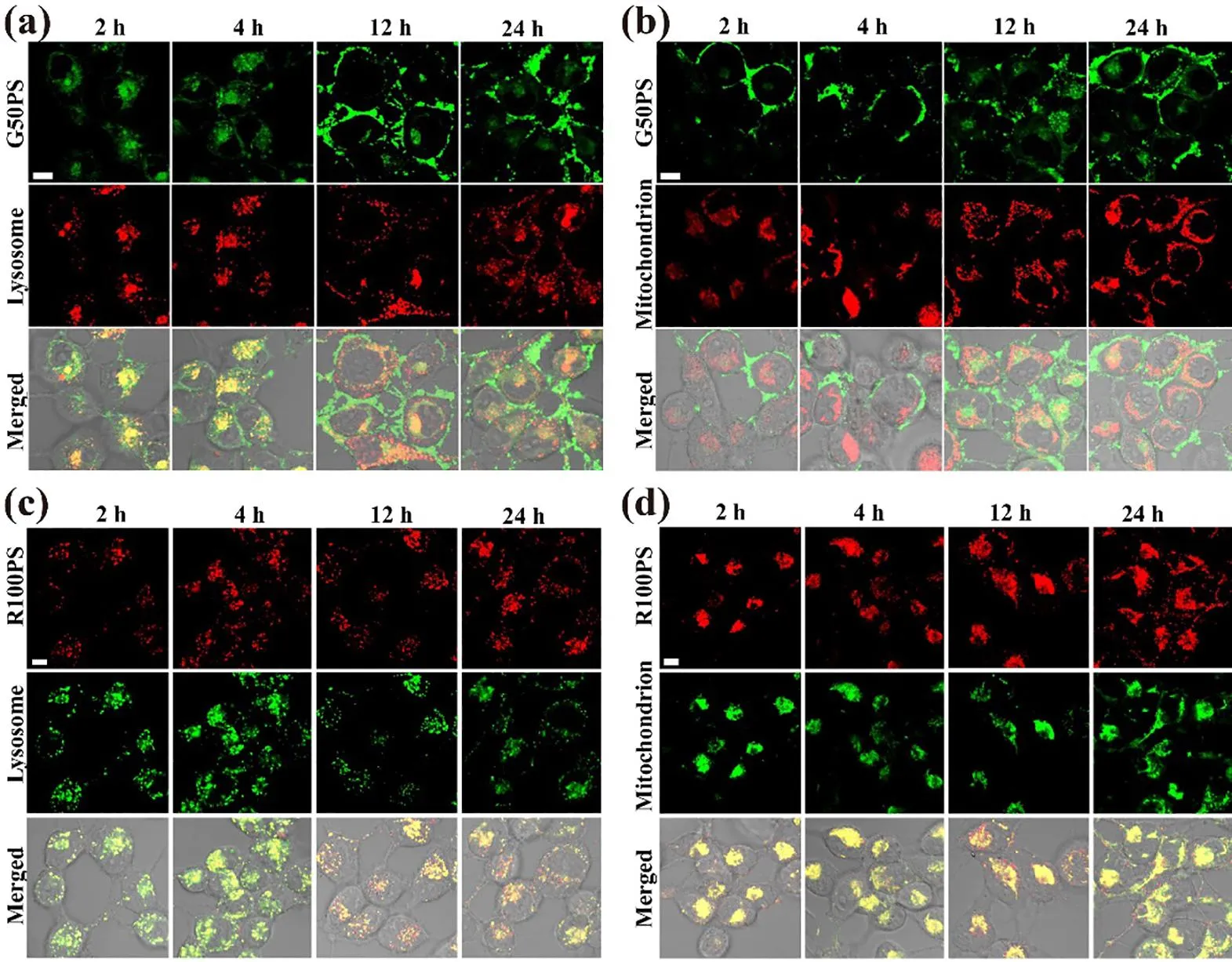
BEAS-2B细胞暴露于50 nm的PS(绿色,a, b)或100 nm的 PS (红色, c, d)不同时间后,PS 在BEAS-2B细胞中的分布.溶酶体和线粒体标记为红色(a,b)或绿色(c,d).标尺代表10 μm
2.2 细胞对微纳米塑料的外排
M/NP的细胞毒性与其细胞内含量密切相关,而细胞内M/NP的含量取决于M/NP的细胞摄入和细胞外排的综合结果.然而,目前对于M/NP的细胞外排的研究还非常欠缺,仅有数据表明M/NP的外排不仅受其大小及表面电荷的影响,还受细胞类型的影响.
小粒径的M/NP容易被排出细胞.例如,50 nm的PS比100 nm和500 nm的PS更易被细胞外排[43,49].但整体而言,M/NP均很难从细胞中排出.在A549细胞中,即使是50 nm的PS,6小时的外排量也只有50%,而100 nm的PS在24小时内的外排可以忽略[43].Han等人[52]发现小鼠胚胎成纤维细胞MEFs内的PS在4天内仅少量被排出.虽然大多数报道认为细胞质中的纳米粒子很难排出细胞,但Fiorentino等[44]报道了一个异常快速的外排,即1分钟内约50%的44 nm的PS通过被动渗透从牛输卵管上皮细胞BOEC和人结肠成纤维细胞HCF中快速排出.M/NP表面电荷对外排的影响可以从Yang和Wang[53]的研究结果看出.虽然100 nm的PS的细胞外排速度都缓慢,但表面中性、带正电和负电的PS在斑马鱼胚胎成纤维细胞ZF4中的保留半衰期还是有不同,分别为10.1,12.0和15.1小时,即表面负电的PS最难从细胞中被排出.
能量依赖和非能量依赖的途径都能参与M/NP的细胞外排[44,54],能量依赖的途径主要是溶酶体路径和内质网/高尔基路径.而我们发现50 nm的PS在A549和BEAS-2B细胞中的外排均具有能量依赖性,溶酶体路径是主要路径[43].非能量依赖的被动渗透也参与外排[44,49].
3 微纳米塑料的细胞毒性
3.1 单独暴露
已有的研究表明,M/NP对细胞造成各种影响,包括细胞膜结构和细胞功能的损伤,氧化应激和炎症因子的表达改变,造成代谢障碍以及遗传毒性,引起细胞凋亡和坏死等[13,55].M/NP细胞毒性的研究采用的细胞模型集中在表皮、胃肠道和肺细胞.
M/NP与细胞之间的物理接触可能导致细胞膜结构和功能的破坏,表现在细胞形态和细胞膜通透性的改变[13,40].比较直接的表现是,短时间作用于细胞后,能够引起的细胞凋亡,且细胞凋亡的情况依赖于M/NP的暴露浓度和细胞类型(图2a-b).而M/NP对细胞膜功能的损伤,可能与其粒径和形状有关,如非球形的PS比球形的PS更容易黏附在细胞膜表面[56],但球形的PS更易被细胞摄入,产生更强的毒性[44].

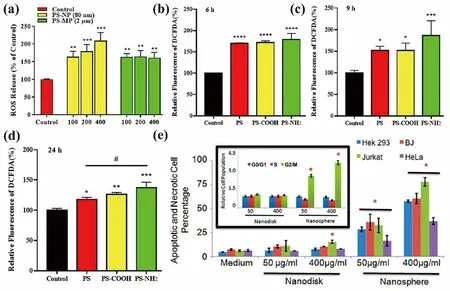
(a-b) PS MP作用CCD841CoN细胞(a)和HIEC-6细胞(b) 0.5 h后引起的细胞凋亡[40];(c) PS、PS- COOH和PS- NH2(50/100 μg/mL)作用PC12细胞24 h后,细胞核中TFEB的平均含量[59];(d-f) PS对A549细胞的基因毒性:(d) 微核形态;(e) 80 nm和2 μm的PS引起的细胞微核的比较;(f)表面基团对80 nm PS引起的细胞微核形成的影响[37]
M/NP导致细胞内活性氧(ROS)的过度产生,这是M/NP最主要的细胞毒性机制[13,40,57].ROS的产生会影响多种信号通路和免疫应答,例如活化B细胞的核因子κB轻链增强子(NF-κB)和丝裂原活化蛋白激酶(MAPK)[58],和促炎因子IL-8的上调等.激活和调节这些信号通路和免疫应答会损伤细胞器、DNA、细胞膜、离子通道和细胞表面受体,导致不良反应和毒性.例如Song等人[59]发现PS引起细胞溶酶体自噬转录因子EB(TFEB)表达升高(图2c),从而导致溶酶体功能障碍,引起细胞死亡;Hou等人[60]发现PS长期作用于细胞,会导致核因子(NF-κB p65)、IL-8和ROS水平的上升,其中NF-κB p65 对于调节细胞炎症和免疫反应至关重要,细胞炎症和免疫反应控制细胞内IL-8的分泌,从而进一步介导细胞凋亡.细胞内M/NP可以直接损伤线粒体,导致细胞内ROS增加;微米级PS对细胞活力和凋亡无显著影响.此外,微米级PS引起的膜损伤显著高于纳米级PS,这可能是由于大量的PS附着在间隙上,对细胞膜功能有显著的负面影响[40].Xu等人[55]发现,随着PS在Caco-2中积累,细胞活力逐渐降低,细胞周期被阻滞在G0/G1期;细胞中Bax/Bcl-2蛋白比值略有增加,表明细胞对凋亡的抵抗能力降低,伴随自噬标志物LC3-Ⅱ和SQSTM1蛋白水平升高,由此诱导细胞凋亡.
此外,M/NP还可以引起遗传毒性.Shi等人[37]通过微核形成实验分析5种不同的M/NP的基因毒性.结果表明,不同粒径和表面修饰的PS均可以导致细胞微核的形成(图2d).80 nm的PS比2 μm的PS引起的基因毒性更强(图2e),同时表面修饰也影响PS对A549细胞的基因毒性,毒性从强到弱依次是氨基修饰的,羧基修饰的和未被修饰的(图2f).
总的来说,M/NP对细胞的毒性作用,包括但又不限于细胞膜结构和功能的损伤,氧化应激以及其引起的一系列毒性相关的信号通路和免疫反应的激活,和造成的遗传毒性.此外,M/NP的细胞毒性不仅与其本身的物化性质相关,还受到细胞类型、暴露条件等因素的影响.然而,相关研究多采用球形PS来代表环境种类众多的微纳塑料[28],代表性有限,今后应该加强其他化学成分的M/NP的研究.
3.2 协同暴露毒性
除了M/NP本身对细胞的毒性影响,M/NP容易吸附环境中的其他物质,包括各种有害物质,与他们联合作用于细胞,有可能引起更严重的毒性效应[61-63].例如,多环芳烃(PAHs)可被M/NP吸附,一起被生物摄入,引起各种毒性效应[63];在M/NP存在的情况下,Cr、Cu、Mn和Zn等重金属元素在生物体内的积累显著增加,引发慢性毒性[64].Zhou等人[65]将这种现象描述为“特洛伊木马”效应,即M/NP作为载体携带其他有害物质穿透生物体膜.M/NP为这些有害物质渗透到组织和体液提供了可能[66].相比于微米尺度的粒子,纳米尺度的粒子由于比表面积大吸附量高,而且吸附在粒子表面的有害物质在细胞内更容易释放,引起线粒体去极化等,导致M/NP的细胞毒性增强[67].
M/NP除了和吸附的有害物质联合作用外,还可以与本身无毒的离子、其他的粒子、甚至不同粒径的M/NP联合作用于细胞,产生更强的毒性效应.相比于单独作用,PS与Ag 纳米粒子联合作用于THP-1细胞使得细胞的IL-6、IL-8和TNFa表达上调,加剧了细胞凋亡和死亡[64].多种粒径的PS共暴露会改变PS的细胞摄取和毒性.de-Boer等人[68]发现,100 nm PS促进细胞对40 nm PS的摄入,而40 nm PS抑制细胞对100 nm PS的摄入(图3a-b);1 μm和5 μm PS混合比单独的PS对A549细胞造成更严重损伤[69].另外,Steckiewicz等人[70]发现PS单独作用于HT-29细胞时,不会诱导ROS产生,也不影响细胞周期;然而PS与本身没有细胞毒性的F-共同作用于细胞后,除了引起细胞超微结构改变(图3c-f),细胞被阻断在G0/G1期,增殖受到抑制,导致细胞凋亡.然而这方面的工作还比较初步,需要更多的研究.
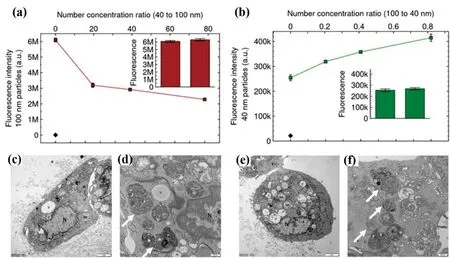
(a-b) HeLa细胞对混合的40 nm和100 nm的PS的摄取,发现40 nm的PS抑制细胞摄入100 nm的PS(a),而100 nm的PS促进细胞摄入40 nm的PS(b)[68];(c-d) HT-29细胞暴露于PS(500 μg/mL)后的TEM图;(e-f) HT-29细胞同时暴露于PS(500 μg/mL)和F—(1 mM) 后的TEM图(V:囊泡;N:细胞核;Mt:线粒体)[70]
4 微纳米塑料影响其细胞摄入及毒性的因素
除了M/NP的物化性质(粒径,形状,表面性质),老化,M/NP的暴露时间和暴露浓度也会影响细胞摄入的量,继而对M/NP的细胞毒性产生影响[69,71-73].
4.1 粒径
M/NP对细胞的毒性效应存在显著的粒径依赖[73-74].小粒径的M/NP比大粒径的更易进入细胞且细胞毒性更大.Prietl等人[75]发现20 nm的PS比0.5 μm和1 μm的PS对人单核细胞有更强的毒性作用,其中一个重要原因可能是与细胞摄入量有关.小于200 nm的PS不仅能以内吞方式被细胞摄入,而且可以依赖浓度梯度下的被动渗入或是与通道蛋白或转运蛋白发生黏附作用进入细胞[76],而粒径大于1 μm的PS却很难在短时内被细胞摄取[73,75],因此纳米级的粒子更容易诱导细胞毒性的产生,如ROS(图4a-d).M/NP在细胞内的大量积累导致细胞活力显著降低.Stock等人[77]就发现Caco-2细胞和THP-1巨噬细胞对粒径小于1 μm的PS的摄入量与两种细胞的活力呈负相关趋势,即摄入PS越多,细胞活力越小.Zhang等人[73]发现内皮细胞暴露于不同粒径(20 nm,50 nm,100 nm,500 nm,5 μm,10 μm)的PS时,PS的粒径越大,细胞摄入量越少,引起的细胞毒性也越弱.细胞摄入最高的20 nm的PS导致细胞出现严重损伤,包括活性氧水平增加,炎症因子IL-6、TNF-α和IL-1β表达水平升高,细胞骨架破坏.
(a) 不同粒径和表面基团的PS诱导A549细胞产生ROS.(b-d) 100 μg/mL不同表面基团的 PS与A549细胞作用6 h(b),9 h(c)和24 h(d)后细胞内的ROS水平[37].(e) 不同形状的PS与不同细胞共孵育24 h后,细胞周期和凋亡水平分析 [56]
与细胞摄入PS纳米粒子从而导致毒性不同的是,PS 微米粒子对细胞造成的损伤可能与其破坏细胞膜的完整性有关.Zhang等人[40]报道粒径为100 nm、500 nm、1 μm和5 μm的PS与人结肠上皮细胞CCD841CON和小肠上皮细胞HIEC-6分别单独作用24 h后,均表现出较低的细胞毒性;但PS 微米粒子对细胞膜的损伤高于PS纳米粒子,这可能是由于大量的PS微米粒子黏在细胞膜的膜间质中,对细胞膜的功能产生了影响.此外,高剂量下,细胞也可以少量摄取5 μm的PS,导致细胞氧化应激的平衡被破坏,引起线粒体去极化.Wu等人[78]也发现,高浓度下5 μm的PS比100 nm的PS对Caco-2细胞造成更严重的线粒体损伤.但Liu等人[79]报道了相反的结果,即粒径小于100 nm的PS比5 μm的PS对Caco-2细胞膜的损伤程度更高.矛盾的结果可能是由于PS的浓度和分散性不同导致的,也可能是PS 纳米粒子通过渗透的方式进入细胞时,引起细胞膜结构的变化[80],即质膜重排[81],最终导致细胞膜结构和功能的损伤.
4.2 形状
对M/NP的细胞毒性研究大多是将细胞暴露于具有特定尺寸、形状和表面修饰的M/NP(多以球形PS为模型),但这并不能反映现实环境中的M/NP的真实情况[38].环境中M/NP多为非球形,与细胞的相互作用可能和球形M/NP表现不同.Zhang等人[56]在研究PS纳米盘和纳米球(20 nm)被HeLa、Hek 293、Jurkat和BJ细胞的摄入和对细胞的毒性时发现,盘状PS只进入细胞膜的脂质双层却不进入细胞内,不产生毒性作用,而球形PS通过内吞作用进入细胞,将细胞周期阻滞在G2/M期,更容易诱导细胞凋亡(图4e).近期的研究获得了相似的结果,即球形PS比非球形PS更易被Caco-2细胞摄入,且能引起细胞更强的氧化应激反应,主要原因是球形PS富集在细胞的线粒体中[82].今后应该更加关注不规则M/NP的细胞摄取和细胞毒性.
4.3 表面性质
4.3.1 表面修饰
细胞对纳米粒子的摄入是由纳米粒子表面的性质和细胞表面受体之间的相互作用决定的[83].通常来说,由于细胞膜表面带负电,因此表面带正电的纳米粒子相比于表面带负电的纳米粒子更容易被细胞摄取[84],同时表面带正电的纳米粒子细胞毒性更大[85],这对于M/NP也同样适用.He等人[86]发现50 nm的表面带负电和正电的PS比表面中性的PS对肝细胞HepG2细胞显示出更严重的毒性且表面带正电的PS会引起更严重的氧化应激,主要是因为细胞对表面带电荷的PS的摄入量高于表面为中性的PS.Xu等人[55]也发现Caco-2细胞对100 nm PS的摄入量和毒性从高到低依次是氨基修饰的PS、羧基修饰的PS和无表面修饰的PS,说明PS的细胞摄入量与毒性正相关.Shi等人[37]也得出了一致的结论,即在6 h内氨基修饰的PS、羧基修饰的PS和无表面修饰的PS均能诱导A549细胞活性氧的产生(图4b-d),但是随着PS与细胞共孵育时间的延长,氨基修饰的PS对细胞具有更大的损伤.除了氨基修饰的PS更易与带负电的细胞膜相互作用的原因外,还可能与氨基修饰的PS引起的溶酶体自噬有关.Song等人[59]发现,不同表面电性的PS被细胞摄入后,均能激活转录因子EB(TFEB),激活细胞自噬.表面带正电的PS比其他PS能够在更低的浓度范围(10 ~ 25 μg/mL)和更短的时间(<24 h)激活TFEB,破坏溶酶体的完整性,从而阻断细胞自噬通量,降低细胞通过自噬溶酶体清除PS的能力,从而显示出更高的细胞毒性.综上,与表面中性的PS相比,表面带电的PS更容易被细胞摄入,且表面带正电的PS能导致更严重的细胞损伤.
4.3.2 老化
排放到环境中的塑料在光、热、氧、水、微生物、机械力等的作用下,失去原有性能,称之为老化[17].如M/NP中不饱和双键、支链、羰基、末端上的羟基等发生断裂或氧化,使得其原本性质发生改变.老化通常表现在M/NP表面电荷的转变,这增加了其亲水性和生物可利用度,使其更容易吸附其它物质,产生联合作用;或是其内部的分子单体释出,进入环境,加剧了其对环境的影响等.
M/NP的老化普遍增强了其对细胞的毒性效应.M/NP与经紫外线辐射后获得的老化后的M/NP相比,粒子形态上差异明显[69,87-89],如图5a所示PS在老化前后的形貌差异.El Hayek等人[69]发现,即使在低浓度(1-30 μg/mL)下,粒径为1 μm和5 μm的老化的PS(APS)对A549细胞的毒性比PS的更明显,表现为细胞膜完整性损伤严重,细胞核减小,细胞骨架和细胞代谢发生改变,细胞周期阻滞在S/G2期,细胞增殖抑制.此外,PS形态的改变通常也伴随着表面官能团和表面元素组成的改变,这导致了有更多的反应位点结合环境中的其它物质或与其反应产生新的物质,从而增强了毒性作用.例如,在支气管肺泡灌洗液(BALF)中,老化的PS(APS)比PS更易形成生物冠,且两者表面吸附蛋白的种类和量也存在较大差异[89].APS在生物冠的“伪装”作用下,则更容易被细胞摄入(图5b-d),增加其在细胞内的含量,使得潜在的风险提高.
4.4 暴露条件
4.4.1 浓度
M/NP浓度是影响细胞摄入和毒性的重要因素[7,69].低浓度暴露条件下,M/NP对细胞可能具有毒性兴奋作用,刺激其增殖;短时间高浓度和长期低浓度的暴露都会容易引起细胞炎症反应、氧化应激和免疫反应等.El Hayek等人[69]就发现1 μm和5 μm的PS在浓度低于10 μg/mL时能够刺激A549细胞增殖,但是当浓度增加到30 μg/mL后,PS则会对细胞产生毒性.暴露于高浓度PS(50-100 μg/mL)中,Caco-2细胞中出现致密囊泡,溶酶体的电子密度升高,线粒体出现肿胀以及脊的消失,ROS水平显著增加[90].此外,M/NP对细胞的毒性作用还表现为时间依赖性.M/NP短时间(小于48 h)高剂量作用于正常人肠道细胞CCD-18Co后,细胞内ROS水平会显著性升高,同时伴有细胞形态和细胞膜通透性的改变,线粒体膜电位的改变,和细胞活力的下降等;而在长时间(4周)低剂量下M/NP导致细胞内ROS水平逐渐升高,细胞代谢过程如TCA循环的重组[13].但Hou等人[60]用10 μg/mL的50 nm PS作用于肠道细胞14天,观察到的细胞凋亡比例、炎症因子表达水平和100 μg/mL的50 nm PS与细胞作用1~2天相当.此外,随着PS浓度的升高,细胞核周围PS的积累量明显增多,说明细胞对PS的摄入是剂量和时间依赖性的,且细胞内PS含量越高越容易导致细胞毒性.
一些研究者提出,M/NP“过量”是导致明显的毒性的主要原因,较少的接触只会产生轻微的影响[77].Zhang等人[40]发现,浓度为1000 μg/mL时,三种粒径(20 nm、100 nm和10 μm)的PS均可导致细胞膜出现不同程度的受损,细胞内ROS含量上升,但该浓度远远高于细胞能够接触的M/NP浓度(如在血液中的含量是1.6 μg/mL)[10].相反,较低浓度(0~80 μg/mL)的500 nm的PS作用于细胞时,并未发现细胞内ROS水平升高[91].与之相似,Cortes等人[90]研究50 nm的PS对Caco-2细胞的毒性效应时发现,暴露浓度在200 μg/mL时Caco-2细胞活力明显降低,而暴露浓度低于150 μg/mL时PS对细胞不产生毒性作用.在另一项研究中,当Caco-2细胞暴露于0~200 μg/mL PS中,也未检测到明显的细胞活力降低[92].可见,M/NP对细胞毒性的影响是具有浓度依赖性的[93],但不同细胞的耐受能力不同,当细胞内蓄积的M/NP浓度超过其耐受的阈值时,就会引发氧化应激和炎症等一系列反应.因此,在体外进行M/NP的健康风险评估时,应当考虑实际暴露剂量以及所采用的细胞模型.此外,由于M/NP在生物体内无法被有效降解,这导致其长期滞留在生物体内,因此M/NP引起的细胞的慢性毒性应当予以关注.
4.4.2 蛋白冠
当M/NP进入生物体后,能够迅速被体内的多种蛋白(如白蛋白、免疫球蛋白和载脂蛋白)所包覆,形成“蛋白冠”层.这赋予M/NP新的生物学身份,并介导其与细胞的相互作用[94-95].这意味着通过各种途径进入体内的M/NP在与细胞相互作用之前,已经在其表面形成蛋白冠,导致M/NP的表面性质发生改变.而被蛋白质包裹的M/NP能够更有效地在细胞间进行交换(转胞吐过程)[96].并且M/NP的蛋白冠在体内会随着微环境的不同而发生蛋白冠成分和量的改变[97],使得M/NP与不同类型的组织细胞的作用不同.Ji等人[98]发现PS表面吸附了蛋白后,更容易被A549细胞摄取,但在细胞内转运缓慢,从而在细胞内长时间滞留.但是,Tan等人[99]发现PS表面被胎牛血清包裹后,能减少巨噬细胞对PS的摄入,进而降低细胞的自噬和溶酶体损伤,减轻了细胞毒性.细胞模型的差异可能是结果不一致的一个重要原因.可见,M/NP表面蛋白冠的形成会显著影响其与细胞相互作用以及其生物效应,但相关作用受多种因素影响,需要进一步深入研究.
5 总结和展望
目前环境中存在大量的M/NP,这些M/NP可以通过皮肤接触、呼吸吸入以及消化道摄入等方式进入人体,对人体健康产生潜在威胁.我们分别从M/NP人体暴露途径和潜在危害,M/NP的细胞摄入和外排,M/NP引起的细胞毒性,以及相关影响因素等方面总结了目前的研究进展.总的来说,M/NP的健康效应的研究才刚刚开始,有很多方面亟需进一步深入研究.
目前M/NP的细胞毒性研究中,大多数采用球形PS作为M/NP的模型,无论从M/NP形态上(粒径、形状、表面粗糙度等)还是暴露条件上(时间、剂量等),均与我们接触到的真实环境中的M/NP存在巨大差异.环境中的M/NP不仅化学成分多种多样,制造商还常常在塑料中添加增塑剂、稳定剂和颜料等,其中许多物质是有害的,如干扰内分泌(激素)系统.而且环境中的M/NP多数是纤维或碎片,而不是球形的,这些特征都能影响M/NP的生物效应.此外,M/NP常常是低剂量长期暴露的,因此开展长期低剂量的M/NP的研究更具有现实意义.同时,M/NP难以降解,通过各种屏障进入体内后会长期滞留,由此带来的负面效应也应予关注.如何在现有的实验设计和结果的基础上,建立一套相对完善的M/NP的实验标准,包括M/NP的标准样、实验条件和毒性检测指标,对于获得接近真实条件下的、可重复的实验结果将尤为重要.
由于环境中M/NP处在复杂体系中,它的表面会吸附环境中的各种物质.只关注M/NP本身的生物效应,不足以反映真实体系的情况,需要考虑M/NP的生物冠以及共存的离子/分子对M/NP的生物效应的影响.
技术和方法的革新是科学发展的基础,目前环境中的M/NP形貌各异、种类繁多,缺乏特异性的分析检测手段.我们需要不断地寻求和探索新的技术和方法,以应对这一领域的挑战,如将快速发展的人工智能和机器学习等先进技术用于M/NP基础数据的收集和分析,推动M/NP的安全性的研究,保护人类健康.

