围网与围塘养鱼下沉积物微生物量和群落结构特征差异
梁川,杨艳芳,俞姗姗,周利,张经纬,张秀娟
1. 安徽师范大学地理与旅游学院/江淮流域地表过程与区域响应安徽省重点实验室,安徽 芜湖 241002;2. 安徽师范大学生态与环境学院,安徽 芜湖 241002
随着自然水产资源不能满足人们对水产品日益增长的需求,水产养殖业逐渐成为我国水产品的重要来源而迅速发展。微生物是水产养殖区生态系统重要组成部分,也是评价养殖区生态系统健康的重要指示生物(Vezzulli et al.,2002;Liu et al.,2020)。渔业养殖是水产品养殖重要组成部分。渔业养殖活动可导致肥料、抗生素、饵料和鱼类排泄物大量积累(Wu,1995;Kucuksezgin et al.,2021),改变了养殖区沉积物环境状况(裘琼芬等,2013;Zhou et al.,2020;Kucuksezgin et al.,2021),进而影响了微生物群落结构(裘琼芬等,2013;Zhou et al.,2020;Zhou et al.,2021)。有研究表明渔业养殖改变了原始湿地土壤微生物组成(周雅心等,2021),导致土壤细菌、真菌、革兰氏阳性及革兰氏阴性细菌的生物量显著升高(张广帅等,2020)。渔业养殖也可促使海边湿地沉积物细菌密度及生物量增长了3 倍多(Chelossi et al.,2003),且革兰氏阴性细菌等耐药性微生物数量增加(Chelossi et al.,2003;Zhou et al.,2021)。而高度集约化的网箱养殖模式下沉积物细菌群落多样性和均匀度均显著降低(裘琼芬等,2013)。鱼类养殖品种、养殖规模和鱼食来源对沉积物微生物组成和群落结构特征均有显著影响(Chelossi et al.,2003;Tamminen et al.,2011;Liu et al.,2020)。同时渔业养殖还可能导致沉积物环境潜在的致病细菌和病原微生物富集(Vezzulli et al.,2002;Tamminen et al.,2011;Zhou et al.,2021)。围网和围塘养殖是淡水湖泊两种主要渔业养殖模式。围网养殖区保持着与湖泊的优质水环境联通性,溶解氧丰富,养殖过程中产生的污染物的稀释和扩散也较迅速,但也可能存在因投放饵料和鱼类排泄物导致水体环境污染的问题(吴庆龙等,1995)。围塘养殖与湖泊自然水域隔绝,是一个相对封闭的水体生态系统,其饵料与抗菌剂投放和鱼类排泄物等产生的污染均在围塘内。当前这两种渔业养殖模式下沉积物环境差异及其对微生物群落结构影响的研究甚少。长江沿江湖泊群是我国水产养殖重要水域,“十年禁渔”政策更是促进了该水域水产养殖业蓬勃发展。因此,本文采集了长江沿江湖泊菜子湖围网与围塘养殖区沉积物样品,分析了沉积物基本物理化学性质指标,同时利用PLFAs 方法解析了微生物量和群落组成,探讨养殖方式对养殖区沉积物微生物的影响及其生态指示意义,以期丰富养殖模式对养殖区微生物生态影响的认识,同时为科学合理渔业养殖提供参考。
1 材料与方法
1.1 研究区概况
菜子湖位于安徽省长江北岸,跨安庆及铜陵两市,位30°43′—30°58′N,117°01′—117°09′E,由菜子湖、嬉子湖和白兔湖3 部分组成,是长江中下游湿地和安徽省沿江湿地自然保护区的重要组成部分,也是当前“引江济淮”工程双线引江布局的主力线路,总面积17.3×103hm2。4—10 月为丰水期,11 月至翌年3 月为枯水期。研究区自上世纪50 年代开始大规模围垦,至80 年代开始退耕还湖,且不同退耕还湖区域因地制宜恢复成自然湿地或水产养殖区。2017 年开始,由于“引江济淮”工程开始拆除菜子湖围栏网,禁止湖面养殖。
1.2 样品采集
菜子湖湖区渔业养殖模式主要有两种。围网养殖区是在天然湖泊水域中进行的围栏网养殖区;围塘养殖区是指人工筑坝与自然湖泊水体完全隔开的养殖区。鱼类养殖品种主要是鲢鱼(Hypophthalmichthys molitrix)、草鱼(Ctenopharyngodonidella)、青鱼(Mylopharyngodonpiceus)、鳙鱼(Aristichthysnobilis)和鳜鱼(Sinipercachuatsi)。2018 年3 月,沿菜子湖边水域分别选取6 个渔业养殖区,在区内又分常年淹水区样地和季节性淹水区样地。季节性淹水区在丰水期,尤其每年6—8 月处于淹水状态,而枯水期露出水面。T1、T2和T3位于开围网养殖的季节性淹水区,T4、T5、T6位于围塘养殖的季节性淹水区。季节性淹水区优势种植被均为苔草(Carexspp),伴生少量芦苇(Phragmitesaustralis),但围网养殖区植被覆盖度为75%—95%,而围塘养殖区植被覆盖度为20%—70%。由于2018 年春旱,采样时植被长势较差。T1位于嬉子湖水域西南岸的观莲咀,T2位于先让村西北侧,T3位于盛家咀头西南侧,T4位于兔儿咀,T5位于西瓜咀,T6位于走马墩湖。D1、D2、D3位于围网养殖的常年淹水区,D4、D5、D6位于围塘养殖的常年淹水区。D1位于走马墩湖西南侧,D2、D5位于菜子湖水域东侧,其中D5位于王家咀西南处,而D2位于D5的堤坝外区域,D3位于盛家咀头西南侧。D4位于小木咀南侧;D6位于盛家咀头南侧。每一个样地由3 个样点组成,每个样点样品再由3 个采样点的土壤混合而成。分别用铁铲和抓斗式采样器采集季节性淹水区和常年淹水区沉积物样品。采样深度均约为10 cm。沉积物样品用聚乙烯塑料袋密封编号,装入存有冰袋的冷藏箱临时存储和运输至实验室。
1.3 沉积物基本理化性质测定
沉积物有机质、全磷、有效磷、全氮、碱解氮等基本理化性质的测定方法主要参照鲁如坤主编的《土壤农业化学分析方法》(鲁如坤,2000)。沉积物粒度采用贝克曼COULTER LS230 型激光粒度分析仪进行测定,沉积物pH 按水土质量比2.5∶1测定。
1.4 沉积物微生物PLFAs 分析
采取修正的Bligh & Dyer 方法进行磷脂脂肪酸提取(Bossio et al.,1998)。具体步骤:取3 g 冻干土于50 mL 三角瓶中,加入磷酸缓冲液:氯仿:甲醇缓冲液,体积比为3.2∶4∶8,振荡提取脂类;通过固相抽提柱层析得到磷脂脂肪酸,然后经过碱性甲基化得到磷脂脂肪酸甲脂,采用MIDI 微生物鉴定仪(Agilent 7890A)进行检测。将单个磷脂脂肪酸摩尔百分比低于0.4%的剔除,筛选得到37 种标记物,磷脂脂肪酸鉴定分为6 类(Frostegrd et al.,1996;于小彦等,2020):真菌2 种(16:1 ω5c,18:2 ω6c)、放线菌5 种(16:0 10-methyl、17:1 ω7c 10-methyl、17:0 10-methyl、18:1 ω7c 10-methyl、18:0 10-methyl)、革兰氏阳性细菌8 种(14:0 iso、15:1 iso ω6c、15:0 iso、15:0 anteiso、16:0 iso、17:1 iso ω9c、17:0 iso、17:0 anteiso)、革兰氏阴性细菌11 种(16:1 ω9c、16:1 ω7c、17:1 ω8c、17:0 cyclo ω7c、18:1 ω9c、18:1 ω7c、19:1 ω6c、19:0 cyclo ω7c、20:1 ω9c、21:1 ω3c、22:1 ω3c)、厌氧菌2 种(15:0 DMA、18:0 DMA)、其他细菌9 种(14:00、15:00、16:0 N alcohol、16:00、17:1 anteiso ω9c、17:00、18:00、20:00、22:00)。
1.5 数据处理与分析
采用Microsoft Excel 2016软件进行微生物多样性指数计算,并对实验数据进行处理;采用SPSS 20.0 对数据进行单因素方差分析;应用Origin 2019绘制柱状图及显著性可视化;应用CANOCO 5.0 基于DCA<3.0,选择冗余分析(RDA)来评估细菌群落与环境因子间的关系;应用R 语言(R.4.1.2)绘制相关性热图。
2 结果与分析
2.1 沉积物物理化学性质指标
两种养殖方式下沉积物粒度组成以粉粒为主,其中围网养殖区常年淹水沉积物粉粒含量显著高于围塘养殖区(表1)。常年淹水沉积物pH 和全磷显著高于季节性淹水,但不同养殖模式间差异不显著;围塘养殖区常年淹水沉积物有机质和全氮含量显著低于其他3 个生境,而其他3 个生境间差异不显著;围塘养殖区的季节性淹水沉积物碱解氮显著高于其他3 个生境,而其他3 个生境间差异不显著;而4 个生境间有效磷含量均无显著性差异。总体上,除围塘养殖区沉积物碱解氮显著高于围网养殖区,养殖模式对季节性淹水沉积物其他指标均未有显著性影响;围网养殖区常年淹水沉积物粉粒、有机质和全氮含量显著高于围塘养殖区,其他指标的两种养殖模式间无显著差异。
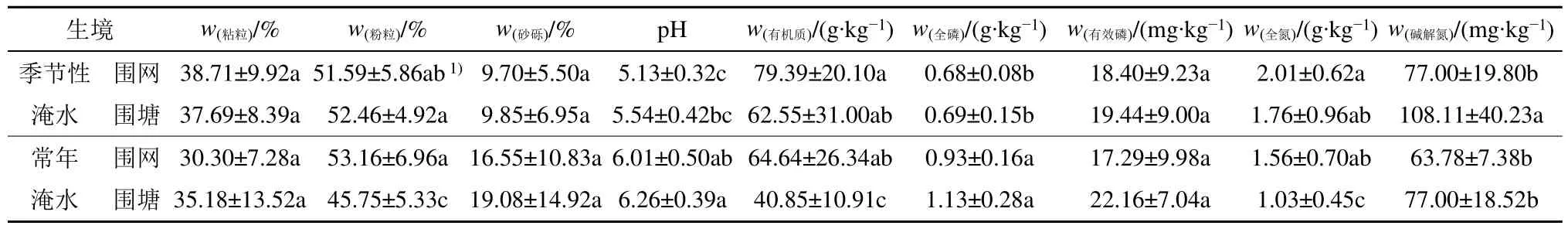
表1 研究区沉积物基本理化性质特征Table1 Basic physical and chemical properties of sediments in the studied area
2.2 沉积物各类群微生物PLFAs 含量
不同生境下微生物生物量主要以细菌为主(表2)。围网养殖区季节性淹水沉积物微生物总生物量、细菌总生物量、放线菌、厌氧菌和真菌生物量显著高于围塘养殖区,而2 种养殖模式下季节性淹水沉积物革兰氏阳性菌(G+)和革兰氏阴性菌(G-)生物量间无显著性差异。围网养殖区常年淹水沉积物微生物总生物量、细菌总生物量(B)、放线菌、厌氧菌生物量、G+、G-和真菌(F)生物量均显著高于围塘养殖区。

表2 研究区不同养殖模式下沉积物微生物PLFAs 含量Table2 The amount of sediment microbial PLFAs under different fish farming models in the studied area
2.3 沉积物微生物群落结构和多样性
研究区沉积物微生物以细菌为主,真菌生物量相对比例较小(2.86%—5.32%)(图1a)。围网养殖区常年淹水沉积物真菌生物量相对比例显著高于围塘养殖区,其他各种群微生物生物量相对比例间无显著性差异。围网养殖区沉积物F/B 均高于围塘养殖区,但仅常年淹水生境下达到显著性差异。围网养殖区沉积物Shannon 指数均显著高于围塘养殖区,Simpson 指数则低于围塘养殖区,但均未达到显著水平。季节性淹水和常年淹水沉积物G+/G-在不同养殖模式下均未有显著性差异(表3)。
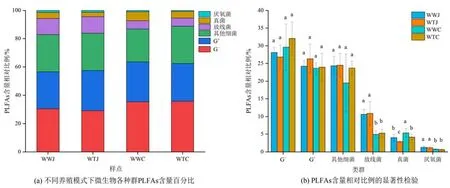
图1 不同养殖模式下微生物各种群PLFAs 含量相对比例及其显著性检验Figure 1 Relative proportions of different microbial population PLFAs in total microbial PLFAs under different fish farming models and their significance tests
2.4 微生物指标与沉积物因子间的相关性分析和冗余分析
研究区季节性淹水沉积物pH 与微生物总量、G-和真菌生物量呈显著负相关关系;季节性淹水沉积物有机质与总微生物量、G-和放线菌生物量达显著正相关关系(图2aI)。常年淹水沉积物粉粒含量与总细菌生物量和除了放线菌微生物外的其他类群生物量均存在显著正相关关系;常年淹水沉积物有机质与总微生物量、G+、放线菌、真菌和厌氧菌生物量均存在显著正相关关系;而全氮与放线菌、真菌和厌氧菌生物量均存在显著正相关关系(图2aⅡ)。季节性淹水沉积物微生物Shannon 指数与粘粒含量呈显著正相关,与砂粒和全磷存在显著负相关关系;而Simpson 指数与粘粒含量显著负相关,但与砂粒和全磷存在显著正相关关系;F/B 与有效氮存在显著负相关关系(图2bⅢ)。常年淹水沉积物G-生物量相对比例与粘粒和pH 存在显著正相关关系,与砂粒存在显著负相关关系;真菌生物量相对比例与粘粒、pH 和全氮呈显著正相关关系,而与砂粒呈显著负相关关系;其中G+/G-与粘粒和pH 呈显著负相关关系,而与砂粒呈显著正相关;F/B 与粉粒含量、有机质和全氮呈显著正相关关系,而与砂粒量呈显著负相关关系(图2bⅣ)。
研究区微生物PLFAs 含量和环境因子间的RDA 分析表明,季节性淹水沉积物的物理化学性质指标仅能解释71.8%的沉积物微生物量差异(图3a)。有机质是解释季节性淹水沉积物微生物量差异的主要环境因子,其单独解释量高达 36.2%(P=0.010);其次pH 与全磷解释量分别为25.4%(P=0.046)和21.4%(P=0.072)。若按照不断加入环境因子后所能增加的解释量计算,有机质具有季节性沉积物各菌群微生物量差异最大的累积解释量(36.2%),且达到显著水平(P=0.010)。本文所分析的理化性质指标能解释86.6%的常年淹水沉积物微生物量差异(图3b);粉粒、有机质、全氮、有效磷和全磷是解释常年淹水沉积物微生物量差异的主要环境因子,其单独解释量分别为45.1%、31.4%(P<0.01)、27.7%、19.0%和14.1%(P<0.05);具有常年淹水沉积物微生物量差异较大累积解释量的是粉粒、有效磷、有机质,其解释量分别为45.1%、25.9%和10.8%(P<0.01)。

图3 研究区微生物生物量和群落结构指标与环境因子的RDA 分析Figure 3 RDA analysis of microbial biomass and community structure indexes and environmental factors in the studied area
RDA 分析结果表明本研究所分析的理化性质指标仅能解释39.4%的季节性淹水沉积物微生物群落结构差异(图3c);砂粒是解释季节性淹水沉积物微生物群落分布的主要环境因子,单独解释量为16.1%(P=0.080),也是最大累积解释量因素(16.1%)。所分析常年淹水沉积物理化性质指标能解释68.0%的微生物群落结构差异(图3d);有机质、粉粒、有效磷、砂粒和全氮是解释常年淹水沉积物微生物群落分布的主要环境因子,其单独解释量分别为35.9%(P=0.006)、20.7%(P=0.030)、18.1%(P=0.016)、13.4%(P=0.056)和11.8%(P=0.088);有机质、砂粒和有效磷是具有较大累积解释量的环境因子,其累积解释量分别为35.9%、12.5%和12.0%,且均达到显著水平(P<0.01)。
3 讨论
微生物PLFAs 既能反映出微生物数量的大小,又能反映出微生物活性潜力(Frostegrd et al.,1996;Bossio et al.,1998)。有研究发现渔业养殖可导致沉积物微生物密度和生物量增长(Chelossi et al.,2003)。研究区除G+细菌和G-细菌生物量外,围网养殖区季节性淹水沉积物中微生物PLFAs 总量、细菌总PLFAs 量和其他微生物量均显著高于围塘养殖区;围网养殖区常年淹水沉积物微生物PLFAs总量、细菌总PLFAs 量、各类细菌生物量和真菌生物量均显著高于围塘养殖区。高的养分条件是沉积物具有较高微生物量的重要因素(Bahram et al.,2018;于小彦等,2020)。渔业养殖活动可促使养殖区饵料、鱼类排泄物和残体大量富集(Wu,1995;Kucuksezgin et al.,2021),促使水体和沉积物养分含量大量提升(Zhou et al.,2020;Kucuksezgin et al.,2021)。确实研究区围网养殖区季节性淹水和常年淹水沉积物养分含量均高于围塘养殖区,但在常年淹水沉积物中表现更为显著(表1)。相关性分析也表明,研究区季节性淹水沉积物有机质与总微生物量、G-和放线菌生物量呈显著的正相关关系,而常年淹水沉积物有机质与总微生物量、G+、放线菌、真菌和厌氧菌生物量均存在显著正相关关系;常年淹水沉积物全氮与放线菌、真菌和厌氧菌生物量均存在显著正相关关系。RDA 分析进一步表明解释季节性淹水沉积物微生物量差异的有机质、pH 和全磷等环境因子中,有机质累积解释量最高;而解释常年淹水沉积物微生物量差异的粉粒、有机质、全氮、有效磷和全磷等环境因子中,粉粒、有效磷和有机质具有相对较大的累积解释量。有研究发现粘粒和粉粒含量相对高的土壤拥有更高的微生物量(刘秉儒等,2019),研究区围网养殖下常年淹水沉积物粉粒含量显著高于围塘养殖区,但季节性淹水沉积物则无显著性差异。总体上本文所分析的理化性质指标能解释71.8%季节性淹水沉积物微生物量差异和86.6%常年淹水沉积物微生物量差异,表明还有其他一些因素影响养殖区沉积物微生物量的差异。有研究表明人类活动干扰可导致土壤微生物PLFAs含量下降(Martensson et al.,2012),如在渔业养殖过程中会施用抗生素、抗菌剂等(Chelossi et al.,2003;卓丽等,2019),均可能促进养殖区沉积物微生物量降低。相对于与自然水体连通的开放式围网养殖区,围塘养殖区封闭式环境下投入的抗生素类污染物更容易在沉积物累积,不利于沉积物微生物生长。因此,研究区不同养殖模式导致沉积物理化性质及抗生素类污染状况存在差异,促使围塘养殖区沉积物微生物量显著低于围塘养殖区;微生物量较好地响应了研究区养殖模式对沉积物生态系统的影响,但在常年淹水沉积物中表现更为显著。
渔业养殖不仅影响养殖区沉积物微生物量,也影响着微生物群落结构(裘琼芬等,2013;Zhou et al.,2020;Zhou et al.,2021)。养殖区整体上两种养殖模式下季节性淹水沉积物放线菌生物量相对比例显著高于常年淹水沉积物,而常年淹水沉积物真菌生物量相对比例显著高于季节性淹水沉积物。这符合土壤放线菌是好氧腐生细菌的属性(de Menezes et al.,2015),也与湿地土壤围垦养殖可以导致真菌生物量升高(张广帅等,2020;周雅心等,2021)的结果相似。围网养殖区季节性淹水和常年淹水沉积物真菌生物量相对比例显著高于围塘养殖区;同时季节性淹水和常年淹水沉积物真菌细菌比也均表现为围网养殖区高于围塘养殖区,但仅在常年淹水条件下具有显著性差异。一般认为细菌偏好分解容易分解的有机质;而真菌偏好难分解的纤维素和木质素以及高碳氮比的有机物(Ingwersen et al.,2008)。研究区围网养殖区沉积物有机质含量相对较高,且主要来源于覆盖度更高的湿地植物,适宜真菌降解和生长,而围塘养殖区更多来源于较易于分解的饵料,有利于细菌生长。由于真菌细菌比是微生物群落结构重要指标之一,高的真菌细菌比意味着更稳定的生态系统(De et al.,2006)。因此,研究区围网养殖区沉积物生态系统比围塘养殖区更稳定。水产养殖改变了沉积物理化性质及污染等环境状况(裘琼芬等,2013;Zhou et al.,2020;Kucuksezgin et al.,2021),进而影响了微生物群落结构(裘琼芬等,2013;Zhou et al.,2020;Zhou et al.,2021)。本研究区分析结果也表明不同养殖模式下沉积物化学指标存在差异(表1),同时沉积物F/B、G-生物量相对比例、真菌生物量相对比例等微生物群落结构指标与沉积物粘粒、砂粒、有机质、全氮等物理化学指标存在显著相关性(图2b)。有研究认为沉积物有机质、磷素和氮素等化学性质影响着沉积物微生物群落结构(杨长明等,2018;于小彦等,2020;Zhou et al.,2020)。同时土壤质地也深刻地影响土壤微生物群落结构(王群艳等,2016),有研究发现鄱阳湖湿地土壤微生物群落结构组成与土壤砂粒含量呈显著相关关系(张广帅等,2018)。RDA 分析也表明研究区砂粒是解释季节性淹水沉积物微生物群落特征差异的重要环境因子;有机质、砂粒和有效磷是解释常年淹水沉积物微生物群落特征差异的重要环境因子。然而,所分析的理化性质指标仅能分别解释39.4%研究区季节性淹水沉积物微生物群落结构差异和68.0%常年淹水沉积物微生物群落结构差异,表明尚有一些其他影响因素。在渔业养殖过程中施用了抗生素、抗菌剂等(Chelossi et al.,2003;卓丽等,2019),可促进沉积物中耐药性更强的革兰氏阴性菌生物量的增加(Chelossi et al.,2003;Zhou et al.,2021)。研究区G-是沉积物中生物量相对比例最大的菌群(图1),且常年淹水沉积物G-生物量均高于季节性淹水沉积物,但未达到显著水平。总体上,研究区微生物群落结构指标基本上反映了养殖模式对沉积物生态系统影响及其稳定性,但养殖模式的影响在常年淹水沉积物表现更显著。
一般生物多样性高的生态系统稳定性就高。围网养殖区沉积物微生物多样性及丰富度显著高于围塘养殖区,但优势度较围塘养殖区低,且差异不显著。同时微生物多样性指数与真菌细菌比相互佐证了围网养殖区沉积物生态系统更加稳定。沉积物细菌多样性主要由pH 和养分状况等环境因子决定和控制(杨长明等,2018;Bahram et al.,2018;于小彦等,2020;Zhou et al.,2020)。研究区季节性淹水沉积物微生物Shannon 指数与粘粒含量呈显著正相关,与砂粒和全磷存在显著负相关关系,而Simpson 指数与粘粒含量呈显著负相关,但与砂粒和全磷存在显著正相关关系;而常年淹水沉积物Shannon 指数和Simpson 指数与所测理化性质指标均未有显著性相关性。同时含水量、土壤有机质等养分非均质分布是导致土壤微生物分布和多样性重要因素(Zhou et al.,2002;Curd et al.,2018;王好才等,2021)。相对于季节性淹水沉积物环境,常年淹水增加了微生物在沉积物环境中的移动性、氧化还原电位和养分分布均匀性,破坏了沉积物空隙隔离效应(朱义族等,2019)。同时长期性淹水条件增加了微生物群落的环境压力,导致了沉积物具有相对高抗压的微生物优势种群,但促使微生物多样性降低(朱义族等,2019)。另外渔业养殖过程施用抗生素、抗菌剂等(Chelossi et al.,2003;卓丽等,2019)更易于在围塘养殖区沉积物中累积,而围网养殖区水体与自然水体连通交换,可能是导致围塘养殖区沉积物微生物多样性更低的另一因素。相对于围网养殖区,围塘养殖区更强烈的人类活动可能也破坏了养殖区沉积物异质性,加上抗生素类污染物的影响,促使微生物多样性较低。因此,沉积物微生物多样性指数基本上反映了两种养殖模式下沉积物生态系统状况及其渔业养殖模式的影响。
4 结论
菜子湖不同养殖模式下人类干扰活动强度和自然水域连通性不同,导致不同养殖模式下沉积物环境物理化学性质及抗菌剂类污染物影响存在差异,沉积物微生物通过调整生物量和种群组成以适应环境差异,进而促使沉积物微生物生物量和群落结构发生改变。研究区内沉积物微生物生物量和群落结构均较灵敏地反映了养殖模式的影响,常年淹水下养殖模式的影响更为明显。相对于围塘养殖区,围网养殖区沉积物拥有更高的微生物生物量和多样性,更有利于维持养殖区沉积物生态系统功能和稳定性。

