氧诱导视网膜病变模型小鼠肾组织代谢组学研究
董利军 祁慧 杨宇航 毛星星 张国明 张少冲 雷和田
深圳市眼科医院 暨南大学附属深圳眼科医院 深圳市眼病防治研究所,深圳 518040
早产儿视网膜病变(retinopathy of prematurity,ROP)是一种由于视网膜发育障碍导致血管异常增生的潜在致盲眼病,早产儿数量的急剧增加使ROP已成为全球儿童盲的主要原因之一[1]。视网膜激光光凝是ROP的一线治疗方案,但对Ⅰ区病变和急进型后极部ROP治疗效果欠佳[2]。随着对ROP发病机制的深入研究,玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物已经成为一种有效治疗ROP的新手段[3]。但是,有大量文献报道了注射抗VEGF药物产生的不良事件,尤其是肾相关疾病,包括蛋白尿恶化、高血压和血管凝血事件以及肾小球相关疾病[4-7]。ROP和肾损伤是氧化应激反应诱发的早产儿典型疾病,早产儿极易受到氧化应激的影响,氧化剂和抗氧化剂之间的不平衡导致自由基水平升高,进而对器官造成氧化损伤[8]。在大鼠氧诱导视网膜病变(oxygen-induced retinopathy,OIR)模型中,肾皮质中VEGF-A和血小板衍生因子β的表达在出生第5天(P5)和P19时与Ⅰ期ROP和Ⅱ期ROP相似,表明高氧诱导肾脏生成受损的机制与ROP相似[9]。因此推测2种组织在高氧诱导下的病理变化可能有一定关联,而从代谢组学的角度探讨OIR小鼠肾组织与血浆的代谢机制可能为相关研究和临床工作提供新的思路。OIR模型是一种公认的研究视网膜新生血管疾病的动物模型[10-11]。OIR模型的高通量转录组和蛋白组学研究发现大量的分子网络和潜在的治疗靶点[12-14]。然而,许多生命活动发生在代谢物层面,如细胞信号释放、能量传递、细胞间通信等都受代谢物调控[15]。因此,可通过代谢组学分析来识别疾病的病理过程[16]。代谢组学已广泛应用于ROP及其他视网膜病理性新生血管增生类疾病的研究中,如增生性糖尿病视网膜病变患者玻璃体液和ROP患者血浆[11,17]、OIR动物模型血浆及视网膜等样本中代谢产物的差异研究等[18]。然而,临床研究和实验研究发现氧代谢相关疾病可同时引起眼部和肾组织相似反应,但ROP与早产儿高氧导致肾损伤的机制研究很少,其致病机制是否也相似需进一步证实。本研究拟采用非靶向代谢组学方法分析OIR小鼠肾匀浆的代谢产物变化,结合OIR小鼠靶向代谢组学的的方式探讨高氧导致的肾损伤及ROP病理性新生血管形成的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 取16只7日龄健康SPF级C57/B6J小鼠及相应母鼠,小鼠雌雄不限,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006]。采用随机数字表法将小鼠分为OIR组和正常对照组,每组8只,采用常规饲料喂养小鼠,饲养于北京大学深圳研究生院实验动物中心SPF级实验室[SYXKC(粤)2017-0172]。动物饲养及使用均严格按照暨南大学伦理委员会要求,研究方案经暨南大学伦理委员会审核批准(批文号:20200401-54)。
1.1.2主要试剂及仪器 甲醇、甲酸、乙腈(北京索莱宝科技有限公司);L-2-氯苯丙氨酸、磷酸盐缓冲液(phosphate buffer saline,PBS)、4%多聚甲醛、Triton X-100、牛血清白蛋白(bovine serum albumin,BSA)(广州哲泰生物科技有限公司);异凝集素(Isolectin B4,IB4)(美国赛默飞世尔科技有限公司);抗荧光淬灭封片剂(北京索莱宝科技有限公司)。动物氧箱(YCP1600,长沙华曦电子科技有限公司);全自动样品快速研磨仪(Wonbio-E,上海万柏生物科技有限公司);台式高速冷冻离心机(TGL-16MS,上海卢湘仪离心机仪器有限公司);冷冻浓缩离心干燥器(LNG-T98,太仓市华美生化仪器厂);超声波清洗机(F-060SD,深圳福洋科技集团有限公司);QEplus高分辨质谱仪(美国赛默飞世尔科技公司);ACQUITY UPLC I-Class plus高效液相色谱仪、ACQUITY UPLC HSS T3 (100 mm×2.1 mm,1.8 μm色谱柱(美国Waters公司);AX激光扫描共聚焦显微镜(日本尼康公司)。
1.2 方法
1.2.1OIR小鼠模型的建立 取OIR组小鼠,根据参考文献[19]中OIR的方法制备OIR模型,自P8起,将小鼠及其母鼠置于(75±2)%的动物氧箱中,每隔2 d更换垫料、饲料、水和母鼠,高氧环境下连续饲养5 d后(P12)更换至正常环境中继续饲养5 d(P17)。正常对照组8只小鼠于正常环境饲养至出生后第17天(P17)。
1.2.2小鼠视网膜铺片IB4染色观察视网膜血管增生情况 根据参考文献[20]中的方法,各组小鼠于P17行CO2安乐死,取出小鼠视网膜后用PBS清洗血渍,吸水纸吸去多余水分,置于4%多聚甲醛中固定30 min,转移至0.5% Triton X-100中破膜过夜,PBS清洗3次并于体视显微镜下清除黏附杂质,转移至1%BSA溶液稀释的IB4染色剂(1∶200)中避光孵育过夜。将染色后的视网膜转移至凹形载玻片,并于视网膜中心3:00、6:00、9:00、12:00方向1 mm处切开分成4个象限平铺于载玻片上,避光滴加4 ℃预冷的冰甲醇固定10 min,重复操作2次。预冷PBS漂洗3次后吸干多余PBS,滴加抗荧光淬灭封片剂封片后用激光扫描共聚焦显微镜采集图像。
1.2.3小鼠血浆氨基酸类代谢物的靶向代谢组学分析 各组小鼠于P17通过眼眶内眦静脉采血500 μl,采集的血液存放于EDTA抗凝管内,离心半径10 cm,4 ℃下3 000 r/min离心10 min,取上清血浆保存于-80 ℃中,用于靶向代谢组学测定。4 ℃条件下融化血浆样品,在100 μl血浆样品中加入400 μl无水乙腈,剧烈振荡30 s,室温下静置10 min,4 ℃条件下12 000 r/min离心10 min,收集上清液,用0.22 μm滤膜过滤,取150 μl滤液进行靶向代谢组学测定。仪器参数设置如下:流动相为80%乙腈(15.4 mol/L)的等温洗脱;流速为140 μl/min。中性氨基酸采用中性损失扫描进行扫描,中性损失片段的质荷比(mass-to-charge ratio,m/z)为102 Da,扫描范围为m/z 140到m/z 280。酰基肉碱分析采用前体扫描方法进行,子离子为m/z 85 Da片段,扫描范围为m/z 210到m/z 502。甘氨酸、鸟氨酸、精氨酸和柠檬酸采用多反应监测。
1.2.4液相色谱-质谱联用法检测小鼠肾组织中代谢物 用CO2将小鼠安乐死,用灭菌手术剪及镊子开腹并取出肾组织,用预冷PBS洗去血渍,吸干表面水渍,装入无菌EP管,用液氮速冻15 min,于-80 ℃保存。取30 mg小鼠肾组织置于1.5 ml EP管中,分别加入20 μl含0.06 mg/ml的L-2-氯苯丙氨酸甲醇溶液和400 μl 80%甲醇溶液,置于-20 ℃中预冷2 min后用功率为60 Hz的研磨机研磨2 min,置于冰水中超声(超声功率500 W,频率40 kHz)提取10 min,于-20 ℃中静置30 min。4 ℃条件下13 000 r/min离心10 min,取300 μl上清液装入LC-MS进样小瓶中挥干,用300 μl体积分数20%甲醇涡旋30 s,超声3 min进行复融,-20 ℃静置2 h,4 ℃条件下13 000 r/min离心10 min,取150 μl上清液,用0.22 μm滤膜过滤后转入进样小瓶,进行液相色谱-质谱(liquid chromatograph mass spectrometer,LC-MS)检测。所有样本的提取液等体积混合制备成质控样本。
采用ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 um)色谱柱,保持柱温为45 ℃,进样体积为2 μl;流动相中水相为0.1%甲酸水溶液,有机相为含有0.1%甲酸的乙腈溶液,流速为0.35 ml/min。采用梯度洗脱:0.01~2 min,5%有机相;2~4 min,5%~30%有机相;4~8 min,30%~50%有机相;8~10 min,50%~80%有机相;10~14 min,80%~100%有机相;14~15 min,100%有机相;15~15.1 min,100%~5%有机相;15.1~16 min,5%有机相。样品质谱信号采集采用正负离子扫描模式,离子源为电喷雾电离离子源(ESI),正负离子喷雾电压分别设定为3 800 V和-3 000 V,正负离子辅助鞘气流速和辅助气体流量分别设定为40 Arb、10 Arb和35 Arb、8 Arb。毛细管温度为320 ℃,辅助燃气加热器温度为350 ℃,质量扫描范围为m/z 100~1 200 Da,全毫秒分辨率和MS/MS分辨率为70 000和17 500,阶梯式NCE梯度为10、20、40 eV。
1.2.5采用生物信息学法分析肾组织中的差异代谢物 采用代谢组学处理软件Progensis QI v2.3对LC-MS获得的原始数据进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化,根据精确质量数(误差小于5个ppm)、二级碎片以及同位素分布对化合物进行鉴定,采用METLIN、Lipidmaps(v2.3)和人代谢组学数据库(Human Metabolome Database,HMDB)及上海鹿明生物科技有限公司自建数据库进行定性分析。根据化合物定性结果评分对提取的数据进行筛选,将高于36分的化合物合并成1个包含保留时间、m/z、峰强度和样品信息的数据矩阵。
对数据矩阵进行分析,首先采用无监督的主成分分析(principal component analysis,PCA)来观察各组肾组织样本之间的总体分布和整个分析过程的稳定性;然后采用有监督的偏最小二乘法分析(partial least-squares-discriminant analysis,PLS-DA)及正交偏最小二乘法分析(orthogonal partial least-squares-discriminant analysis,OPLS-DA)区分各组间代谢轮廓的总体差异,在此过程中用参数R2X、解释率R2Y和预测率Q2进行质量评价,采用7次循环交互验证和200次响应排序检验(response permutation testing,RPT)法考察模型质量,防止模型过拟合。根据OPLS-DA模型得到变量权重值(variable importance of projection,VIP),以VIP>1为筛选条件评估2个组之间有差异的代谢产物及其倍数变化(fold change,FC)。
1.2.6肾组织代谢产物KEGG富集通路分析 对筛选得到的差异代谢物利用其KEGG ID在KEGG(http://www.kegg.jp)数据库进行富集分析,应用超几何检验,找出与整个背景相比,在显著性差异表达代谢物中显著富集的代谢通路,以P≤0.05为阈值,满足此条件的代谢通路为在差异代谢物中显著富集的代谢通路,P值越小,则该代谢通路的富集越显著。
1.3 统计学方法
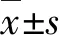
2 结果
2.1 2个组小鼠视网膜血管分布及无灌注区相对面积比较
视网膜铺片IB4染色结果显示,正常对照组P17小鼠视网膜血管均匀分布于整个视网膜,血管走行正常;OIR组小鼠视网膜中央出现大面积的无灌注区,与血管区界限明显,其分界处形成大量新生血管簇,血管走行紊乱(图1)。OIR组视网膜无灌注区相对面积为(25.16±3.50)%,明显大于正常对照组的(0.63±0.30)%,差异有统计学意义(t=12.07,P<0.001)。
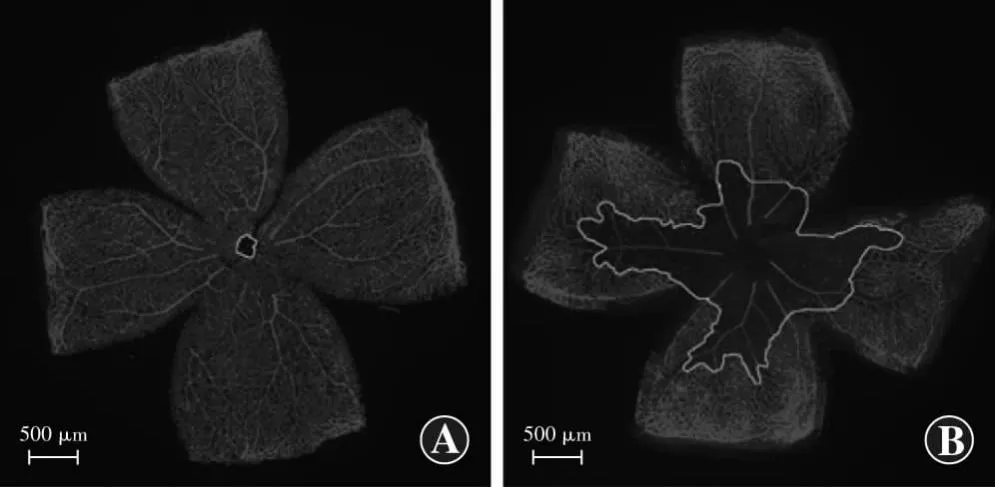
图1 2个组小鼠视网膜血管分布及定量分析(标尺=500 μm,IB4) A:正常对照组小鼠视网膜血管分布正常 B:OIR组小鼠视网膜血管迂曲,中央区可见大面积无灌注区
2.2 2个组小鼠肾组织差异代谢产物差异及其倍数比较
PCA结果显示,OIR组与对照组小鼠的肾组织样本主成分PC1和PC2上投影的得分在坐标轴上相距较远,样本之间总体区分明显。OPLS-DA模型中R2X cum为0.578,R2Y cum为0.978,Q2 cum为0.857,均大于0.5,表明该模型与数据拟合良好,具有较好的预测能力。循环交互验证和RPT验证OPLS-DA模型中的R2和Q2分别为0.9和-0.488,所有R2和Q2均低于原始值,表明模型不存在过度拟和。OPLS-DA评分图显示,OIR组和正常对照组代谢产物分别位于模型投影左侧和右侧且相距较远,表明2个组间小鼠代谢产物明显不同(图2)。

图2 2个组小鼠肾组织代谢产物分析图 A:PCA表达的代谢产物总体分布图 B:OPLS-DA测试的代谢轮廓图 C:RPT的反应排序图 蓝色矩形和红色三角分别代表正常对照组小鼠肾组织样本和OIR组肾组织小鼠样本
OPSL-DA模型载荷图显示,代谢物磷脂酰胆碱(phosphatidylcholine,PC)14∶1(9Z)/20∶2(11Z,14Z)、左旋异亮氨酸、左旋组氨酸、2-羟基苯丙烯酸权重较大,可能是缺氧条件下导致血管增生的主要因子,而OPLS-DA S-plot图显示,PC 14∶1(9Z)/20∶2(11Z,14Z)、左旋异亮氨酸与主成分具有良好的相关性(图3)。

图3 2个组小鼠肾组织代谢产物OPLS-DA模型的载荷图和S-plot图 A:载荷图 图中每个点代表一种代谢物,代谢物距离载荷图中心的距离越远,载荷值越接近于-1或1,即该代谢产物作用愈大 B:S-plot图 横坐标是组间比较的代谢产物与影响的特征值,纵坐标是代谢产物得分。代谢产物越靠近右上角和左下角,表示组间差异越显著
依据OPLS-DA模型第一主成分VIP>1为筛选标准,共筛选出组间差异代谢物236个,其中表达上调134个,下调102个(图4)。
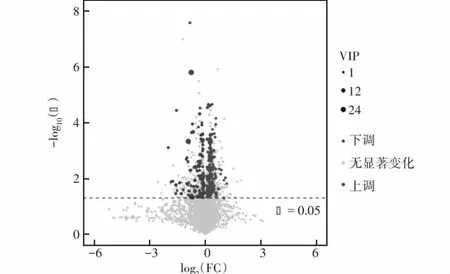
图4 2个组小鼠肾组织差异代谢产物火山图 圆点越大提示VIP值越大,VIP值≥1且远离坐标轴原点者为优先考虑的潜在生物标志物 VIP:变量权重值;FC:倍数变化
2.3 2个组小鼠肾组织差异代谢物的鉴定及分层聚类分析
对筛选的VIP值>1结合t检验中P<0.05的差异代谢产物标准在HMDB、Lipidmaps、METLIN以及自建库进行比对鉴定,得到26种有意义的化合物(表1)。OIR组小鼠肾组织中甘油磷脂类化合物PC 20∶4(5Z,8Z,11Z,14Z)/0∶0和PC22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/0∶0代谢产物表达上调,PC 14∶1(9Z)/20∶2(11Z,14Z)和PE P-18∶0/20∶4(6E,8Z,11Z,14Z)(5OH[S])代谢产物表达下调。氨基酸类代谢物精氨酸、鸟氨酸、哌可酸和羟基赖氨酸代谢产物水平升高。
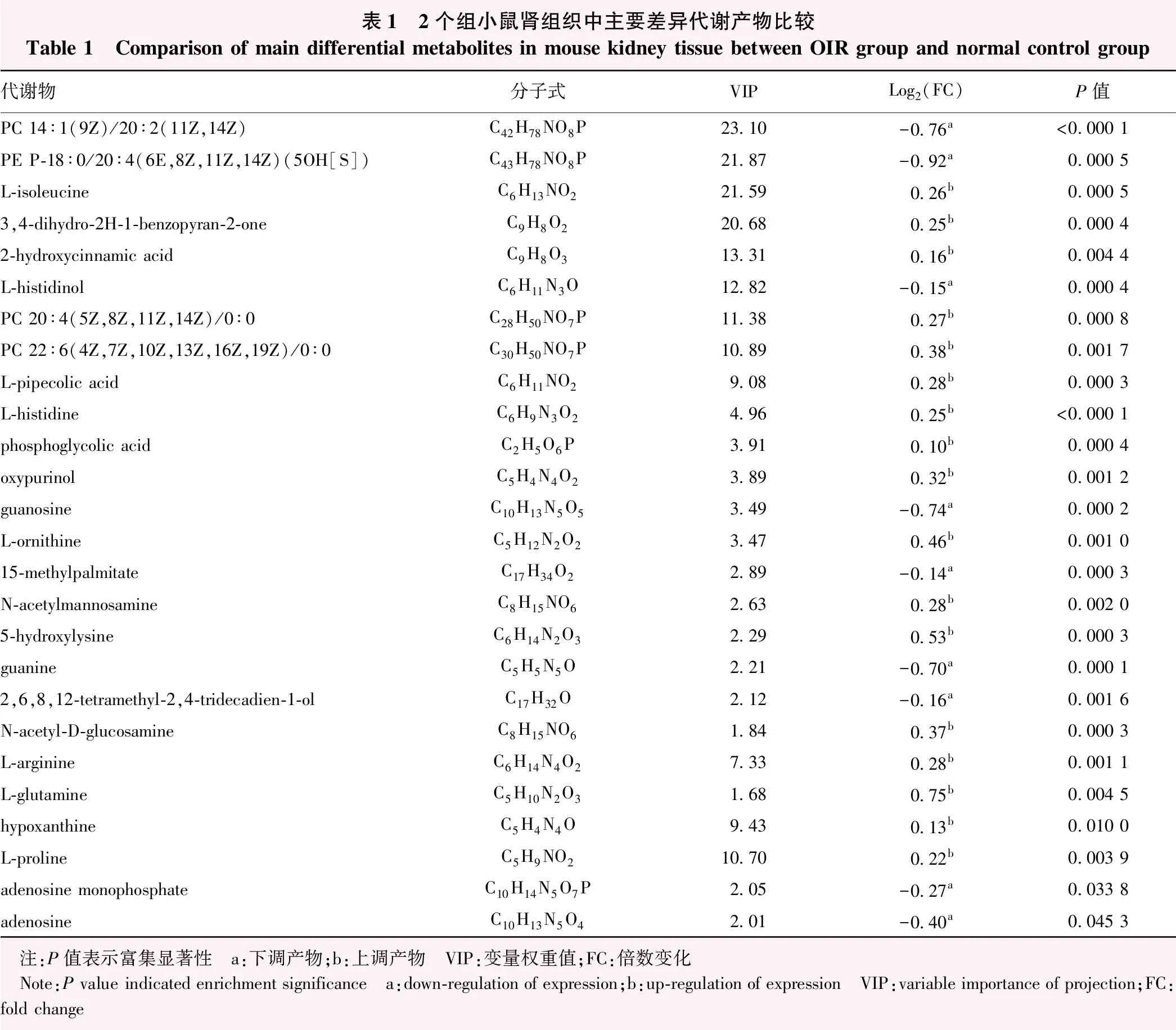
表1 2个组小鼠肾组织中主要差异代谢产物比较Table 1 Comparison of main differential metabolites in mouse kidney tissue between OIR group and normal control group代谢物分子式VIPLog2(FC)P值PC 14∶1(9Z)/20∶2(11Z,14Z)C42H78NO8P23.10-0.76a<0.000 1PE P-18∶0/20∶4(6E,8Z,11Z,14Z)(5OH[S])C43H78NO8P21.87-0.92a0.000 5L-isoleucineC6H13NO221.590.26b0.000 53,4-dihydro-2H-1-benzopyran-2-oneC9H8O220.680.25b0.000 42-hydroxycinnamic acidC9H8O313.310.16b0.004 4L-histidinolC6H11N3O12.82-0.15a0.000 4PC 20∶4(5Z,8Z,11Z,14Z)/0∶0C28H50NO7P11.380.27b0.000 8PC 22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/0∶0C30H50NO7P10.890.38b0.001 7L-pipecolic acidC6H11NO29.080.28b0.000 3L-histidineC6H9N3O24.960.25b<0.000 1phosphoglycolic acidC2H5O6P3.910.10b0.000 4oxypurinolC5H4N4O23.890.32b0.001 2guanosineC10H13N5O53.49-0.74a0.000 2L-ornithineC5H12N2O23.470.46b0.001 015-methylpalmitateC17H34O22.89-0.14a0.000 3N-acetylmannosamineC8H15NO62.630.28b0.002 05-hydroxylysineC6H14N2O32.290.53b0.000 3guanineC5H5N5O2.21-0.70a0.000 12,6,8,12-tetramethyl-2,4-tridecadien-1-olC17H32O2.12-0.16a0.001 6N-acetyl-D-glucosamineC8H15NO61.840.37b0.000 3L-arginineC6H14N4O27.330.28b0.001 1L-glutamineC5H10N2O31.680.75b0.004 5hypoxanthineC5H4N4O9.430.13b0.010 0L-prolineC5H9NO210.700.22b0.003 9adenosine monophosphateC10H14N5O7P2.05-0.27a0.033 8adenosineC10H13N5O42.01-0.40a0.045 3 注:P值表示富集显著性 a:下调产物;b:上调产物 VIP:变量权重值;FC:倍数变化 Note:P value indicated enrichment significance a:down-regulation of expression;b:up-regulation of expression VIP:variable importance of projection;FC:fold change
分层聚类分析结果显示,相较于正常对照组,OIR组肾组织中氨基酸类代谢物精氨酸、鸟氨酸、哌可酸、脯氨酸和羟基赖氨酸含量及甘油磷脂类化合物PC 14∶1(9Z)/20∶2(11Z,14Z)、PE P-18∶0/20∶4(6E,8Z,11Z,14Z)(5OH[S])含量均明显升高,PC 20∶4(5Z,8Z,11Z,14Z)/0∶0、PC 22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/0∶0含量及嘌呤类(鸟嘌呤、羟嘌醇)和脂肪酸类(15-棕榈酸甲酯、2,6,8,12-tetramethyl-2,4-tridecadien-1-ol)含量均降低(图5)。

图5 2个组小鼠主要差异代谢产物聚类热图 垂直轴代表代谢产物,水平轴代表不同样本组。红色表示代谢产物含量最高,蓝色表示含量最低,轴上的分叉越近说明相似度越高 OIR:氧诱导视网膜病变;WT:野生型
2.4 2个组小鼠肾组织中差异代谢产物KEGG通路富集
差异代谢物KEGG通路富集分析结果显示,差异代谢产物的前10个富集通路主要涉及ABC转运蛋白、嘌呤代谢、癌症中的胆碱代谢、氨酰-tRNA生物合成、mTOR信号通路、精氨酸生物合成、蛋白质消化吸收、吗啡成瘾、癌症中的中心碳代谢、cGMP-PKG信号通路(图6)。

图6 2个组小鼠主要差异代谢产物排名前20 KEGG富集通路气泡图 富集因子越大,提示富集程度越高;气泡点越大,说明该通路上发生变化的代谢物越多
2.5 小鼠血浆氨基酸类代谢产物的靶向鉴定
根据VIP值结合t检验P<0.05的标准对小鼠血浆氨基酸类代谢产物在HMDB、Lipidmaps、METLIN以及自建库比对鉴定得到11种具有明显差异的主要氨基酸类代谢物。与正常对照组比较,OIR组小鼠血浆内天冬酰胺和丁酰肉碱的代谢水平降低,缬氨酸、酪氨酸、亚油基肉碱、半胱氨酸、十四碳二烯酰肉碱、丙氨酸、瓜氨酸、色氨酸和癸二烯酰肉碱的代谢水平明显升高(表2)。KEGG通路分析表明,这些代谢产物主要富集在氨酰-tRNA生物合成,精氨酸生物合成,缬氨酸、亮氨酸和异亮氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,泛酸和CoA生物合成,癌症中的中心碳代谢,缬氨酸、亮氨酸和异亮氨酸降解,ABC转运蛋白等信号通路(图7)。
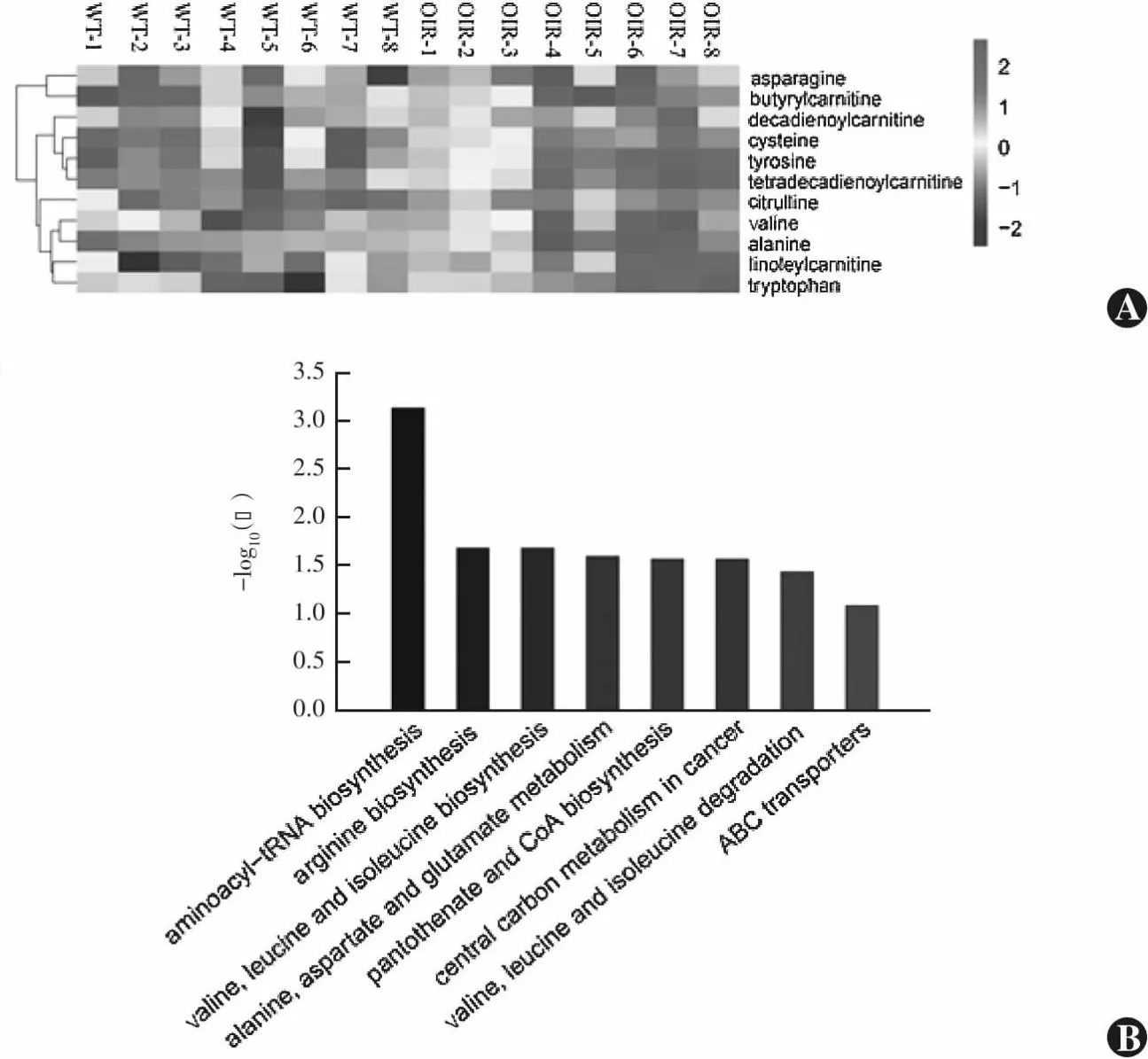
图7 2个组小鼠血浆主要差异代谢产物聚类热图和KEGG通路分析 A:小鼠血浆主要差异代谢产物聚类热图 B:代谢通路富集图 WT:野生型;OIR:氧诱导视网膜病变
3 讨论
ROP是一种以视网膜缺血、病理性新生血管形成为特点,发生于早产儿和低出生体重儿的不可逆致盲视网膜病变,主要特征是玻璃体中VEGF表达水平上调,但其具体发病机制尚未完全阐明。有研究发现,大鼠OIR模型中同时存在高氧诱导的肾生成受损机制,认为其可能是由活性氧和VEGF-A引起的微血管生成改变所致[9]。VEGF在维持正常肾功能方面也起着至关重要的作用,从足细胞释放的VEGF与肾小球毛细血管上的VEGF受体2相互作用,促进内皮孔的完整性和维持由此产生的肾小球屏障功能[21],而缺氧会诱导VEGF分泌,充足和适量VEGF的产生和血管生成对肾脏和眼组织正常功能的维持是必要的,但高水平的VEGF会导致血管过度生成,从而导致ROP、糖尿病视网膜病变和肾病等的发生[22-24]。而以OIR小鼠为研究对象,用代谢组学的方法探寻高氧导致肾损伤的机制,可以从人体的整合医学角度为ROP的发病机制研究提供新的思路。
本研究中,OIR小鼠肾组织匀浆中氨酰-tRNA生物合成相关的代谢物表达增多。已有研究显示,ROP患者和OIR模型大鼠的血浆中、OIR模型小鼠的视网膜匀浆中氨酰-tRNA生物合成通路代谢物发生变化[17,20,25]。同时有研究报道白内障合并糖尿病患者房水中氨酰-tRNA生物合成通路代谢物发生变化[26]。在秀丽隐杆线虫的正向遗传筛选得到的编码氨酰-tRNA合成酶的基因合成酶的rrt-1,敲除rrt-1和大多数其他编码氨酰-tRNA合成酶的基因,可以使动物免于缺氧诱导的死亡[27]。因此,高氧诱导肾损伤的发病可能与氨酰-tRNA的生物合成有关。
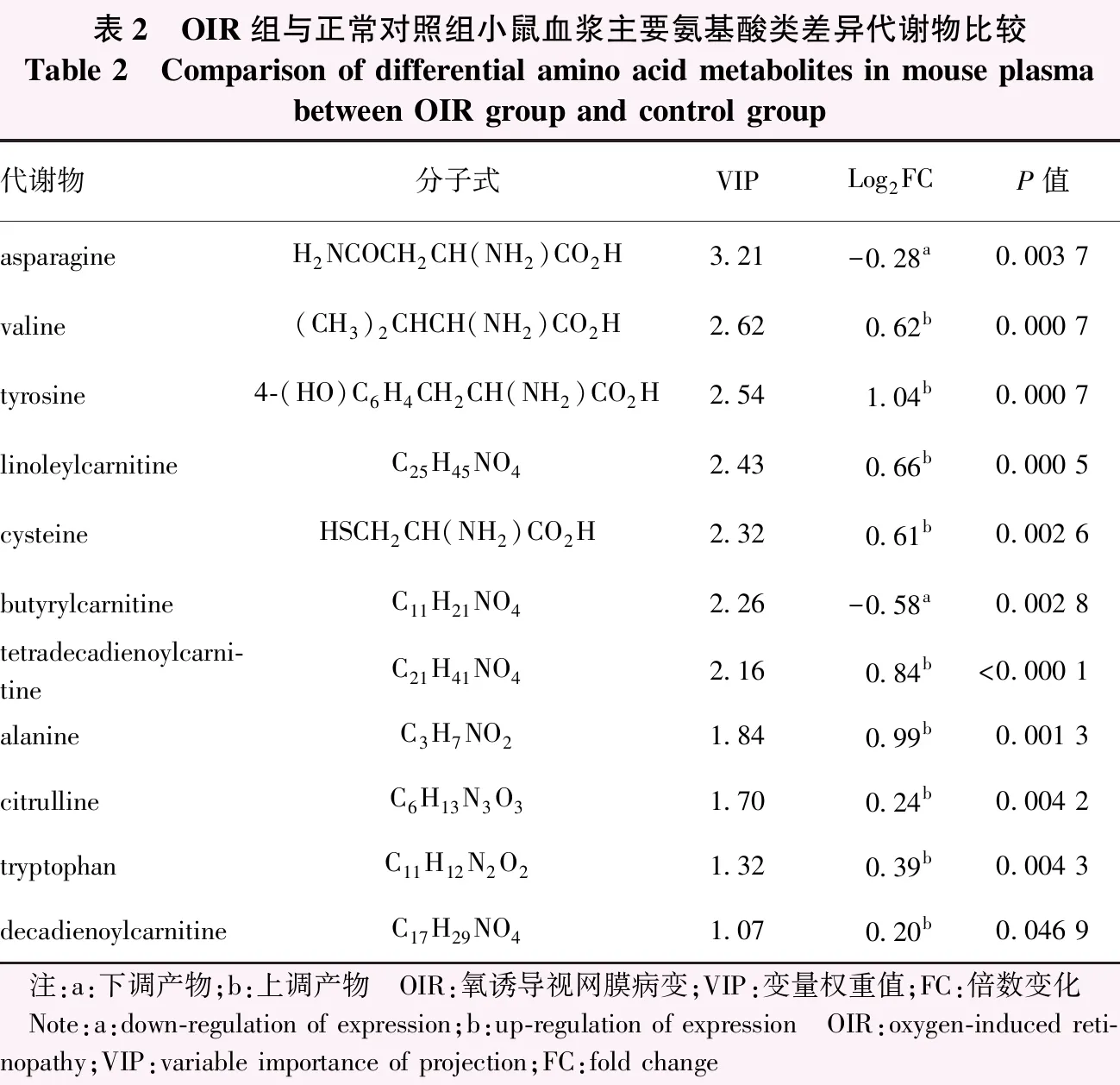
表2 OIR组与正常对照组小鼠血浆主要氨基酸类差异代谢物比较Table 2 Comparison of differential amino acid metabolites in mouse plasma between OIR group and control group代谢物分子式VIPLog2FCP值asparagineH2NCOCH2CH(NH2)CO2H3.21-0.28a0.003 7 valine(CH3)2CHCH(NH2)CO2H2.620.62b0.000 7tyrosine4-(HO)C6H4CH2CH(NH2)CO2H2.541.04b0.000 7linoleylcarnitineC25H45NO42.430.66b0.000 5cysteineHSCH2CH(NH2)CO2H2.320.61b0.002 6butyrylcarnitineC11H21NO42.26-0.58a0.002 8tetradecadienoylcarni-tineC21H41NO42.160.84b<0.000 1alanineC3H7NO21.840.99b0.001 3citrullineC6H13N3O31.700.24b0.004 2 tryptophanC11H12N2O21.320.39b0.004 3decadienoylcarnitineC17H29NO41.070.20b0.046 9 注:a:下调产物;b:上调产物 OIR:氧诱导视网膜病变;VIP:变量权重值;FC:倍数变化 Note:a:down-regulation of expression;b:up-regulation of expression OIR:oxygen-induced reti-nopathy;VIP:variable importance of projection;FC:fold change
本研究中,OIR组小鼠肾组织匀浆中精氨酸、鸟氨酸、谷氨酸和脯氨酸表达增多,这4种氨基酸是“精氨酸和脯氨酸代谢途径”的重要组成部分。Lu等[18]认为精氨酸和脯氨酸代谢是造成大鼠血管增生的主要途径。Wang等[28]研究结果表明,GCN2/ATF4通路通过氨基酸介导的VEGF表达促进肿瘤生长和血管生成,而限制氨基酸通过GCN2/ATF4途径诱导血管生成能够调节VEGF和H2S的产生[29]。此外,氨基酸剥夺能够诱导人视网膜色素上皮细胞株VEGF的表达[30]。因此,氨基酸及其相关途径可能在高氧诱导肾损伤的发病中发挥重要作用,而在OIR小鼠血浆样本靶向氨基酸代谢组学中,精氨酸生物合成通路同样富集大量差异代谢物,表明在高氧诱导下肾损伤与视网膜病变的发病机制可能具有相似性。进一步的研究需要揭示氨基酸代谢的功能和机制以及这些交叉参与的途径在视网膜新生血管中的作用。
本研究结果还显示,OIR组小鼠血浆中蛋白质的消化与吸收通路发生改变,与既往对ROP患者血浆和OIR小鼠视网膜的代谢组学分析结果一致[17-18,31]。蛋白质的消化和吸收在促进早产儿发育和降低早产儿患病风险方面起着重要作用[32]。本研究还发现OIR小鼠肾匀浆中的ABC转运蛋白相关代谢产物大量富集,ABC转运蛋白是在长期进化中形成的高度保守的一大基因家族编码的一类跨膜蛋白,含有负责多种底物跨细胞膜运输的膜蛋白。这些底物包括代谢产物、药物、毒素、内源性脂类、多肽、核苷酸和甾醇[33]。在低氧状态下,已证实其对P-糖蛋白编码基因(ABCB1)的调节作用[34]。而ABCA1基因也在低氧诱导下在内皮细胞中表达[35],其已经被证实能够通过介导ABCA1基因表达来抑制黑色素瘤血管生成和发展[36]。
同时本研究还发现,OIR小鼠肾组织嘌呤代谢途径中代谢物发生变化,而在ROP相关的代谢物研究中未见报道,而嘌呤代谢途径可能与糖尿病微血管并发症的发生密切相关[37]。本研究中代谢物腺苷含量降低,次黄嘌呤和黄嘌呤含量升高,嘌呤代谢循环中,腺苷被转化成腺嘌呤,然后脱氨形成肌苷,肌苷被转化为次黄嘌呤,次黄嘌呤在黄嘌呤氧化酶的作用下被转化为黄嘌呤,黄嘌呤也是黄嘌呤氧化酶的底物,可增加超氧化物的生成。而超氧化物能够刺激机体新生血管生成[38]。
总之,本研究确定了OIR小鼠肾组织匀浆中代谢谱的变化。通过生物信息学分析,ABC转运蛋白、嘌呤代谢途径、氨酰-tRNA生物合成、精氨酸生物合成和蛋白质的消化与吸收是与发生改变的代谢物相关的主要KEGG途径。这些代谢物以及涉及的代谢途径,可能参与了肾损伤和视网膜新生血管疾病的病理过程。然而本研究中未能同时综合分析OIR小鼠血浆、视网膜以及肾匀浆样本代谢产物,不利于发现缺氧诱导的肾损伤和ROP发病机制之间的关联,还要通过化合物诱导以及基因敲除的方式在后续研究中对本研究筛选到的代谢物以及代谢通路进行验证,进一步探讨其具体的作用机制。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明董利军:参与酝酿和设计实验、实施研究、采集数据、分析/解释数据、文章撰写;祁慧、杨宇航、毛星星:参与实施研究、采集数据;张国明、张少冲:参与实验设计及论文指导;雷和田:参与实验设计、论文审阅及定稿

