姜黄素对葡萄膜黑色素瘤细胞恶性生物学行为及Wnt/β-catenin通路的抑制作用
盛小红 王利明 赵鑫 辛向阳
内蒙古包钢医院眼科,包头 014010
葡萄膜黑色素瘤(uveal melanoma,UM)是成人常见的原发性眼内肿瘤,起源于脉络膜、睫状体或虹膜内的黑色素细胞[1]。目前,针对该肿瘤的临床一线治疗方法包括手术切除、放射治疗和眼球摘除;然而,高达50%的UM会发生转移,1年生存率仅为15%[2-3]。因此,积极探索UM潜在转移机制并开发有效方法对于提高患者生存率至关重要。Wnt/β-连环蛋白(β-catenin)通路是调节胚胎发育和细胞干性的关键级联反应之一[4];其在肿瘤增生和发展中发挥关键作用,在结肠癌、乳腺癌等多种癌症中均已证实被激活[5-6]。对不同病理类型的UM进行微小RNA差异表达谱分析发现,差异微小RNA靶基因广泛参与Wnt通路,且该通路参与了肿瘤的生长与转移[7]。阻断Wnt/β-catenin通路可抑制UM细胞的生长、迁移和侵袭等恶性表型[8]。以上研究结果提示,Wnt/β-catenin通路可能是干预UM转移及发展的有效分子机制靶点。姜黄素是一种从姜黄的根茎中提取的天然活性酚类化合物。研究发现,其可抑制黑色素瘤肺转移[9],还可通过线粒体途径诱导人UM细胞死亡[10],提示姜黄素对UM可能具有一定治疗潜力。M23细胞是实验研究中常用的人UM细胞系、细胞株之一,本研究拟探讨姜黄素对体外培养M23细胞增生、凋亡、迁移及侵袭等生物学行为的作用及Wnt/β-catenin通路相关蛋白表达的影响,以期为UM的预防转移、治疗及预后提供一定参考。
1 材料与方法
1.1 材料
1.1.1细胞系及实验动物 人UM细胞系M23购自上海细胞库(美国菌种保藏中心)。6周龄SPF级雌性BALB/c小鼠20只,体质量(16±2)g,购自济南朋悦实验动物繁育有限公司[许可证号:SCXK(鲁)2019-0003]。所有小鼠于相同环境恒温(22±2)℃、恒湿(55±5)%下普通饲养,自由进食饮水,12 h光-暗交替,适应性培养1周。动物实验过程遵循动物福利3R原则,经内蒙古包钢医院实验动物伦理委员会审核批准(批文号:2021MER-023)。
1.1.2主要试剂及仪器 姜黄素(纯度≥98%)(458-37-7,四川维克奇生物科技有限公司);Matrigel基质胶(356234,美国BD公司);细胞计数试剂盒8(cell counting kit-8,CCK8)(sck0105,上海生博生物医药科技有限公司);AnnexinV-FITC/PI流式细胞凋亡检测试剂盒(KGA106,南京凯基生物科技公司);BCA蛋白浓度测定试剂盒(PC0020,北京索莱宝科技有限公司);兔抗β-catenin(ab223075)、兔抗轴抑制蛋白2(axis inhibition protein 2,Axin2)(ab109307)、兔抗细胞周期蛋白D1(Cyclin D1)(ab16663)、兔抗Survivin(ab76424)、兔抗c-Myc(ab32072)单克隆抗体,兔抗基质金属蛋白酶9(matrix metallo proteinase 9,MMP-9)(ab38898)多克隆抗体,辣根过氧化物酶偶联的二抗(ab150077,美国Abcam公司);兔抗糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)单克隆抗体(YT782,北京百奥莱德科技有限公司);兔抗磷酸化GSK-3β(p-GSK-3β)多克隆抗体(PL0303230,加拿大PL Laboratories公司)。IX70型倒置相差显微镜(日本OLYMPUS公司);Allegra 64R低温高速离心机(美国贝克曼库尔特有限公司);ABI 7300型实时荧光定量PCR系统(美国ABI公司);Gel Doc XR+凝胶成像分析系统(美国BIO-RAD公司)。
1.2 方法
1.2.1细胞复苏、培养及培养液配制 用含10%胎牛血清的DMEM完全培养液复苏M23细胞,于37 ℃、5% CO2的培养箱中培养,传代2~3次。采用848.32 ml含10%胎牛血清的DMEM完全培养液溶解20 mg姜黄素以制备原始浓度为80 μmol/L姜黄素的条件培养液,后取适量80 μmol/L姜黄素的条件培养液进行倍比稀释以制备含20、40 μmol/L姜黄素的条件培养液。
1.2.2CCK8法检测细胞存活率 收集对数生长期M23细胞,分别采用含0、20、40及80 μmol/L姜黄素培养液重悬细胞,调整细胞密度为2×104个/ml。细胞以每孔2×103个密度接种于96孔板中,每个浓度各设置5个复孔。培养48 h后,各孔加入10 μl CCK8溶液,37 ℃下孵育2 h,采用酶标仪于450 nm处测定吸光度(absorbance,A)值,细胞存活率(%)=各浓度姜黄素组A值/0 μmol/L姜黄素组A值×100%。实验重复3次。
1.2.3平板克隆形成实验检测细胞集落数 收集对数生长期M23细胞,采用含0、20、40和80 μmol/L姜黄素的DMEM完全培养液重悬,以每孔1×103个细胞密度接种至6孔板内,每3天更换1次培养液;培养2周后,PBS洗涤2次,4%多聚甲醛溶液室温固定15 min,0.1%结晶紫溶液染色20 min,PBS洗涤2次,晾干,观察集落形成情况并计数。光学显微镜下观察细胞形态,ImageJ软件统计细胞克隆形成的集落数目,超过50个细胞的集落被认为1个集落形成。实验重复3次。
1.2.4流式细胞仪检测细胞凋亡率 收集对数生长期M23细胞,采用含0、20、40和80 μmol/L姜黄素的DMEM完全培养液重悬,以每孔1×105个细胞接种至6孔板内并连续培养48 h。胰蛋白酶消化,PBS洗涤2次,1 000 r/min(离心半径10 cm)离心5 min,收集细胞,加入结合缓冲液重悬并调整细胞密度为1×106个/ml,连续加入5 μl Annexin V-FITC溶液、5 μl PI溶液,室温避光染色15 min,采用流式细胞仪检测细胞凋亡率。实验重复3次。
1.2.5细胞划痕实验检测细胞迁移率 收集对数期M23细胞,以每孔5×105个接种至24孔板内培养,直至细胞融合,利用无菌10 μl移液枪头尖端划线,PBS洗涤,更换不含胎牛血清的含0、20、40和80 μmol/L姜黄素的DMEM培养液继续培养48 h;在划痕后0 h和48 h拍照,采用ImageJ软件测量划痕宽度。计算细胞迁移率,细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。实验重复3次。
1.2.6Transwell实验检测细胞侵袭数 采用Matrigel基质胶涂布Transwell上室,4 ℃下干燥,将不同浓度姜黄素处理48 h后的各组细胞用胰蛋白酶消化,采用不含胎牛血清的对应培养液重悬;调整细胞密度为2×106个/ml,以100 μl/孔接种至Transwell 24孔板上室,下室加入500 μl含20%胎牛血清的DMEM培养液,48 h后用95%乙醇固定Transwell下侧侵入的细胞30 min,0.1%结晶紫染色15 min,400倍光学显微镜下随机选取5个视野进行观察并拍照,统计细胞数目,重复计数3次,取平均值。实验重复3次。
1.2.7实时荧光定量PCR法检测Wnt/β-catenin通路相关基因表达 采用含0、20、40、80 μmol/L姜黄素的DMEM完全培养液重悬对数生长期M23细胞,以1×105个/孔接种至6孔板内并连续培养48 h。采用Trizol试剂提取各组细胞总RNA,紫外分光光度计测定RNA纯度及浓度后,通过琼脂糖凝胶电泳技术检测RNA完整性,利用逆转录试剂盒将RNA反转录为cDNA。c-Myc基因引物序列:正向为5'-GGCAAAAGG TCAGAGTCTGG-3',反向为5'-GTGCATTTTCGGTTGTT GC-3';CyclinD1基因引物序列:正向为5'-CCGCCTC ACACGCTFCCTCTC-3',反向为5'-TCCTCCTCGGCGG CCTTGGGG-3';Survivin基因引物序列:正向为5'-TGGACAAACAAAGAGCCAAGAA-3',反向为5'-TAGA GCAAAGCCACAAAACCAA-3';MMP-9基因引物序列:正向为5'-TTGACAGCGACAAGAAGTGG-3',反向为5'-GCCATTCACGTCGTCCTTAT-3';GAPDH基因引物序列:正向为5'-ATTTGGTCGTATTGGG CG-3',反向为5'-TGGAAGATGGGTGATGGGATT-3'。各基因引物由上海生工生物工程有限公司合成。以cDNA为模板,对各基因引物于ABI7300系统上进行实时荧光定量PCR分析,反应条件:95 ℃预变性3 min;95 ℃变性5 s,58 ℃退火及延伸1 min,共39个循环。以GAPDH为内参,采用2-ΔΔCt法计算各目的基因相对表达量。实验重复3次。
1.2.8Western blot法检测Wnt/β-catenin通路相关蛋白表达水平 采用含0、20、40、80 μmol/L姜黄素的DMEM完全培养液重悬对数生长期M23细胞,以1×105个孔密度接种至6孔板内并连续培养48 h。1 000 r/min离心5 min收集细胞,PBS清洗3次,RIPA裂解缓冲液提取细胞总蛋白。采用BCA法测定总蛋白浓度,上样20 μg总蛋白进行SDS-PAGE凝胶电泳分离,湿法转印至PVDF膜;取PVDF膜于含0.05 g/ml脱脂奶粉的三乙醇胺缓冲盐水溶液(tris buffered saline,TBS)中室温封闭1 h,置于相应一抗(均1∶1 000稀释)中4 ℃孵育过夜,TBS洗膜3次;辣根过氧化物酶偶联的二抗(1∶10 000稀释)室温孵育1 h,TBS洗膜3次;ECL发光液显色,全自动凝胶成像系统拍照。采用ImageJ软件分析条带灰度值,以目的蛋白与内参GAPDH灰度值比值表示各蛋白相对表达量。
1.2.9UM荷瘤小鼠模型的建立及分组处理 于20只小鼠左后腹皮下脂肪垫注射M23细胞悬浮液100 μl(1×107个细胞),接种5 d后接种部位可触摸到结节为造模成功。将造模成功小鼠按照随机数字表法随机分为模型组、姜黄素低、中和高剂量组,每组各5只,分别于腹腔内注射含0、10、20和40 mg/kg姜黄素的生理盐水溶液,每日注射1次,连续注射30 d。
1.2.10肿瘤质量检测 各组小鼠末次给药后禁食24 h,颈椎脱臼法处死后,剥离小鼠左后腹皮下瘤体并称取肿瘤质量,比较各组小鼠肿瘤质量。
1.3 统计学方法
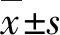
2 结果
2.1 各组细胞形态及存活率比较
倒置显微镜下观察可见,M23细胞相互连接紧密,呈融合状纺锤形;经不同浓度姜黄素作用后细胞逐渐变得扁平、狭长,假足状突起逐渐增多,细胞密度逐渐减小(图1)。不同浓度姜黄素组间M23细胞存活率总体比较差异有统计学意义(F=125.321,P<0.001);M23细胞存活率随姜黄素浓度升高而降低,组间两两比较差异均有统计学意义(均P<0.05)(表1)。
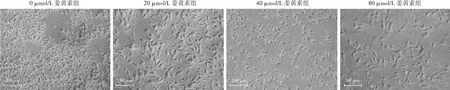
图1 光学显微镜下不同浓度姜黄素组M23细胞形态图(×100,标尺=200 μm) 随着姜黄素浓度的增加,细胞密度逐渐降低,其中0 μmol/L姜黄素组细胞呈融合状纺锤形,不同浓度姜黄素组处理后细胞逐渐变得扁平、狭长
2.2 不同浓度姜黄素组细胞集落形成数比较
随着姜黄素作用浓度增大,细胞集落数逐渐减少(图2)。不同浓度姜黄素组M23细胞集落形成数总体比较差异有统计学意义(F=97.941,P<0.001);M23细胞集落形成数随姜黄素浓度增大而减少,组间两两比较差异均有统计学意义(均P<0.05)(表2)。

表1 不同浓度姜黄素组M23细胞存活率比较(x±s,%)Table 1 Comparison of survival rate of M23 cells among different concentrations of curcumin groups (x±s,%)组别样本量细胞存活率0 μmol/L姜黄素组3100.00±0.0020 μmol/L姜黄素组383.78±4.59a40 μmol/L姜黄素组366.09±3.92ab80 μmol/L姜黄素组347.16±3.63abcF值125.321P值<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test)
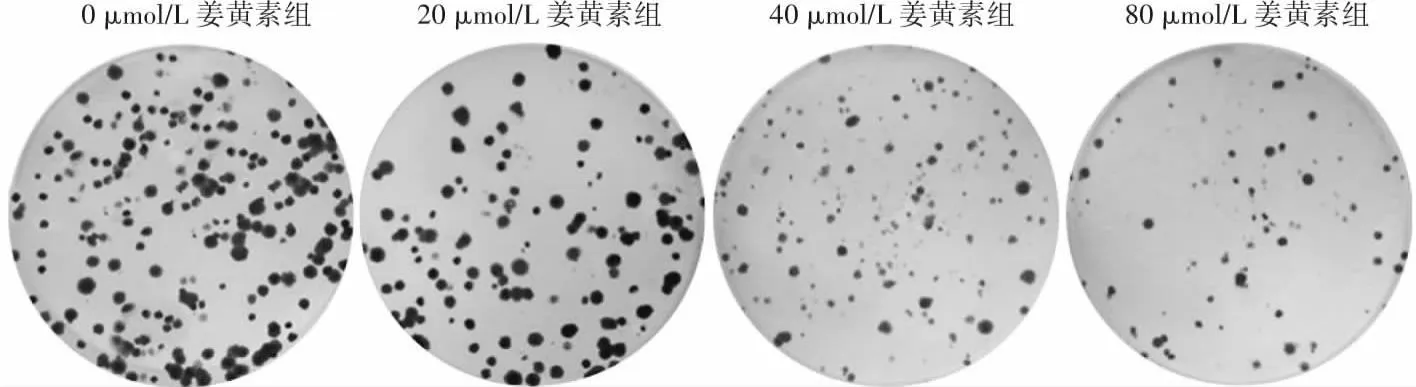
图2 各浓度姜黄素组M23细胞集落形成情况 细胞集落数随着姜黄素浓度的增加而逐渐减少
2.3 不同浓度姜黄素组细胞凋亡率比较
流式细胞术检测结果显示,随姜黄素浓度增大,早期凋亡及晚期凋亡细胞逐渐增多(图3)。不同浓度姜黄素组细胞凋亡率总体比较差异有统计学意义(F=72.516,P<0.001);M23细胞凋亡率随姜黄素作用浓度增加而逐渐升高,组间两两比较差异均有统计学意义(均P<0.05)(表3)。

表2 不同浓度姜黄素组细胞集落形成数量比较(x±s,个)Table 2 Comparison of colony formation number of M23 cells among different concentrations of curcumin groups (x±s,pcs)组别样本量集落形成数0 μmol/L姜黄素组3128.7±9.220 μmol/L姜黄素组3100.3±8.7a40 μmol/L姜黄素组358.7±6.6ab80 μmol/L姜黄素组331.7±4.9abcF值97.941P值<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05(One-way ANOVA,LSD-t test)

图3 不同浓度姜黄素组细胞凋亡流式细胞图 细胞早期及晚期凋亡率随着姜黄素浓度的增加而逐渐升高
2.4 不同浓度姜黄素组细胞迁移率比较
随着姜黄素作用浓度增加,细胞生长迁移速度减慢(图4)。不同浓度姜黄素组M23细胞迁移率总体比较差异有统计学意义(F=277.097,P<0.001);其中M23细胞迁移率随姜黄素作用浓度增加而降低,组间两两比较差异均有统计学意义(均P<0.05)(表4)。

图4 不同浓度姜黄素组细胞迁移情况 细胞迁移速度随着姜黄素浓度的增加逐渐减慢
2.5 不同浓度姜黄素组细胞侵袭数目比较
随着姜黄素浓度增加,侵袭细胞密度逐渐减小(图5)。不同浓度姜黄素组M23侵袭细胞数总体比较差异有统计学意义(F=139.006,P<0.001);M23侵袭细胞数随姜黄素作用浓度增加而减少,各组间两两比较差异均有统计学意义(均P<0.05)(表5)。
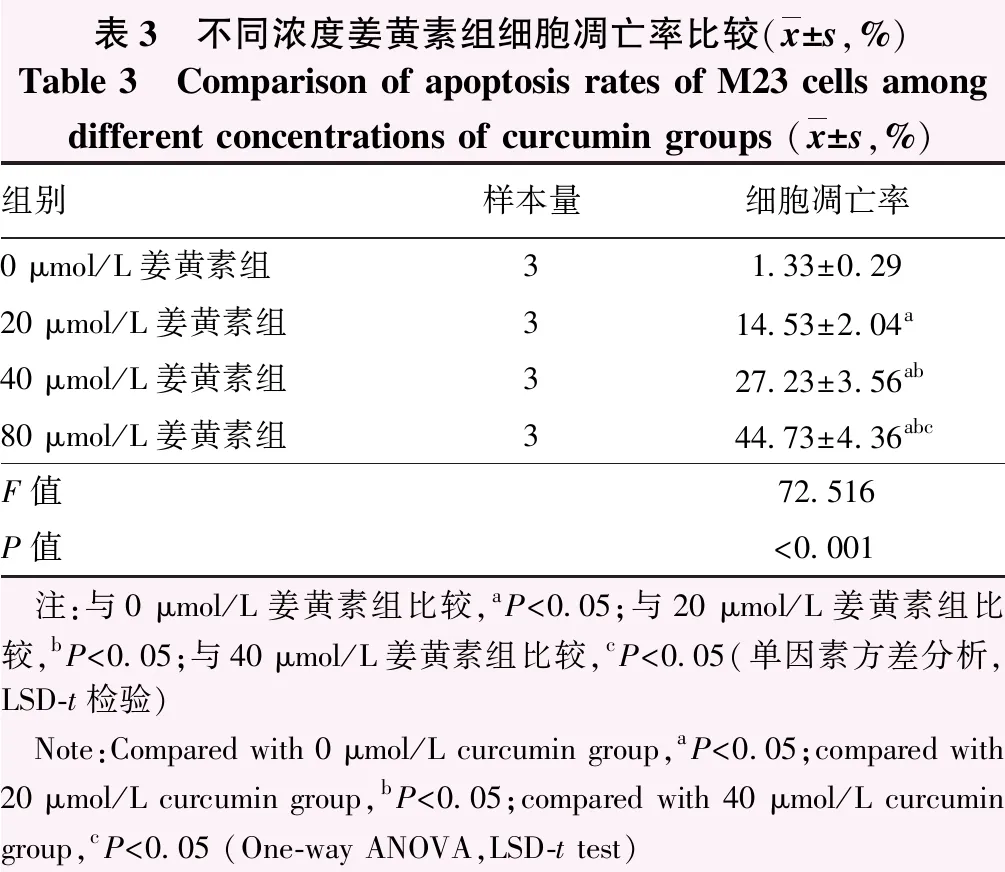
表3 不同浓度姜黄素组细胞凋亡率比较(x±s,%)Table 3 Comparison of apoptosis rates of M23 cells among different concentrations of curcumin groups (x±s,%)组别样本量细胞凋亡率0 μmol/L姜黄素组31.33±0.2920 μmol/L姜黄素组314.53±2.04a40 μmol/L姜黄素组327.23±3.56ab80 μmol/L姜黄素组344.73±4.36abcF值72.516P值<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test)

图5 各浓度姜黄素组细胞侵袭情况(结晶紫 ×400,标尺=50 μm) 侵袭细胞密度随着姜黄素浓度的增加逐渐降低
2.6 不同浓度姜黄素组Wnt/β-catenin通路相关基因表达水平比较
不同浓度姜黄素组M23细胞c-Myc、CyclinD1、Survivin及MMP-9 mRNA相对表达水平总体比较差异均有统计学意义(F=241.558、269.804、179.680、284.000,均P<0.001);其中M23细胞c-Myc、Cyclin D1、Survivin及MMP-9 mRNA相对表达水平均随姜黄素作用浓度增加而降低,组间两两比较差异均有统计学意义(均P<0.05)(表6)。
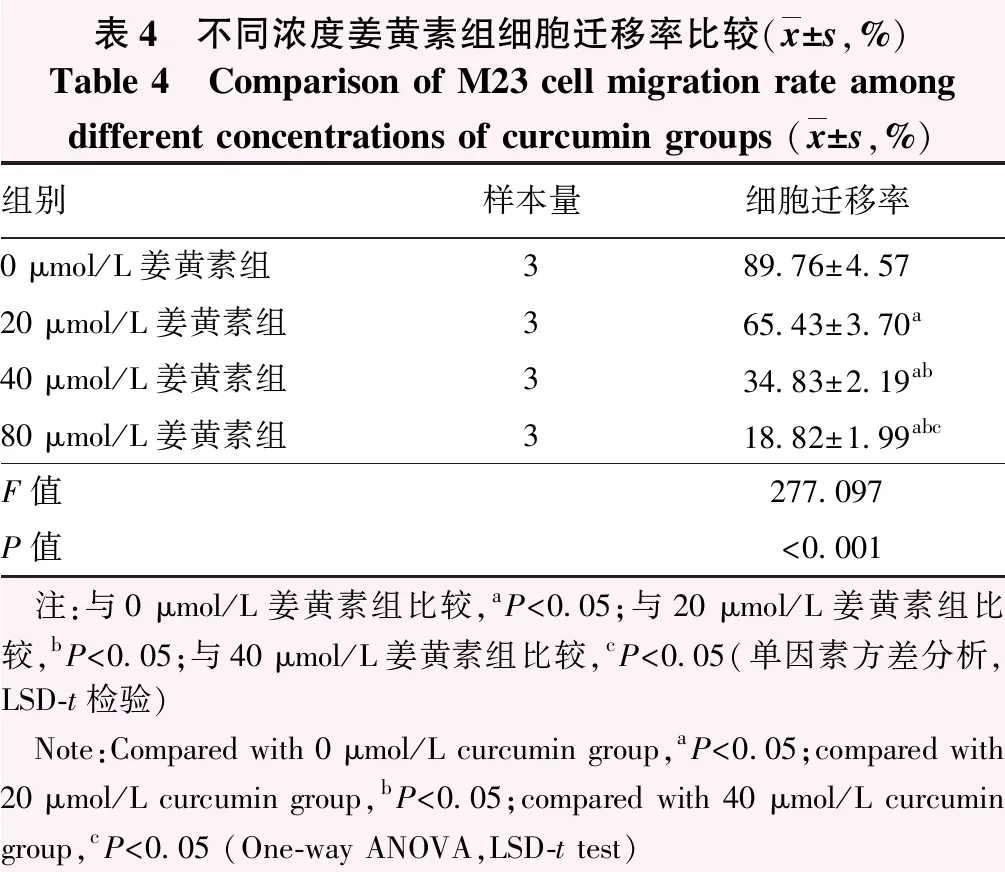
表4 不同浓度姜黄素组细胞迁移率比较(x±s,%)Table 4 Comparison of M23 cell migration rate among different concentrations of curcumin groups (x±s,%)组别样本量细胞迁移率0 μmol/L姜黄素组389.76±4.5720 μmol/L姜黄素组365.43±3.70a40 μmol/L姜黄素组334.83±2.19ab80 μmol/L姜黄素组318.82±1.99abcF值277.097P值<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test)
2.7 不同浓度姜黄素组Wnt/β-catenin通路相关蛋白表达水平比较
与0 μmol/L姜黄素组比较,20 μmol/L、40 μmol/L及80 μmol/L姜黄素组细胞β-catenin、p-GSK-3β、c-Myc、Cyclin D1、Survivin及MMP-9蛋白电泳条带灰度值逐渐减弱,Axin2蛋白表达强度逐渐增强(图6)。不同浓度姜黄素组GSK-3β蛋白相对表达水平总体比较差异无统计学意义(F=0.494,P>0.05),β-catenin、p-GSK-3β、c-Myc、Cyclin D1、Survivin、MMP-9和Axin2蛋白相对表达水平总体比较差异均有统计学意义(F=182.877、183.026、55.200、150.128、136.000、139.611、92.211,均P<0.001);随姜黄素浓度增大,β-catenin、p-GSK-3β、c-Myc、Cyclin D1、Survivin及MMP-9蛋白相对表达水平明显降低,Axin2蛋白相对表达水平明显升高,组间两两比较差异均有统计学意义(均P<0.05)(表7)。

表6 不同浓度姜黄素组Wnt/β-catenin通路相关基因mRNA相对表达水平比较(x±s)Table 6 Comparison of mRNA expression levels of genes related to Wnt/β-catenin pathway among different concentrations of curcumin groups (x±s)组别样本量c-MycCyclin D1SurvivinMMP-90 μmol/L姜黄素组51.01±0.011.00±0.011.01±0.011.00±0.0120 μmol/L姜黄素组50.86±0.05a0.91±0.05a0.92±0.06a0.83±0.05a40 μmol/L姜黄素组50.58±0.04ab0.52±0.04ab0.61±0.03ab0.51±0.04ab80 μmol/L姜黄素组50.27±0.03abc0.32±0.02abc0.42±0.02abc0.26±0.02abcF值241.558269.804179.680284.000P值<0.001<0.001<0.001<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Cyclin D1:细胞周期蛋白D1;MMP-9:基质金属蛋白酶9 Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;com-pared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test) Cyclin D1:cyclic protein D1;MMP-9:matrix metalloproteinase 9
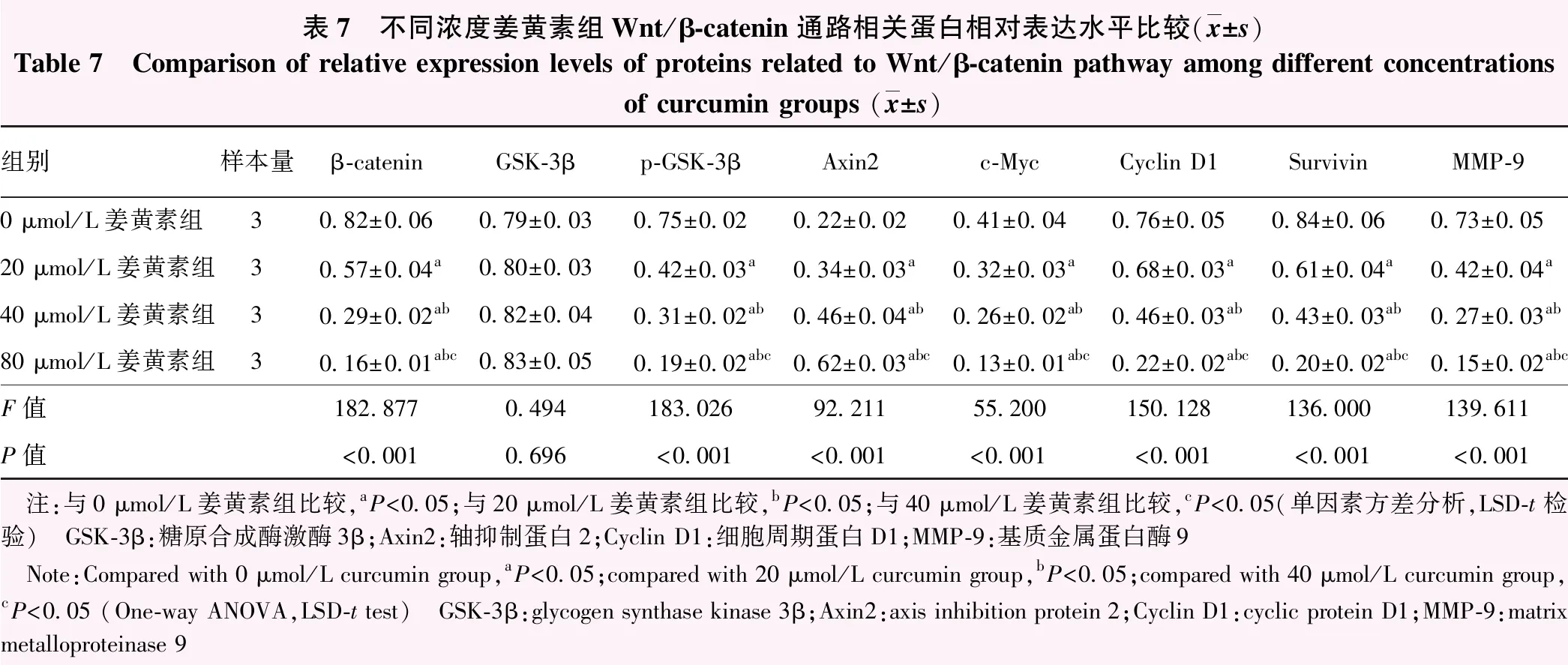
表7 不同浓度姜黄素组Wnt/β-catenin通路相关蛋白相对表达水平比较(x±s)Table 7 Comparison of relative expression levels of proteins related to Wnt/β-catenin pathway among different concentrations of curcumin groups (x±s)组别样本量β-cateninGSK-3βp-GSK-3βAxin2c-MycCyclin D1SurvivinMMP-90 μmol/L姜黄素组30.82±0.060.79±0.030.75±0.020.22±0.020.41±0.040.76±0.050.84±0.060.73±0.0520 μmol/L姜黄素组30.57±0.04a0.80±0.030.42±0.03a0.34±0.03a0.32±0.03a0.68±0.03a0.61±0.04a0.42±0.04a40 μmol/L姜黄素组30.29±0.02ab0.82±0.040.31±0.02ab0.46±0.04ab0.26±0.02ab0.46±0.03ab0.43±0.03ab0.27±0.03ab80 μmol/L姜黄素组30.16±0.01abc0.83±0.050.19±0.02abc0.62±0.03abc0.13±0.01abc0.22±0.02abc0.20±0.02abc0.15±0.02abcF值182.8770.494183.02692.21155.200150.128136.000139.611P值<0.0010.696<0.001<0.001<0.001<0.001<0.001<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) GSK-3β:糖原合成酶激酶3β;Axin2:轴抑制蛋白2;Cyclin D1:细胞周期蛋白D1;MMP-9:基质金属蛋白酶9 Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test) GSK-3β:glycogen synthase kinase 3β;Axin2:axis inhibition protein 2;Cyclin D1:cyclic protein D1;MMP-9:matrix metalloproteinase 9
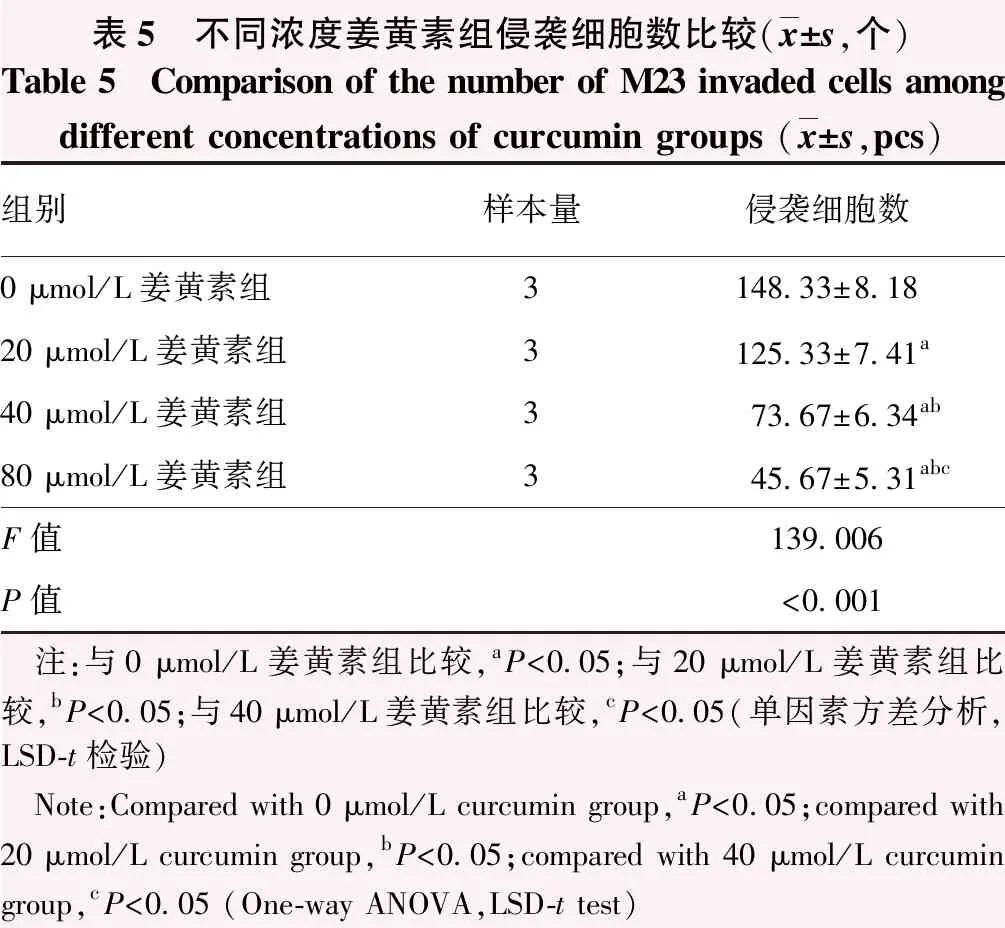
表5 不同浓度姜黄素组侵袭细胞数比较(x±s,个)Table 5 Comparison of the number of M23 invaded cells among different concentrations of curcumin groups (x±s,pcs)组别样本量侵袭细胞数0 μmol/L姜黄素组3148.33±8.1820 μmol/L姜黄素组3125.33±7.41a40 μmol/L姜黄素组373.67±6.34ab80 μmol/L姜黄素组345.67±5.31abcF值139.006P值<0.001 注:与0 μmol/L姜黄素组比较,aP<0.05;与20 μmol/L姜黄素组比较,bP<0.05;与40 μmol/L姜黄素组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with 0 μmol/L curcumin group,aP<0.05;compared with 20 μmol/L curcumin group,bP<0.05;compared with 40 μmol/L curcumin group,cP<0.05 (One-way ANOVA,LSD-t test)

图6 各浓度姜黄素组Wnt/β-catenin通路相关蛋白Western blot电泳图 1:0 μmol/L姜黄素组;2:20 μmol/L姜黄素组;3:40 μmol/L姜黄素组;4:80 μmol/L姜黄素组 Axin2:轴抑制蛋白2;GSK-3β:糖原合成酶激酶3β;GAPDH:甘油醛-3-磷酸脱氢酶;MMP-9:基质金属蛋白酶9;Cyclin D1:细胞周期蛋白D1
2.8 各组小鼠肿瘤质量比较
随着姜黄素作用浓度增加,小鼠荷瘤组织整体变小(图7)。各组小鼠荷瘤组织质量总体比较差异有统计学意义(F=58.026,P<0.001);其中小鼠荷瘤组织质量随姜黄素作用剂量增加而降低,组间两两比较差异均有统计学意义(均P<0.05)(表8)。
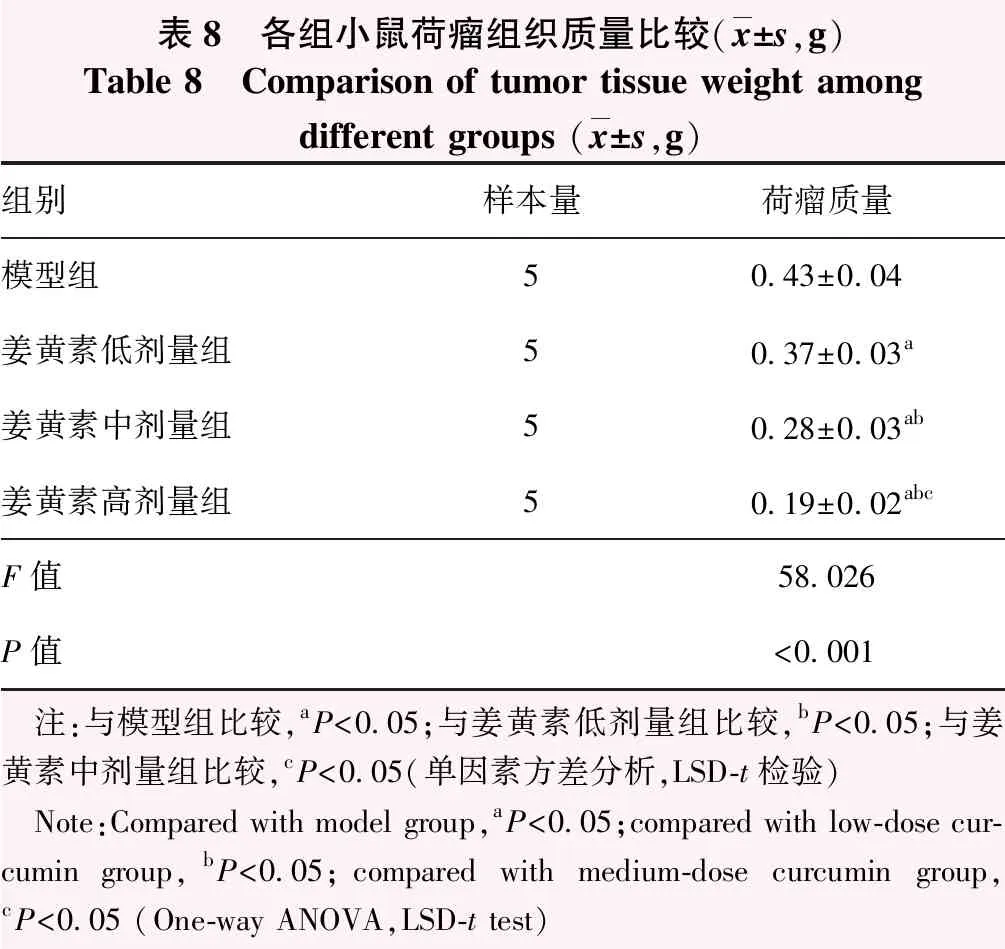
表8 各组小鼠荷瘤组织质量比较(x±s,g)Table 8 Comparison of tumor tissue weight among different groups (x±s,g)组别样本量荷瘤质量模型组50.43±0.04姜黄素低剂量组50.37±0.03a姜黄素中剂量组50.28±0.03ab姜黄素高剂量组50.19±0.02abcF值58.026P值<0.001 注:与模型组比较,aP<0.05;与姜黄素低剂量组比较,bP<0.05;与姜黄素中剂量组比较,cP<0.05(单因素方差分析,LSD-t检验) Note:Compared with model group,aP<0.05;compared with low-dose cur-cumin group,bP<0.05;compared with medium-dose curcumin group,cP<0.05 (One-way ANOVA,LSD-t test)
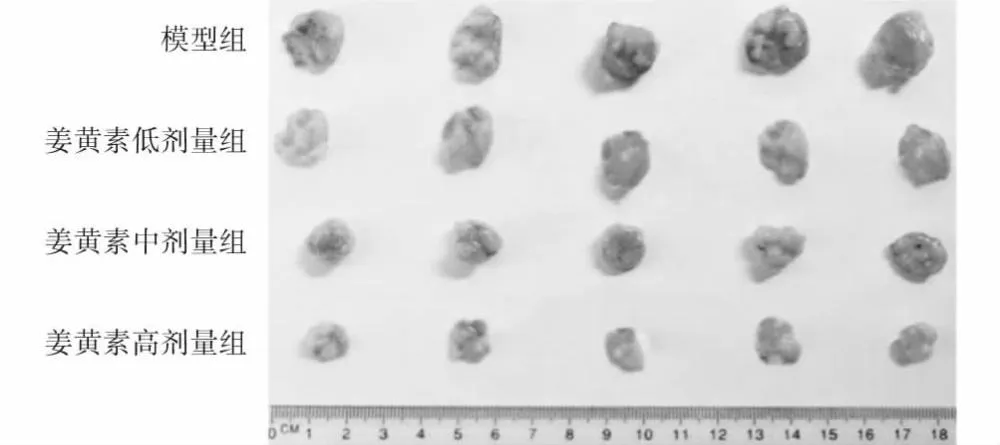
图7 各组小鼠荷瘤组织观察 随姜黄素作用浓度增大,荷瘤组织整体变小
3 讨论
UM转移是导致患者死亡的重要原因,积极寻找能够减少UM细胞增生、迁移及侵袭的潜在化合物是建立新的有效治疗UM策略的重要一步。据报道,姜黄素作为一种有效的抗癌候选药物,可参与多种癌症的发展,并影响肿瘤相关信号通路和分子靶点,抑制癌细胞存活、迁移和侵袭[11]。Xie等[12]研究发现,含姜黄素纳米颗粒/原位水凝胶复合物可实现对人UM细胞增生的长效抑制作用,对改善预后、抑制UM进展和转移至关重要,但体内外条件下姜黄素对UM是否具有积极干预作用仍待探究。本研究中,M23细胞于体外条件下经不同浓度姜黄素作用后,细胞增生、集落形成、迁移及侵袭能力减弱,细胞凋亡率升高;体内实验结果显示,姜黄素作用可显著抑制异种移植肿瘤生长,且作用效果呈剂量依赖性,说明姜黄素对UM细胞的恶性生物学行为具有抑制作用,在机体内可发挥抗UM效果,对于UM后期转移性进展可能具有一定的干预作用。
c-Myc是一种促存活蛋白,通常在肿瘤细胞中过度表达,参与调节细胞存活、化学抗性和肿瘤发生等多种生理过程,已被证明与肿瘤转移和不良临床结果有关[13-14];其表达上调可导致癌细胞的干细胞特征和侵袭性[15]。Cyclin D1是细胞周期G1~S期过渡进程的重要调节剂,在包括细胞增生、线粒体活性调节、DNA修复和细胞迁移控制等细胞生物学过程中发挥关键作用[16]。Survivin与细胞凋亡抑制相关,其在多种恶性肿瘤,如结肠癌、肺癌、乳腺癌和黑色素瘤中的表达水平显著升高,可促进上皮-间质转化(epithelial mesenchymal transition,EMT)和干性过程[17]。EMT是癌症发展和转移第一阶段的关键机制,通过改变细胞间黏附和细胞外基质(extracellular matrix,ECM)重塑,有利于恶性肿瘤ECM内的侵入性迁移[18]。MMP-9为旁分泌癌细胞分泌的明胶酶,可参与ECM组织重塑和降解过程,其表达被视为肿瘤侵袭的主要先决条件[19]。c-Myc、Cyclin D1、Survivin和MMP-9均为Wnt/β-catenin通路的关键下游因子[20]。本研究结果显示,经姜黄素作用后,M23细胞中的c-Myc、Cyclin D1、Survivin及MMP-9 mRNA相对表达水平均降低,提示姜黄素对UM细胞恶性生物学行为的抗性效果可能是通过干扰其存活蛋白表达,介导增生周期紊乱,促进其凋亡并降低其对基底膜屏障的降解作用来实现的。
Wnt/β-catenin通路与肿瘤发生、进展、转移和耐药性密切相关,已成为抗肿瘤治疗的有效靶标[21]。当Wnt通路未被激活时,β-catenin被包含结肠腺瘤息肉蛋白、酪蛋白激酶1、GSK-3β和Axin1或Axin2的多蛋白复合物磷酸化,随后经历泛素依赖性蛋白水解;但当该通路被激活时,复合物被灭活,导致β-catenin在细胞质中积累并转移至细胞核,与转录因子TCF/LEF结合并激活下游调节细胞增生、细胞周期及细胞间黏附靶基因的转录与表达,Axin2负反馈调控Wnt/β-catenin通路活性[22-23]。研究发现,抑制Wnt/β-catenin通路可下调p-GSK-3β和β-catenin表达,且能减弱癌细胞增生、迁移及侵袭能力[24]。姜黄素已被证实参与多种癌细胞中Wnt/β-catenin通路的下调[25-27]。本研究结果显示,经姜黄素作用后,M23细胞中β-catenin及p-GSK-3β蛋白相对表达水平显著下调,Axin2蛋白相对表达水平有所提高,提示姜黄素可能通过抑制Wnt/β-catenin通路激活,进而减少下游靶基因c-Myc、CyclinD1、Survivin和MMP-9等的转录。
综上所述,姜黄素可抑制UM细胞的恶性生物学行为,其作用机制可能与阻断Wnt/β-catenin通路激活有关。该研究结果对UM临床药物治疗靶点及用药选择提供了一定参考,对干预UM恶性进展及改善预后具有一定的积极意义。但本研究仅选择了UM单一细胞株进行探究,未来尚需扩大细胞类型进一步验证。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明盛小红:研究实施、数据分析及文章撰写;王利明、赵鑫:研究实施、数据采集及分析;辛向阳:酝酿和设计实验、文章审阅及定稿

