槲皮素改善苯并(a)芘致雄性大鼠生殖功能损伤的机制研究*
张庆洲,陈建设,孙自学,陈雨,张宸铭
1.河南中医药大学,河南 郑州 450046; 2.河南中医药大学第二附属医院/河南省中医院,河南 郑州 450002
研究表明,全球大约有15%的育龄夫妇不能生育,其中男方因素占40%~50%[1]。苯并(a)芘作为多环芳羟类的代表物,广泛存在于大气污染中,与人们日常生活密不可分[2]。经研究证实,苯并(a)芘对雄性小鼠的生殖毒性主要表现在睾丸细胞 DNA损伤、精子畸形及干扰生精过程[3]。前期研究发现,苯并(a)芘可以影响机体内抗氧化机制,造成性激素部分紊乱,并且损伤生精细胞、降低生精细胞蛋白表达水平,诱发细胞凋亡[4-5]。
目前,关于苯并(a)芘引起的生殖毒性尚无确切的治疗方案,中医认为有毒之品易损伤正气,在中医“扶正制毒”理论指导下,治疗上配伍补益之剂,既减轻毒性,又可提高药物疗效。苯并(a)芘的生殖毒性多属于中医“肾虚精伤”范畴,临床上多采用补肾填精之法,扶助正气,减轻毒性[6-7]。孙自学教授基于“肾主生殖”理论,主张补肾填精、活血通络,创立益肾通络方,在治疗男性不育症中疗效显著[8-11]。方中菟丝子补肾填精,滋补肝肾;淫羊藿补肾助阳,强壮筋骨,二者合用使肾精充足,共为君药。熟地黄滋阴补血,益精填髓;丹参活血祛瘀,补而不滞,与熟地黄合用,补血兼养血,活血而不耗血,共为臣药。水蛭逐瘀通络,破血通经;黄芪补气升阳,既助丹参、水蛭活血化瘀通络,又防其苦寒损伤正气,是为佐药。川牛膝补肾强骨,引药下行,是为使药。前期研究证实,益肾通络方可纠正苯并(a)芘对大鼠性激素的不利影响,改善生精细胞损伤,上调生精细胞X射线修复交叉互补蛋白1(X-ray repair cross complementing 1,XRCC1)、8-羟基鸟嘌呤DNA糖苷酶(8-oxoguanine DNA glycosylase,OGG1)蛋白表达水平,从而保护精子DNA完整性[12-13]。现代研究发现,菟丝子提取物可减轻双酚A引起的生殖毒性,降低畸形率[14]。淫羊藿提取物可以改善环磷酰胺致小鼠生殖损伤,提高精子密度、活力及机体抗氧化能力[15]。黄芪提取物能够降低重金属铬对孕鼠的生殖损伤,提高血清中超氧化物歧化酶(superoxide dismutase,SOD)、雌二醇(estradiol,E2)、孕酮(progesterone,P)水平,促进DNA合成[16]。课题组前期在对益肾通络方进行网络药理学分析时发现,槲皮素为益肾通络方中的有效单体[17]。研究发现,槲皮素可以抑制苯并(a)芘所诱发的活性氧(reactive oxygen species,ROS),降低细胞凋亡率[18]。基于此,本研究探讨槲皮素减轻苯并(a)芘致雄性大鼠生殖损伤的作用机制。
1 材料
1.1 动物雄性SD大鼠30只,2月龄,SPF级,体质量(180±10)g,均来自河南斯克贝斯生物科技股份有限公司,许可证号:SCXK(豫)2020-0005。动物放于河南省中医院中心实验室饲养,许可证号:SYXK(豫)2016-0009。IVC系统,笼盒温度20~24 ℃,湿度 36%~62%,换气20次/h,光照12 h,自由进食,适应性饲养1周。实验方案由河南省中医院伦理委员会批准,批准号:PZ-HNSZYY-2020-015。
1.2 药物与试剂苯并(a)芘、槲皮素(北京德晟嘉行科技有限公司,批号:C12227372、C28J11Y116820);二甲基亚砜(规格:每瓶500 mL,国药集团化学试剂有限公司,批号:20131012);精子核DNA完整性检测试剂盒(浙江星博生物科技有限公司,批号:2104281);HE染色试剂盒(北京索莱宝科技有限公司,批号:G1120-10);促卵泡素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testostrone,T)、SOD、丙二醛(malondialdehyde,MDA)、一氧化氮(nitrogen monoxide,NO)、大鼠三磷酸腺苷(adenosine triphosphate,ATP)ELISA试剂盒(江苏酶免生物科技有限公司、批号:20210301-20239A、20210301-20363A、20210301-20320A、20210301-20222A、20210301-20206A、20210301-20774A、20210301-30726A);caspase-3抗体、caspase-9抗体(武汉三鹰生物科技有限公司,批号:19677-1-AP、10380-1-AP)。
1.3 仪器超高速离心机(美国Sigma公司,型号:3-18K,离心半径:10 cm);恒温水浴箱(新康医疗器械有限公司,型号:420-B);流式细胞仪(美国BD公司,型号:BD AccuriTMC5);CASA 计算机辅助精液分析仪(南宁松景天伦生物科技有限公司,型号:Sperm Limited)。
2 方法
2.1 药物制备实验开始前,苯并(a)芘用玉米油稀释成浓度1 g·L-1的工作液。称取一定量的槲皮素标准品溶于5%二甲基亚砜中,配制成100 mg·kg-1的混悬液待用。
2.2 动物分组及造模与给药将30只雄性大鼠按随机数字表法分为3组:溶剂对照组、模型组、槲皮素组,每组10只。除溶剂对照组外,其余组大鼠参照Jeng等[19]方法灌胃给予苯并(a)芘溶液进行染毒,诱导大鼠生殖功能损伤,即从第1天开始,大鼠给予80 mg·kg-1的苯并(a)芘溶液灌胃,持续时间30 d。第10天,从每组中各取1只大鼠检测精子DNA碎片率(DNA fragmentation index,DFI),若升高一倍以上则提示造模成功。从第11天开始,槲皮素组大鼠灌胃给予100 mg·kg-1的槲皮素溶液,持续20 d,灌胃剂量按《实验动物学》[20]所述的比例进行折算,灌胃体积为1 mL·kg-1,溶剂对照组和模型组灌胃给予等体积的玉米油。
2.3 大鼠体质量及脏器指数的测定末次给药完成后,选择9%戊巴比妥钠以35 mg·kg-1的剂量腹腔注射麻醉大鼠,腹主动脉取血完成后,取睾丸、附睾、精囊腺,并称其质量,计算脏器指数。
脏器指数=脏器质量/体质量×100%
2.4 精子密度和活力检测大鼠麻醉后,剪开腹腔,取右侧附睾置于2 mL生理盐水的培养皿中剪碎,37 ℃ 温浴轻摇匀(30 s左右),使精子充分扩散,将处理后的精子混悬液涂于计数板上,选取10个视野,得出精子浓度。随机选取10个视野下共计200个精子,计算前向运动精子和非前向运动精子的百分率,即为精子总活力。
2.5 DFI检测在河南省中医院生殖实验室采用精子染色质结构分析法(sperm chromatin structure assay,SCSA)[21]对冷冻精子悬液进行DFI检测。先将精子悬液解冻,然后加入800 μL冷TNE缓冲液中,用100 μm尼龙过滤器过滤,精子悬液稀释至 2×106mL-1。随后加入600 μL吖啶橙染色液对精子进行染色。BD AccuriTMC5流式细胞仪对每个样本中至少5 000个精子进行分析,并使用CellQuest ProTM软件计算DFI,DFI为受损精子DNA即单链DNA(红色)和正常精子DNA即双链DNA(绿色)荧光的比值。
2.6 大鼠血清性激素、氧化因子水平的测定大鼠麻醉后,取腹主动脉血,3 500 r·min-1离心10 min后取上层血清,放于-20 ℃冰箱保存。检测时,将血清样本取出解冻,按照ELISA试剂盒说明书检测FSH、LH、T及MDA、SOD、NO、ATP 的水平。
2.7 HE染色将大鼠睾丸在固定液中固定,24 h后依次进行透明、浸蜡、包埋、切片,再按HE试剂盒说明书染色、选择中性光学树脂封片,显微镜下观察组织形态变化。
2.8 XRCC1、OGCC1、caspase-3、caspase-9蛋白表达水平检测采用Western Blot 法检测睾丸组织XRCC1、OGG1、caspase-3、caspase-9蛋白表达水平。将-80 ℃保存的睾丸组织解冻,3 500 r·min-1离心10 min后,取上层清液,按BCA试剂盒说明书测定蛋白浓度后,对蛋白进行电泳,洗涤后放在摇床上,缓慢摇动,封闭1 h,加入一抗工作液(稀释比例11 000),1×TBST洗涤3次,4 ℃冰箱孵育过夜,加入羊抗兔二抗(稀释比例11000),室温中孵育 2 h 后,TBST再次洗膜3次,随后将制备出的膜放于反应液中孵育,并夹在两塑料薄膜之间,待X光胶片曝光后扫描图片并保存,随后使用软件把图片上条带灰度值数字化,将XRCC1、OGG1、caspase-3、caspase-9蛋白条带灰度值与GAPDH条带灰度值比值表示为目的蛋白的相对表达量。
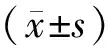
3 结果
3.1 各组大鼠体质量、脏器质量以及脏器指数比较与溶剂对照组比较,模型组大鼠体质量、睾丸质量、附睾质量、精囊腺质量、睾丸指数、附睾指数、精囊腺指数均明显降低(P<0.05);与模型组比较,槲皮素组大鼠体质量、睾丸质量、附睾质量、精囊腺质量、睾丸指数、附睾指数、精囊腺指数均明显增加(P<0.05)。见表1、表2。
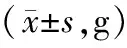
表1 槲皮素对大鼠体质量和脏器质量的影响

表2 槲皮素对大鼠脏器指数的影响
3.2 各组大鼠精子总活力、密度及DFI比较与溶剂对照组比较,模型组大鼠精子密度、总活力显著下降(P<0.01),DFI显著升高(P<0.01);与模型组比较,槲皮素组精子密度、总活力显著上升(P<0.05),DFI显著降低(P<0.01)。见表3。
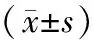
表3 各组大鼠精子密度、总活力及DFI比较
3.3 各组大鼠血清中性激素水平的比较与溶剂对照组比较,模型组大鼠血清FSH、LH、T水平显著降低(P<0.05);与模型组比较,槲皮素组FSH、LH、T水平显著升高(P<0.05)。见表4。
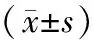
表4 各组大鼠血清中FSH、LH、T水平比较
3.4 各组大鼠血清中氧化因子水平比较与溶剂对照组比较,模型组SOD、ATP水平显著下降(P<0.01),MDA、NO水平显著升高(P<0.01)。与模型组比较,槲皮素组SOD、ATP水平明显增高(P<0.05),MDA、NO水平显著降低(P<0.05)。见表5。
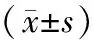
表5 各组大鼠血清氧化因子水平比较
3.5 HE染色检测睾丸病理变化结果HE染色显示,溶剂对照组大鼠生精细胞排列紧凑,生精上皮数量适中,层次规则,生精小管充盈饱满,生精细胞形态正常,可见到管腔内成熟精子,间质细胞形态无异常。模型组大鼠生精细胞结构紊乱,排列疏松,生精小管缩小,生精上皮层数减少,管腔内可见少量的生精细胞、精子细胞,其中部分间质细胞开始出现变性。槲皮素组损伤程度减轻,生精小管边界变清晰,同时生精上皮厚度明显恢复,生精细胞数量增多,部分管腔内能够见到成熟精子,变性的间质细胞减少。见图1。

A:溶剂对照组;B:溶剂对照组;C:模型组;D:模型组;E:槲皮素组;F:槲皮素组。
3.6 各组大鼠蛋白表达水平比较与溶剂对照组比较,模型组XRCC、OGG1蛋白表达水平明显降低(P<0.01),caspase-3、caspase-9蛋白表达水平明显升高(P<0.01);与模型组比较,槲皮素组大鼠 XRCC1、OGG1蛋白表达水平明显升高(P<0.01);caspase-3、caspase-9蛋白表达水平明显降低(P<0.01)。结果见图2、表6。

图2 XRCC1、OGG1、caspase-3、caspase-9蛋白条带图
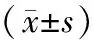
表6 各组大鼠睾丸组织蛋白表达水平比较
4 讨论
苯并(a)芘是一种存在于大气污染物中具有致癌性的芳香烃类化合物[22]。研究发现,苯并(a)芘对食品、水体、气体的污染也直接危害人体健康和生命安全[23-24]。苯并(a)芘可破坏成年小鼠卵母细胞,增加线粒体中的活性氧水平,阻碍精卵结合[25]。持续苯并(a)芘暴露可致雄性大鼠精子DFI增加,降低合笼雌鼠妊娠率[26]。课题组前期研究表明,苯并(a)芘会导致染毒大鼠血清中FSH、LH水平增加,从而抑制精子的产生,且随着苯并(a)芘的持续暴露,大鼠睾丸生精细胞、间质细胞遭到破坏而变性[27-29]。
近几年研究中发现,中药提取物在干预大鼠生殖损伤方面与中药复方作用相似[30]。槲皮素作为一种天然的抗氧化剂[31-32],广泛存在于黄芪、黄连、石斛、淫羊藿等多种中草药及中药复方中[33-34]。笔者前期在对益肾通络方进行网络药理学分析时发现,槲皮素为该方的主要有效单体[17]。益肾通络方可以降低染毒大鼠DFI,保护精子DNA完整性,降低血清中FSH、LH水平,促进精子产生,上调XRCC1、OGG1蛋白表达水平,促进机体对生殖细胞的修复[13,35]。本实验发现,槲皮素可以增加大鼠睾丸生精上皮厚度,改善生精细胞数量,降低DFI,提升大鼠睾丸精子密度、活力,提升大鼠血清内SOD、ATP水平,降低MDA、NO水平,这与孙小娜、布同良等研究一致[36-37],说明槲皮素可以改善染毒大鼠生精功能,从而减轻染毒大鼠生殖损伤。
现代医学认为,过多的ROS会导致机体抗氧化系统失衡,造成精子功能缺陷[38]。苯并(a)芘暴露可导致体内ROS增加,从而造成精子DNA损伤[39]。机体清除氧自由基能力的强弱取决于SOD水平的高低,同样自由基对机体的攻击程度也取决于MDA的水平。当机体内NO水平较高时,则会导致ATP合成减少。研究发现,苯并(a)芘暴露会导致大鼠血清中SOD、ATP水平降低,MDA、NO水平升高,造成生殖损伤[28]。本实验也得到了相似的结果,与溶剂对照组比较,模型大鼠DFI升高,精子总活力、密度均降低,血清中SOD、ATP水平也出现不同程度的降低,MDA、NO水平显著升高;经槲皮素干预后,大鼠DFI水平下降,精子密度与总活力有所提升,大鼠血清中SOD、ATP水平也有所升高,MDA、NO水平下降,提示槲皮素可以通过降低NO水平,促进ATP合成,从而减少大鼠睾丸生殖毒性损伤。有研究表明,精子DNA的损伤与男性生殖激素水平密切相关,下丘脑-垂体-性腺轴直接调控生殖激素水平,FSH、LH、T三者相互配合,共同调节生殖功能,睾丸生精小管的成熟取决于FSH,睾丸间质细胞增生以及其分泌的T都来源于LH,二者结合可以更好促进精子的产生[40-43]。本实验发现,与溶剂对照组比较,模型组FSH、LH、T水平降低,而槲皮素干预后,FSH、LH、T明显提升,提示槲皮素可以缓解苯并(a)芘造成的性激素紊乱。
碱基切除修复(base excision repair,BER)系统是修复DNA损伤的重要途径,OGG1能够识别8-oxoG,去除受损的碱基,形成一个3-羟基末端和一个5-脱氧核糖磷酸末端,并在AP核酸内切酶1、DNA聚合酶的相互作用下,将损伤的碱基切除、修复,在DNA聚合酶和DNA连接酶作用下,XRCC1将自身不同部位与其他碱基修复蛋白相结合,共同促进DNA的修复[44-49]。caspase-3、caspase-9是生精细胞凋亡过程中不可或缺的两种蛋白酶,二者都在细胞凋亡途径中起到至关重要的作用,凋亡蛋白在被凋亡因子诱导后形成跨膜通道,此时线粒体中的色素C被释放出来,随后凋亡蛋白酶激活因子-1(apoptotic protease zctivating factor-1 Apaf-1)与色素C相互影响,形成凋亡体,激活caspase系统,诱发级联反应,激活caspase-3促进细胞凋亡[50-52]。本实验中,经槲皮素干预后,大鼠睾丸蛋白OGG1、XRGG1表达水平有所提升,caspase-3、caspase-9蛋白表达水平下降,提示槲皮素可以降低苯并(a)芘诱导大鼠精子DNA损伤,其机制可能与上调BER通路上的OGG1、XRCC1蛋白水平,降低caspase-3、caspase-9蛋白水平有关。
综上所述,槲皮素可以降低大鼠DFI,提升精子活力及密度,减轻睾丸病理损伤,提高睾丸蛋白XRCC1、OGG1表达,其机制可能与激活睾丸组织中BER信号通路,上调XRCC1、OGGG1等相关蛋白水平、抑制凋亡蛋白表达水平及抗氧化应激有关。

