ESD 对结直肠神经内分泌肿瘤患者疗效的影响及Akt/mTOR 信号途径参与机制研究
牛振楠,梁冬红,刘 壮,孟嫦娟
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)作为异质性肿瘤,起源于神经内分泌细胞,发病率较低,但随着影像学和临床诊断技术不断提高,其检出率和发病率呈现逐年增加趋势, 常见于结直肠等部位[1,2]。 NEN 的发病较为复杂[3,4],可能与遗传、饮食和生活习惯相关,主要临床症状为局部肿块、头痛、视野模糊等压迫症状及肌无力、 醛固酮增多等神经内分泌症状,严重威胁患者生命安全。 现阶段临床治疗NEN 以手术、化学治疗、放射治疗及靶向治疗为主,并根据肿瘤分型、分期、发生部位等选择适宜手段,且手术为首选方案[5]。 常规开腹切除因切口大、术后恢复慢,已逐渐被临床摒弃[6];内镜切除术,如内镜下黏膜切除术(endoscopic mucosal resection,EMR)可有效切除病灶,阻止癌变病灶的进展或转移,但其在切除直径>2 cm 病灶方面存在一定局限性[7]。 内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是在EMR 的基础上发展而来的手术方式, 可完整切除病灶,降低复发率[8],且已用于胃肠NEN 患者[9],但具体应用于结直肠部位肿瘤研究及作用机制相对较少。因此笔者选择146 例结直肠NEN 患者, 采用随机信封法, 研究ESD 和常规内镜切除术对患者临床疗效及作用机制,为临床控制疾病进展、延长生存期等提供依据。
1 资料与方法
1.1 临床资料
选择2014 年1 月至2019 年10 月在邢台市第三医院收治的146 例结直肠NEN 患者, 其中男性92例,女性54 例;年龄42 ~65 岁,平均年龄53.49 岁(标准差5.42 岁);病灶直径1.15 ~1.85 cm,平均直径1.50 cm(标准差0.18 cm);病理分级[10],G132 例,G251 例,G363 例;直肠99 例,结肠47 例。 按随机信封法将患者分成观察组和对照组,每组73 例。对照组患者行EMR,观察组行ESD。 观察组男性49 例,女性24 例;年龄42 ~65 岁,平均年龄53.15 岁(标准差5.50 岁);病灶直径1.16 ~1.82 cm,平均直径1.47 cm(标准差0.18 cm); 病理分级,G114 例,G224 例,G335 例;直肠47 例,结肠26 例。 对照组男性43 例,女性30 例;年龄44 ~62 岁,平均年龄52.87 岁(标准差4.52 岁);病灶直径1.16 ~1.84 cm,平均直径1.49 cm(标准差0.20 cm); 病理分级,G118 例,G227 例,G328 例;直肠52 例,结肠21 例。
选择标准:①均经病理组织检查确诊为NEN,且发病部位为结直肠[11];②年龄18 ~75 岁;③均符合手术治疗诊断,首次应用内镜切除术或ESD;④入院前未经放化疗等治疗;⑤患者首次发病,病历资料齐全,能正常沟通和交流;⑥知情同意研究方案。
排除标准:①合并恶性肿瘤者;②凝血功能障碍、出血性疾病者;③红斑狼疮、类风湿性关节炎等自身免疫疾病者;④肝、肾、心等重要脏器衰竭者;⑤不配合者。
两组患者性别、年龄、病理分级、病灶部位及病灶直径比较,差异无统计学意义(χ2/t=1.058、0.336、1.454、0.784、0.635,P >0.05)。
1.2 方法
1.2.1 治疗方法
手术由同一手术团队进行,所有患者术前均进行手术指征确认。 术前禁饮、禁食至少6 h,并于术前给予镇静剂和解痉剂,在静脉麻醉下行相应手术治疗。
观察组:给予常规ESD 治疗。 具体步骤如下:采用日本Olympus CF-H260AI 型电子肠镜判断、 勾画病灶, 并应用DUAL 刀在病灶区域0.5 cm 外沿电凝法标记;在病灶周边注射混合液,主要为甘油果糖、肾上腺素和由美蓝, 每次注射3 mL, 等待病灶肌层分离;再次应用DUAL 刀沿着标记点边缘逐步切开,在钩刀的辅助下在黏膜下层沿着原有基层剥离病灶黏膜,将完整瘤体送检,同时确认基底和边沿是否有肿瘤残留物;彻底剥离后,应用热活检钳充分止血,降低活动性出血事件发生。
对照组:给予常规EMR 治疗。 在内镜的辅助下充分暴露病灶基底,并探查病灶。 在病灶周边注射混合液,主要为甘油果糖、肾上腺素和由美蓝,关注病灶的抬举征是否为阳性,选用适宜大小的圈套器对阳性病灶圈套,并应用电凝刀切除,针对体积较大的病灶可分批次切除,最后应用热活检钳行相应创面关闭处理,以发挥止血功能。
术后24 h 密切监测患者生命体征,并给予止血、抑酸及抗感染等,于术后3、6、12 个月定期复查。
1.2.2 观察指标
病变切除情况:记录两组患者治愈性切除、整块切除及基底病灶残余等情况。
手术情况:记录两组患者术中出血量、手术时间、住院时间、治疗费用、病变组织直径及病变组织厚度等。
生存质量:于术前和术后7 d 应用生存质量量表评估两组患者生存质量[12]。 该量表包括食欲、精神、睡眠、生活能力、疲倦及疼痛等6 个维度,除生活能力每个维度满分为5 分, 生活能力满分为20 分。 分值越高,患者生存质量越差,该量表Cronbach’α 为0.789,信效度较好。
免疫功能:分别于术前和术后7 d 采集空腹肘静脉外周血4 mL,流式细胞仪检测两组患者CD3+CD4+、CD3+CD8+和CD4+/CD8+等免疫指标。
蛋白激酶B(protein kinase B,Akt)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR):分别术前和术后7 d 采集空腹肘静脉外周血4 mL,采用德国Hettich MIKRO220 型离心机,参数:3000 r/min,半径8 cm,时间10 min,温度-4 ℃;上清液为目标产物,应用美国Bio 公司Tek Synergy H1MF 型号全自动酶标仪,波长为450 nm,测定血清Akt 和mTOR 水平,所有操作均严格按照说明书进行。
并发症: 记录两组患者围术期并发症发生情况,如术中穿孔、皮下气肿及术后迟发性出血等情况。
复发情况:随访1 年,记录两组患者术后1 年复发情况。
诊断效能分析:以术后7 d 血清Akt 和mTOR 为检验变量,以术后是否复发为状态标量,绘制受试者工作特性(receiver operating characteristic,ROC)曲线,绘制曲线下面积(area under curve,AUC),分析Akt 诊断、mTOR 诊断和二者联合诊断的灵敏度、特异度。
1.3 统计学方法
采用SPSS 25.0 统计软件进行数据分析。 计量资料符合正态分布,以均数± 标准差表示,组间行独立样本t 检验,治疗前后行配对t 检验;计数资料以例(%)表示,比较采用χ2检验。 P <0.05 为差异有统计学意义,P <0.01 为差异有显著统计学意义。
2 结果
2.1 两组患者病变切除情况比较
术后观察组患者治愈性切除率和整块切除率明显高于对照组[83.56 %(61/73) vs 60.27 %(44/73)。χ2=9.801,P=0.002。 97.26%(71/73)vs 73.97%(54/73)。 χ2=16.074,P=0.000],而两组患者基底病灶残余率差异无统计学意义[1.37%(1/73)vs 5.48%(4/73)。χ2=1.864,P=0.172]。
2.2 两组患者手术情况比较
观察组患者手术时间和治疗费用明显高于对照组,而术中出血量和住院时间明显低于对照组(P <0.05)。 两组患者病变组织直径和病变组织厚度比较,差异无统计学意义(P >0.05)。 见表1。
2.3 两组患者手术前后生存质量比较
术前两组患者食欲、精神、睡眠、生活能力、疲倦及疼痛等生存质量各维度差异无统计学意义 (P >0.05);术后7 d 两组患者生存质量各维度水平明显降低(P <0.05),且观察组患者食欲、精神、睡眠、生活能力、疲倦及疼痛等生存质量评分明显低于对照组(P <0.05)。 见表2。
2.4 两组患者手术前后免疫功能比较
术前两组患者CD3+CD4+、CD3+CD8+和CD4+/CD8+等免疫指标差异无统计学意义(P >0.05)。 术后7 d,两组患者CD3+CD4+和CD4+/CD8+水平明显提高,CD3+CD8+水平明显降低(P <0.05);且观察组患者CD3+CD4+和CD4+/CD8+水平明显高于对照组,CD3+CD8+水平明显低于对照组(P <0.05)。 见表3。
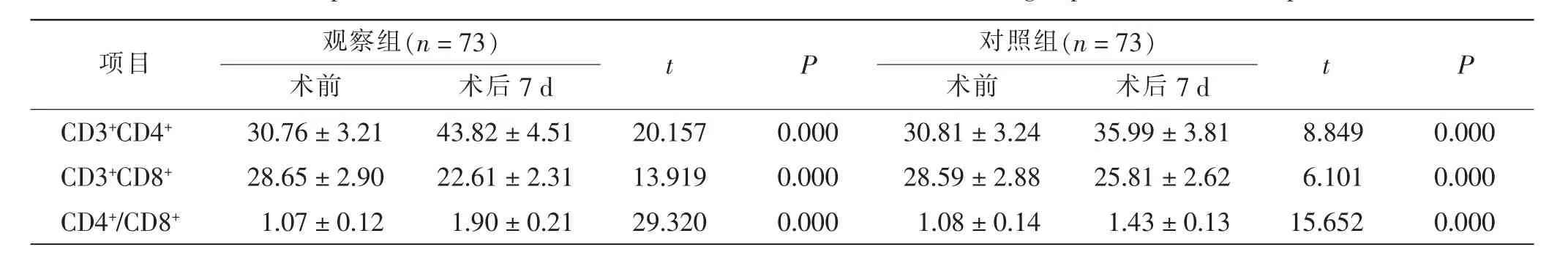
表3 两组患者手术前后免疫功能比较Tab.3 Comparison of immune function before and after treatment between 2 groups before and after operation
2.5 两组患者手术前后Akt 和mTOR 比较
术前两组患者血清Akt 和mTOR 水平比较,差异无统计学意义(P >0.05);术后7 d,两组患者血清Akt和mTOR 明显降低(P <0.05),且观察组患者血清Akt和mTOR 明显低于对照组(P <0.05)。 见表4。
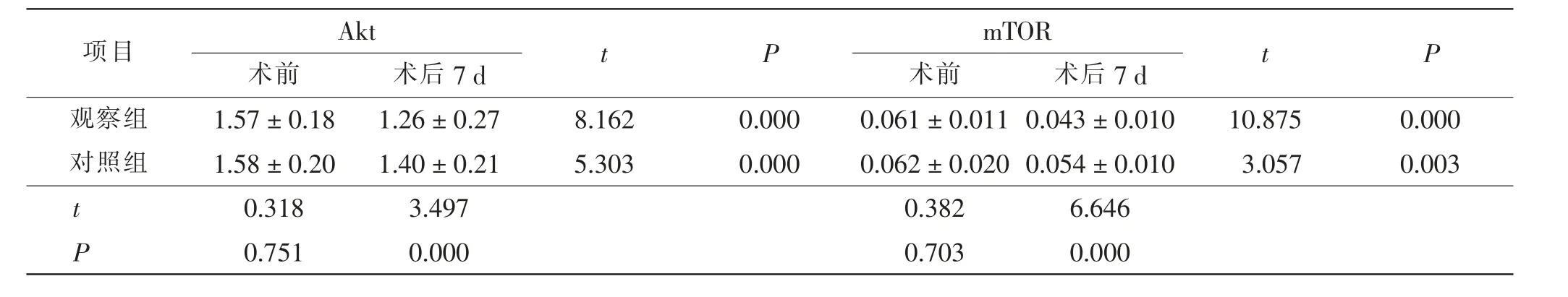
表4 两组患者手术前后血清Akt 和mTOR 比较ng/mLTab.4 Comparison of Akt and mTOR between 2 groups before and after operationng/mL
2.6 两组患者术后并发症比较
观察组术后迟发性出血1 例(1.37%),穿孔2 例(2.74%),皮下气肿1 例(1.37%)。 对照组术后迟发性出血4 例(5.48%),穿孔4 例(5.48 %),皮下气肿5例(6.85%)。 两组患者均出现术后迟发性出血、穿孔及皮下气肿等并发症,但差异无统计学意义(χ2=1.864、0.695、2.781,P=0.172、0.404、0.095)。
2.7 两组术后复发情况比较
随访1 年,失访3 例。观察组患者复发率为4.17%(3/72),明显低于对照组的22.54%(16/71),差异有显著统计学意义(χ2=10.469,P=0.001)。
2.8 单独和联合诊断效能比较
血清Akt 临界值为1.33 ng/mL,Akt 诊断的灵敏度为68.42%,特异度为70.16 %,AUC 为0.765[95%可信区间(confidence interval,CI)0.706 ~0.813];血清mTOR 临界值为0.049 ng/mL,mTOR 诊断的灵敏度为73.68%, 特异度为59.89%,AUC 为0.808 (95%CI0.749 ~0.851);二者联合诊断,其灵敏度为84.21 %,特异度为75.00%,AUC 0.878(95%CI 0.832 ~0.911)。见图1。

图1 Akt 诊断、mTOR 诊断和二者联合诊断的ROC 曲线Fig. 1 ROC curves of Akt diagnosis, mTOR diagnosis and combined diagnosis
3 讨论
NEN 起源于弥散神经内分泌系统, 可分布于全身不同器官和组织,以胃肠道等消化系统最为常见,以低血糖、皮肤潮红、胰高糖素瘤及生长抑素瘤等为主要临床症状,其生长缓慢、恶性程度低,若早期及时发现并对症治疗,将会明显改善患者预后[13,14]。现阶段[15],NEN 未见有效预防措施,手术是根治NEN 最有效的方式,传统息肉切除术完全切除率仅为30%~50%,不仅存在较高复发率,而且具有创伤大、恢复慢等缺点,患者依从性较低。随着内镜技术应用于外科手术,EMR 的肿瘤清除率明显高于传统开腹手术, 术中损伤、侵袭小,术后并发症发生率低,其安全性和有效性已得到临床广泛证实,但其在切除大体积病灶方面存在不足[16]。ESD 是在内镜直视下应用专用医疗器械将病灶剥离正常黏膜,以彻底清除病灶、遏止疾病复发[17],二者在NEN 治疗中均有一定作用,但在治疗效果、优势和缺点等方面临床尚未得出统一结论。有研究[18]证实,NEN 患者3 年生存率仅为52.64 %,预后较差。因而研究治疗方式的作用机制,对疾病复发、预后的改善具有重要临床意义。
ESD 在治愈性切除率、整块切除率、生存质量和免疫功能提高等方面独具优势, 但ESD 手术时间和治疗费用高于EMR。 Dinc S 等[19]大鼠实验表明,ESD后创面比EMR 损伤大,手术时间较长。 ESD 可在内镜的帮助下, 应用专用医疗器械完全剥离病灶组织,而病灶的完全剥离与疾病复发、免疫功能和生存质量明显相关。 贺德志等[20]证实,ESD 可有效提高病理组织切除率, 降低并发症, 但术后复发率仍较高,为23.64%,略高于笔者研究,可能与样本量、手术方式相关。Akt 是高度保守的蛋白激酶,是磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)的下游因子;mTOR 是Akt 信号下游作用靶点, 可直接磷酸化或者阻滞结节性硬化复合物, 以激活mTOR信号通路,Akt/mTOR 信号通路的激活与肿瘤细胞的增殖、分化密切有关[21]。笔者研究结果表明,两组患者血清Akt 和mTOR 明显降低,且观察组患者血清Akt和mTOR 明显低于对照组(P <0.05),即临床切除结直肠NEN,提高临床疗效、改善患者生存质量与降低Akt/mTOR 信号通路相关,且Akt 和mTOR 单独和二者联合检测可应用于预测结直肠NEN 术后复发,临床可通过术后Akt 和mTOR 指标预测疾病复发。
综上所述,ESD 应用于治疗结直肠NEN 患者可有效提高治愈性切除率和整块切除率,改善患者生存质量,恢复免疫功能,降低术后1 年复发率,且血清Akt 和mTOR 单独和二者联合诊断可应用于预测结直肠NEN 术后复发。

