三七总皂苷对脑缺血再灌注的保护作用研究
祝燕平,高 磊,刘亚芳,祝凌丽,周 兰
(安庆医药高等专科学校药学院,安庆 246003)
血脑屏障(blood–brain barrier,BBB)是血液和大脑之间的一种独特的选择性屏障,在维持中枢神经系统稳定状态方面发挥着至关重要的作用[1]。当血脑屏障遭到破坏,脑损伤进一步恶化,显著提高了出血乃至死亡的风险[2-3]。脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是由缺氧和缺血引起的神经损伤,涉及多种病理生理过程,如氧化应激、钙超载、毒性损伤等[4]。众所周知,转录因子NF-E2相关因子(nuclear factor erytroid 2-releated factor 2,Nrf2)是细胞抗氧化应激反应的重要调节因子[5]。此外,研究证明,Nrf2通路是对抗氧化应激介导疾病的有效靶点[6]。
总皂苷(panax notoginseng saponins,PNS)是从三七根中提取的主要活性化合物,具有减小脑梗死体积、抗氧化、抑制血小板聚集等药理作用[7-8]。PNS的作用在很多疾病中得到广泛研究,如PNS通过脂质代谢调节对糖尿病、心肌病的保护作用[9]。LI等[10]发现,PNS可通过抑制IDO1介导的免疫调节预防结肠炎相关的大肠癌。经证实PNS在预防和治疗脑缺血再灌注损伤方面具有一定的临床意义[11]。HU等[12]发现PNS可激活OGD/R诱导的bEnd.3中的Nrf2通路。综上所述,本研究旨在探索PNS在脑缺血再灌注损伤中的作用机制。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 小鼠脑微血管内皮细胞bEnd.3,购于武汉普诺赛生命科技有限公司。
1.1.2 供试试剂 DMEM培养液、胎牛血清和青霉素-链霉素,均购于美国Gibco公司;CCK-8试剂盒、BCA蛋白浓度测定试剂盒、LDH试剂盒,购于碧云天生物技术有限公司;RIPA蛋白裂解液,购于索莱宝科技有限公司;ZO-1(cat.no.ab276131,1∶1 000)、claudin-5(cat.no.ab131259,1∶1 000)、occludin(cat.no.ab216327,1∶1 000)、PPARα(cat.no.ab272718,1∶1 000)、Nrf2(cat.no.16396-1-AP,1∶5 000)、HO-1(cat.no.ab52947,1∶2 000),6种抗体均购于武汉三鹰生物技术有限公司;山羊抗兔IgG H&L(cat.no.ab6721,1∶2 000),购于Abcam。
1.2 试验方法
1.2.1 细胞培养 将bEnd.3细胞在10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养,当细胞贴壁生长至汇合度70%~80%时进行试验。
1.2.2 细胞模型建立及分组给药 为建立缺血再灌注损伤模型,用氧糖剥夺/复氧(oxygen-glucose deprivation/re-oxygenation,OGD/R)方式诱导bEnd.3细胞。用不含葡萄糖的DMEM培养基代替正常培养基,将细胞置于37 ℃、95% N2、5% CO2、1% O2的厌氧室中缺氧6 h。然后换为不含葡萄糖的DMEM培养基,置于37 ℃、78% O2、5% CO2培养箱中继续培养12 h。细胞随机分为对照组、OGD/R模型组、低剂量PNS组(OGD/R+PNS 200 µg/mL)、中剂量PNS组(OGD/R+PNS 300 µg/mL)、高剂量PNS组(OGD/R+PNS 400 µg/mL)。对照组不做处理,正常培养,其余各组细胞均缺氧缺糖处理6 h,再复氧12 h建立OGD/R细胞模型。各给药组均需在造模前分别加药孵育2 h。
1.2.3 CCK-8试验 采用CCK-8测定细胞活性。取对数生长期bEnd.3细胞,按照3×104个/孔的密度接种于96孔板中,并如1.2.2进行处理。每孔中滴入15 µL CCK-8溶液避光孵育2 h后,使用酶标仪于450 nm处测量每孔的吸光度,重复2次。
1.2.4 LDH检测试验 取对数生长期细胞,按照1×105个/孔的密度接种于6孔板中,并如1.2.2进行处理。取细胞培养液上清液,根据LDH细胞检测试剂盒说明进行后续测定。使用酶标仪于450 nm处测量每孔的吸光度,重复2次。
1.2.5 蛋白印迹试验 取对数生长期细胞,按照1×105个/孔的密度接种于6孔板中,并如1.2.2进行处理。采用RIPA裂解缓冲液提取bEnd.3细胞中总蛋白,BCA试剂盒测定蛋白浓度。蛋白煮沸变性后,取20 µg蛋白样品进行电泳分离,并转到PVDF膜上。使用5% BSA室温封闭2 h后,将膜与一抗4 ℃过夜孵育。第二日将膜和二抗室温孵育1 h。最后使用ECL试剂盒对蛋白进行显影拍照,Image J分析软件对蛋白条带进行灰度值计算,重复2次。
1.2.6 划痕试验 取对数生长期细胞,按照5×105个/孔的密度接种于6孔板中,置于培养箱中培养,并如1.2.2进行处理。待细胞融合均达到90%时,使用灭菌后的吸头在设定好的轨迹上划线[13],PBS清洗掉落的细胞并对其进行拍照,将培养皿放在培养箱继续培养24 h,再次对相同位置进行拍照,重复2次。
1.2.7 侵袭试验 取对数生长期细胞,接种于用Matrigel基质胶预处理的小室上室(1×105个/孔),将600 µL含10% FBS的培养基加入下室,培养箱中培养24 h[14]。使用4%多聚甲醛固定细胞20 min,0.1%结晶紫染液染色10 min。在显微镜下观察侵袭的细胞数,重复2次。
1.2.8 小管形成试验 通过在Matrigel基质胶上培养bEnd.3细胞评估内皮小管形成。取对数生长期细胞,按照5×103个/孔的密度接种于冷基质凝胶膜预处理的24孔板中,37 ℃培养72 h。使用Image J分析软件随机对10个区域进行成像和分析,以量化管腔形成数量。
1.3 数据分析
试验数据以均值±标准差表示,采用GraphPad Prism 8.0软件对数据进行统计学分析,多组间比较采用单因素方差分析,并使用Tukey检验方法进行检验。P<0.05表明数据具有统计学意义。
2 结果与分析
2.1 PNS对OGD/R诱导的脑内皮细胞bEnd.3活性和屏障损伤的影响
CCK-8试验和LDH试剂盒检测PNS处理的bEnd.3细胞活性和细胞损伤。细胞上清液中LDH活性与细胞损伤密切相关。由图1A可知,与对照组相比,模型组bEnd.3细胞活性极显著降低。由图1B可知,与对照组相比,LDH活性显著增加。经过PNS处理后,bEnd.3细胞活性显著增加,LDH活性显著降低,且具有浓度依赖性,当PNS浓度为400 µg/mL时,LDH活性呈极显著下降的趋势。由图1C、图1D、图1F可知,与对照组相比,模型组中ZO-1、claudin-5、occludin呈极显著下降的趋势。PNS处理后,当PNS浓度为200 µg/mL时,ZO-1、claudin-5、occludin表达显著增加;当PNS浓度为300 µg/mL和400 µg/mL时,ZO-1、claudin-5、occludin表达极显著增加。
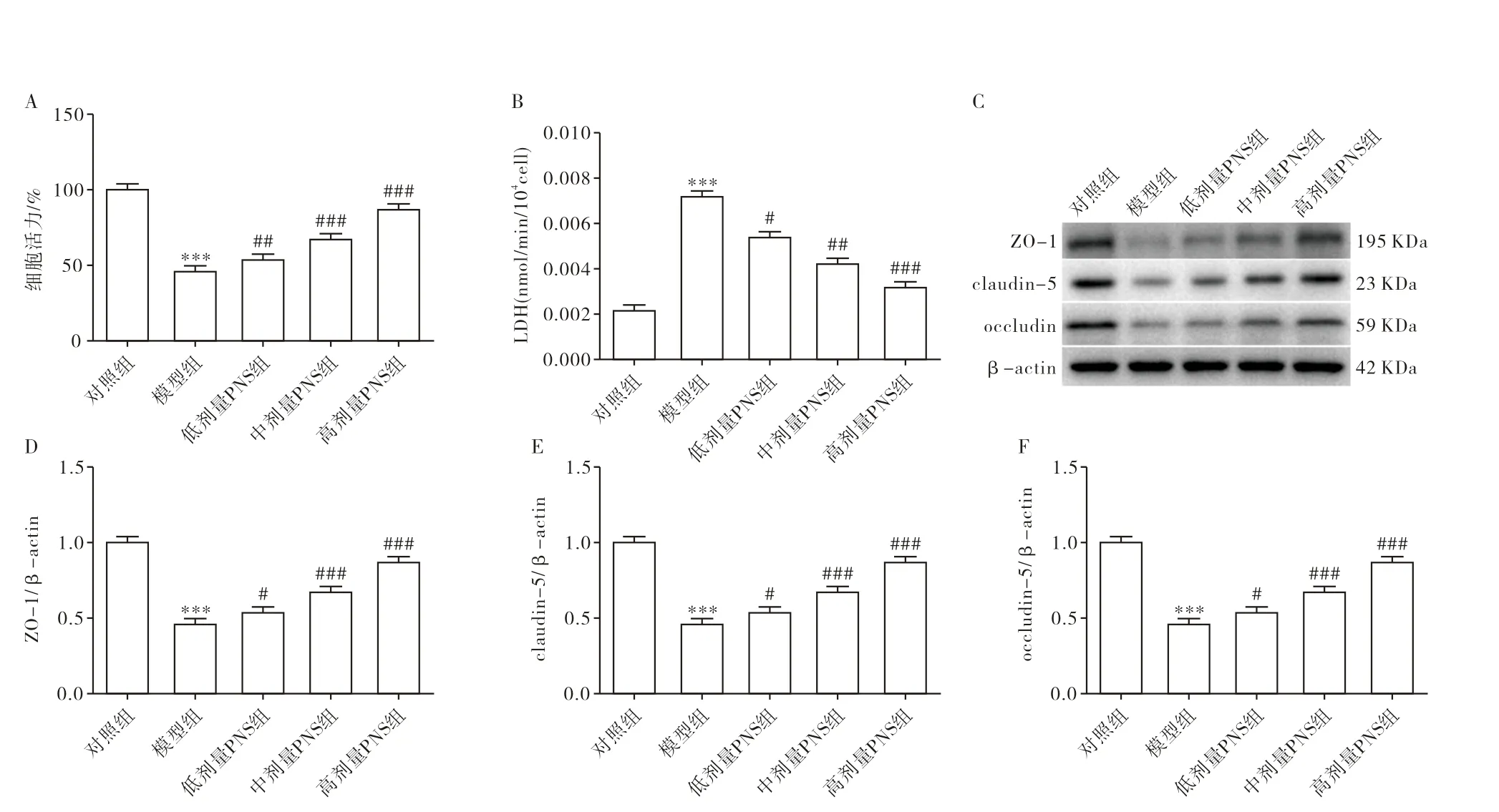
图1 PNS对OGD/R诱导的脑内皮细胞bEnd.3活性和屏障损伤的影响
2.2 PNS对OGD/R诱导的脑内皮细胞bEnd.3迁移和侵袭及血管生成的影响
由图2A、图2B可知,与对照组相比,模型组中划痕宽度极显著增加,细胞侵袭数目极显著降低,说明细胞迁移和侵袭能力极显著降低。PNS处理后,划痕宽度极显著降低,细胞侵袭数目极显著增加,说明细胞迁移和侵袭能力极显著增强,细胞迁移和侵袭能力的增强呈PNS浓度依赖型。由图2C可知,与对照组相比,模型组中细胞形成的管腔数量极显著降低,PNS处理后,细胞形成的管腔数量极显著增加。
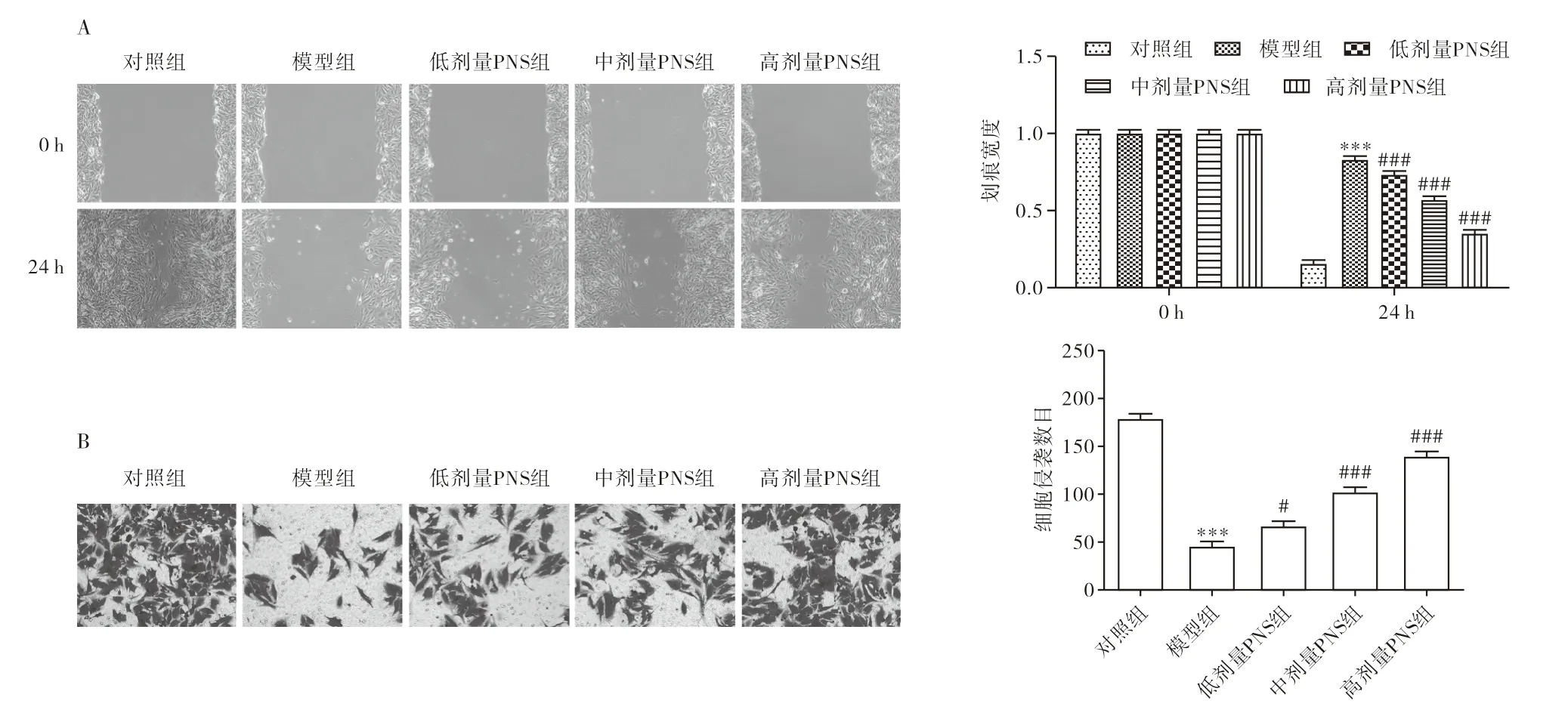
图2 PNS对OGD/R诱导的脑内皮细胞bEnd.3迁移和侵袭及血管生成受损的影响
2.3 PNS对OGD/R诱导的脑内皮细胞bEnd.3细胞中PPARα/Nrf2信号表达的影响
蛋白印迹试验检测PNS对bEnd.3细胞中PPARα、Nrf2、HO-1信号相关蛋白表达的影响。由图3可知,与对照组相比,模型组中PPARα、Nrf2、HO-1表达极显著降低。PNS处理后,PPARα、Nrf2、HO-1蛋白表达极显著增加。然而,在PNS处理基础上,加入PPARα抑制剂后,细胞中PPARα、Nrf2、HO-1表达极显著降低。

图3 PNS对OGD/R诱导的脑内皮细胞bEnd.3细胞中PPARα/Nrf2信号表达的影响
3 讨论
本研究从内皮细胞活性损伤、内皮屏障损伤、内皮细胞侵袭和迁移及血管生成损伤角度出发,研究了PNS对OGD/R诱导bEnd.3细胞的影响,发现PNS通过激活PPARα/Nrf2信号减轻OGD/R诱导的内皮细胞活性损伤、内皮屏障损伤、内皮细胞侵袭和迁移及血管生成损伤。
OGD/R会导致内皮细胞的各种损伤,包括细胞活力受损[15-16]。研究表明,PNS处理对细胞活性具有促进作用,本研究发现,OGD/R诱导显著降低了bEnd.3细胞活性,经过不同浓度的PNS处理后,OGD/R诱导的bEnd.3细胞活性逐渐升高。然而bEnd.3细胞中,OGD/R诱导的LDH高表达经过PNS处理后显著降低。
改善血脑屏障损伤对于减轻缺血再灌注损伤具有重要意义[17]。bEnd.3细胞具有脑微血管内皮细胞的屏障特性[18]。毛细血管内皮细胞之间的紧密连接(tight-junction,TJ)是血脑屏障结构和功能的基础[19]。紧密连接蛋白包括claudin 5、occludin和ZO-1,是血脑屏障渗透性特性的关键决定因子[20]。本研究发现,OGD/R显著降低了claudin 5、occludin和ZO-1表达水平,这与LI等[21]研究结果一致。经过PNS处理后,claudin 5、occludin和ZO-1表达水平逐渐增加。
内皮细胞对维持血脑屏障完整性具有重要意义[22]。大量研究表明,PNS可调节内皮细胞功能。此外,研究还发现PNS通过诱导内皮细胞迁移和管腔形成数量发挥其对急性心肌梗塞的保护作用[23]。本研究发现,PNS处理促进了OGD/R诱导的bEnd.3细胞迁移和侵袭及管腔形成数量的能力。
氧化应激是导致脑屏障损坏的主要病理过程[24]。研究表明,Nrf2是细胞抗氧化应激反应的重要调节因子[5]。Nrf2通路认为是对抗氧化应激介导疾病的有效靶点[6]。此外,研究还发现,PPARα通路的激活有助于抑制氧化应激[25]。本研究借助蛋白印迹法测定PPARα、Nrf2、HO-1表达,发现PNS显著提高OGD/R诱导的bEnd.3细胞中PPARα、Nrf2、HO-1表达,表明PNS可激活OGD/R诱导的脑内皮细胞bEnd.3细胞中PPARα/NRF2信号。综上所述,PNS可减轻OGD/R诱导的内皮细胞屏障和功能损伤并激活PPARα/NRF2信号,这一结论丰富了脑缺血再灌注损伤的药物机制。

