肥胖引起血脑屏障功能障碍的表型和机制研究进展
冯梓莹, 方 程综述, 畅君雷审校
随着经济社会发展和生活水平提高,肥胖的流行率在全球范围内迅速增长,1975—2016 年间增长了近3 倍[1]。根据世界卫生组织发布的数据,截至2016 年,全球18 岁及以上成年人中约有19 亿人超重,11.2亿人肥胖。肥胖可以显著增加心脏病、糖尿病、高血压、部分癌症等多种疾病的发病风险,严重影响寿命和生活质量,造成巨大的健康和经济负担。近年来,研究发现,肥胖是多种神经系统疾病如阿尔茨海默病[2]和脑卒中[3]的一个风险因素,这意味着肥胖对神经系统疾病的发生发展起到了关键作用。全面了解肥胖对中枢神经系统(central nervous system,CNS)的有害影响,特别是对脑血管系统的影响对预防和治疗肥胖相关的神经系统疾病至关重要。脑血管系统的一个关键组成部分是血脑屏障(bloodbrain barrier,BBB),其主要位于小动脉、毛细血管和小静脉等部分。BBB 严格控制血液中的分子和细胞进入脑组织,并及时地排出或降解脑组织的代谢产物或偶然进入脑组织的有害物质,对维持脑组织微环境稳态和神经细胞正常功能具有关键作用[4,5]。然而,在肥胖状态下,特别是在高脂饮食(high fat diet,HFD)摄入的背景下,这一关键屏障可受到损伤,发生功能障碍,潜在导致各种神经系统疾病的发生发展。本文旨在探讨肥胖状态下BBB功能障碍的表型和潜在机制研究进展,着重阐述了BBB 功能障碍在肥胖中的重要性及其对神经健康的影响,以指导未来的研究和临床实践。
1 血脑屏障的细胞和分子组成
BBB 是中枢神经系统血管相对外周组织血管所具有的特殊结构,其独特功能归功于其复杂的细胞和分子组成成分,包括脑内皮细胞、周细胞、细胞外基质、星形胶质细胞,以及小胶质细胞和神经元,后者共同构成神经血管单元(neurovascular unit,NVU)[6]。这些细胞和分子成分相互联系、相互作用,对BBB起重要的支撑作用,共同调节BBB的功能。
在结构上,脑内皮细胞紧密排列构成血管内壁,是BBB 的主要组成部分。作为BBB 的第一防线,脑内皮细胞具有独特的转录特征和特化的差异基因表达谱[7],具有能与外周内皮细胞区分开的独特属性[8-10],主要包括:(1)通过高水平的紧密连接蛋白(tight junction proteins,TJs)相连,限制细胞旁运输;(2)缺乏膜开窗(fenestration)并表现出低水平的胞吞转运(transcytosis)活性,限制跨细胞转运;(3)表达多种特定的转运蛋白,为大脑提供营养物质(如葡萄糖转运蛋白1,Glut1)和健康环境(如毒性分子外排蛋白P-糖蛋白,P-gp);(4)表达低水平的白细胞黏附分子,以限制病原体和免疫细胞入脑;(5)具有数量更多、体积更大的线粒体,为运输营养物质至大脑提供充足能量。
NVU 中其他细胞对BBB 的维持同样起着重要作用。具体来说,周细胞通过延长其胞体突起覆盖脑内皮细胞,从而起到调节脑血流、血管发育、紧密连接表达等作用[11];星形胶质细胞通过其端足包裹脑内皮细胞和周细胞,可分泌Shh(sonic hedgehog,Shh)来刺激紧密连接蛋白的表达,并降低炎症因子的表达来促进BBB 的免疫静止[12];小胶质细胞是大脑中的常驻免疫细胞,既可参与BBB 保护和神经修复过程,也可通过释放各种炎症因子损伤BBB,发挥双重作用[13];神经元与NVU 中的其他细胞如内皮细胞、周细胞和星形胶质细胞相接触、交流,以调节BBB 的特性,并构成神经血管耦合效应的基础功能单元[14]。此外,非细胞成分细胞外基质通过为NVU中的细胞提供结构支撑、介导细胞内或间的信号通路等,也在BBB的维持中发挥重要作用[15]。
2 肥胖引起的血脑屏障通透性改变:表型和机制
鉴于肥胖与各种神经系统疾病之间的关系,肥胖对BBB完整性的影响是一个日益受到关注的研究领域。BBB 完整性的破坏或通常所提及的“BBB 渗漏”,是在肥胖状态下特别是HFD 摄入背景下所观察到的常见表型,是由多种因素相互作用形成的复杂病理状态。
肥胖引起的BBB渗漏的一个关键因素是紧密连接蛋白的失调。如前所述,紧密连接蛋白对于维持BBB 的完整性至关重要,然而在肥胖状态下,这些蛋白的表达和功能被改变。例如,经8周的HFD 喂养,小鼠脑微血管紧密连接蛋白ZO-1、Claudin-5 和Occludin 的蛋白水平显著下降,并在氨苯砜治疗下得到有效改善[16]。为时3 个月的高脂高糖饮食则降低了大鼠脉络丛和BBB 紧密连接蛋白的mRNA 水平,尤其是Claudin-5。因此,在这些大鼠的海马体中观察到荧光素钠的渗透性增加,但在纹状体或前额叶皮质中则没有差异[17]。值得注意的是,肥胖不仅对自身的BBB 有影响,还会对后代产生影响。研究证明母鼠妊娠期肥胖会损害胎儿BBB 的形成,使得子代大脑弓状核区域的紧密连接成分改变,BBB 渗透性显著增加[18]。紧密连接蛋白的失调损坏了BBB的完整性,导致BBB渗漏,使潜在有害物质得以从血液中进入CNS。最近的研究也将长时间摄入HFD与神经行为变化联系起来,这些神经行为恶化也伴随着紧密连接的表达异常。24 周的HFD 会导致焦虑样行为和抑郁样行为的增加[19],这可能与肠道微生物群稳态受损和炎症有关,长期的HFD可能通过肠-脑轴诱发与神经疾病相关的行为表型。与此相符的是,用抗炎分子棕榈酰乙醇胺治疗可以有效改善肥胖小鼠的焦虑样行为,同时抑制外周和中枢炎症[20]。肥胖不仅会破坏紧密连接蛋白的表达和BBB的完整性,而且还可能引发神经行为的改变,从而继发影响BBB 功能,因此需要更深入的研究来阐明肥胖、BBB功能和神经行为之间复杂的相互作用。
在正常情况下,脑内皮细胞缺乏膜开窗,限制分子跨细胞运输,有助于BBB 完整性地维持。膜开窗数量的异常增加会增强BBB 的通透性。因此,研究肥胖期间脑内皮细胞膜开窗的数量变化将能进一步了解BBB 渗漏的表型和机制。与此相一致的是,一项研究表明肥胖会导致脑内皮细胞的膜开窗增加。在该研究中,母鼠在妊娠期持续摄入HFD,导致其后代下丘脑弓状核的内皮细胞膜开窗率和血管通透性均显著高于对照组[18]。此外,质膜囊泡相关蛋白(PV-1)已被发现是内皮细胞开窗隔膜中的主要成分[21],其调节可能会影响开窗数。虽然肥胖与PV-1之间的直接联系还尚不明确,但上述研究提供了肥胖诱导开窗数增加的初步证据。以PV-1为靶点探索开窗改变的信号通路和调控机制将为肥胖如何引起BBB渗漏提供进一步的见解。
基质金属蛋白酶(matrix metalloproteinases,MMPs)是一种蛋白水解酶,其过量表达和激活会诱发细胞外基质的病理性降解以及组织结构和功能的损伤,如MMP-2 和MMP-9 对BBB 的破坏[22-24]。而肥胖与某些MMPs 的表达和活性增加有关,这可能是肥胖引起BBB 渗漏的机制之一。例如,肥胖受试者的MMP-9 水平升高[25,26]。此外,脂质运载蛋白-2(Lipocalin-2)在肥胖者的脂肪组织中也增加,并与MMP-2 和MMP-9 的活性相关[27]。这些结果表明,肥胖会上调部分MMPs,这可能是由Lipocalin-2 等介质的增加所驱动的。通过降解细胞外基质,这些MMPs可以破坏BBB 的结构完整性。靶向这些MMPs 及其调控途径可能为保护肥胖引起BBB渗漏提供治疗策略(见图1)。

图1 肥胖对血脑屏障通透性的作用及机制示意图
3 肥胖引起的血脑屏障转运功能障碍:表型和机制
除了造成BBB 渗漏外,肥胖还与BBB 转运功能的改变有关,包括瘦素(leptin)和胰岛素(insulin)等分子的运输异常、Glut1和P-gp等转运体的功能失调等。这些转运功能的改变不仅会影响大脑的营养供应,还会影响信号传导和毒素清除等过程,使得大脑处于危险情况中。
3.1 瘦素(leptin) 瘦素是一种脂肪因子,需穿过BBB 作用于下丘脑,才能发挥出调节食物摄入和能量消耗的重要作用。研究发现,肥胖小鼠对通过脑室内注射的瘦素有反应,却对通过皮下或腹腔注射的瘦素没有反应[28,29],表明肥胖可导致瘦素的BBB 运输功能受损[30],外周血液中的瘦素无法被正常运转至大脑。与此相一致的是,肥胖人群瘦素向大脑的运输水平也被下调,表现为脑脊液/血清的瘦素比值远低于健康瘦者[31,32]。总之,肥胖可抑制瘦素向大脑的运输,使大脑无法接收到瘦素发出的“饱腹信号”,于是造成过度进食,进一步加重肥胖并可能引发一系列代谢疾病。此外,有研究指出循环甘油三酯以浓度依赖式方式抑制瘦素的BBB 转运[33],而肥胖常伴随着较高水平的甘油三酯,对甘油三酯的循环水平进行干预,或许能有效治疗肥胖相关的BBB瘦素运输功能失调。
3.2 胰岛素(insulin) 胰岛素是CNS 重要的负反馈调节信号,对大脑的代谢健康有重要影响。循环胰岛素以饱和运输的方式通过BBB 进入大脑[34]。研究指出,在动物模型中,肥胖降低了胰岛素向大脑的运输速率[35,36];高脂饮食会损害脑内皮细胞对胰岛素的摄取能力[37]。在人类临床试验中,与健康瘦者相比,肥胖受试者脑脊液的胰岛素水平降低[38]。总的来说,这些研究表明,肥胖会减少胰岛素向大脑的输送,使得胰岛素在大脑中的生理作用受损,引发大脑胰岛素抵抗。值得注意的是,大脑胰岛素抵抗是常见神经系统疾病阿尔茨海默病的早期特征[39]。此外,与瘦素相似,有研究发现甘油三酯可穿过BBB,诱导大脑胰岛素受体抵抗[40],这提示靶向外周血液中的甘油三酯水平同样可能是治疗肥胖相关的BBB胰岛素运输失调的一种治疗策略。
3.3 葡萄糖转运蛋白1(Glut1) Glut1 在脑内皮细胞中高度表达,是负责将葡萄糖从血液运输至大脑以供应能量的主要转运体。在HFD 摄入背景下,Glut1 的表达和功能被改变。具体来说,短期急性HFD 摄入会抑制大脑中Glut1 的表达和葡萄糖摄取[41,42],但随着HFD 摄入的时间延长,Glut1 的表达被恢复,与血管内皮生长因子(VEGF)的代偿机制启动相关[42]。相似地,小鼠胰岛素抵抗模型显示,当2 周的HFD 显著下调脑血管Glut1 的表达时,10 周HFD却能使Glut1的表达正常化,提示胰岛素抵抗的持续时间会影响对Glut1 的调控[43]。综上所述,虽然短期HFD 导致的Glut1 功能失调可能会被长期HFD引发的代偿机制所改善,但大脑是一个时刻需要高能量维持运转的器官,葡萄糖供能的暂时中断可能足以影响神经元的健康,对大脑构成潜在危害。
3.4 P-糖蛋白(P-gp) P-gp 是一种ATP 依赖性的蛋白转运体,表达于脑内皮细胞。P-gp 负责将物质从大脑运返至血液中,以保护大脑免受暴露于堆积的代谢废物和神经毒性物质之中所造成的伤害。P-gp由ABCB1基因编码,研究发现,身体质量指数(BMI)值与大脑中ABCB1表达水平呈负相关,表明肥胖患者的P-gp 水平降低[44]。虽然将肥胖与P-gp调节联系起来的机制仍有待阐明,但全身性炎症似乎起到了一定的作用。在肥胖妊娠小鼠中,胎盘Pgp 的表达随着炎症因子如肿瘤坏死因子-α(TNFα)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)的增加而降低[45]。虽然关于肥胖与P-gp 的研究较少,但目前的证据表明肥胖可抑制P-gp的表达,进行深入研究探索肥胖中介导P-gp 表达下调的信号通路,将有助于制定恢复肥胖中BBB 运输功能的治疗策略(见图2)。
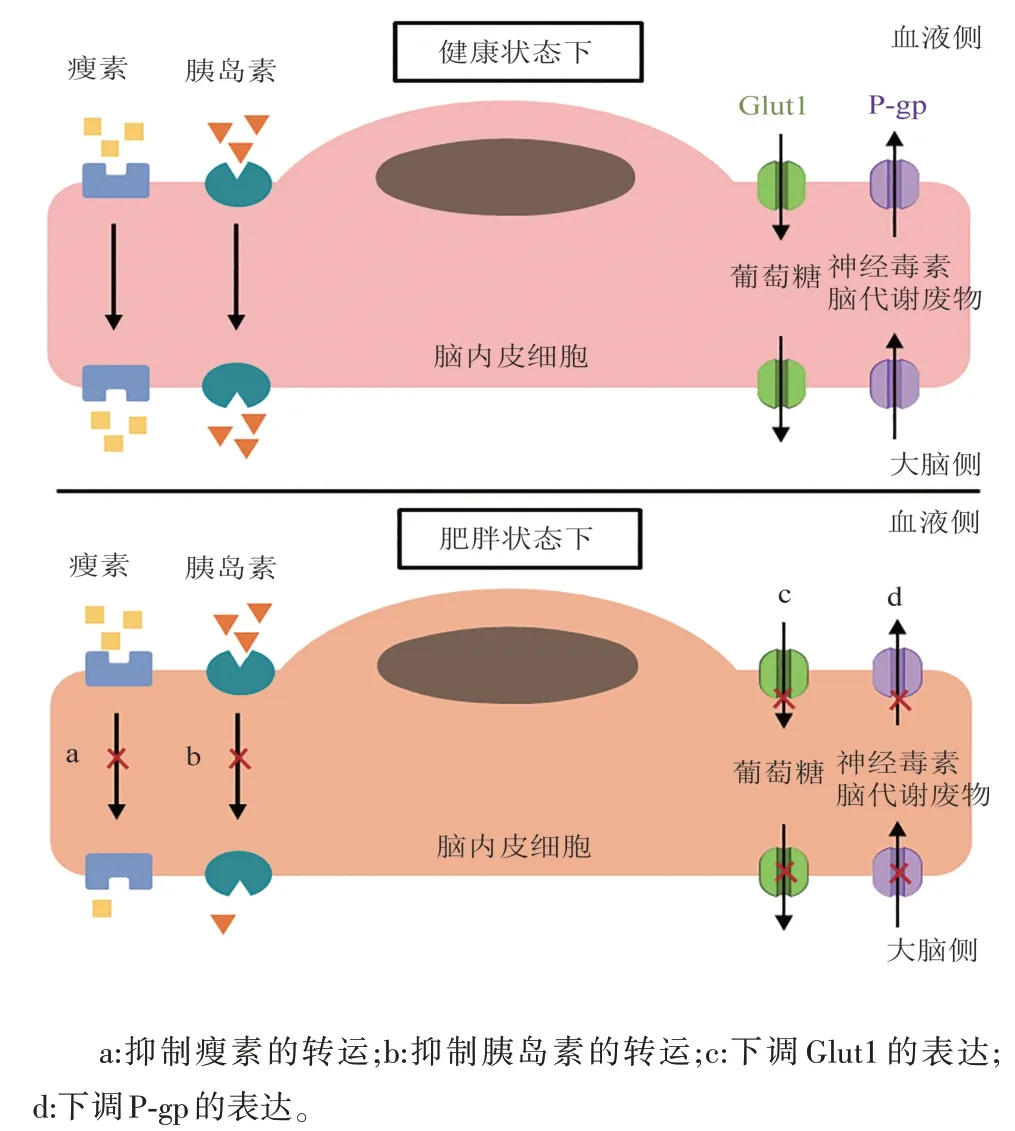
图2 肥胖对血脑屏障转运功能的影响及其机制示意图
4 肥胖引起的神经炎症:表型和机制
如前所述,肥胖会引起BBB通透性的增加,使得血液中的有害物质和免疫细胞得以入脑,导致常驻免疫细胞小胶质细胞的激活和外周免疫细胞的浸润,从而引发广泛的神经炎症,加快各种神经系统疾病的发生发展。近年来,神经炎症已被普遍认为是肥胖的一个重要病理特征。
小胶质细胞是大脑中的主要常驻免疫细胞,当受到病理性因素刺激时,小胶质细胞被激活并获得相应的免疫功能。不少研究表明,肥胖或HFD 会增加小鼠海马体或下丘脑区域小胶质细胞的激活,促进小胶质细胞释放大量的促炎因子,如TNF-α、IL-1β和IL-6等,造成脑内的促炎环境[20,46,47]。值得注意的是,有研究表明虽然小胶质细胞在高脂饮食诱导的早期肥胖阶段表现出促炎表型,但随着HFD 摄入时间的推移,会逐渐向抗炎表型转化。这种类型的反应似乎是小胶质细胞对慢性疾病或慢性损伤的典型反应,这也意味着高脂饮食诱导的肥胖给CNS 和小胶质细胞之间的稳态带来了慢性挑战[48]。
星形胶质细胞是CNS 中的另一种关键细胞类型,肥胖或HFD 会刺激反应性星形胶质细胞的增生[49,50]。与小胶质细胞类似,活化的星形胶质细胞也可以分泌TNF-α、IL-1β和IL-6等促炎因子[50],造成神经炎症。而抑制星形胶质细胞IKKβ/NF-κB 信号可减轻HFD 诱导的体重增加、葡萄糖耐受不良和下丘脑炎症[50],这表明IKKβ/NF-κB 信号通路对肥胖相关的星形胶质细胞活化过程至关重要。进一步鉴定反应性星形胶质细胞内改变的多种信号通路,如IKKβ/NF-κB 信号,可以促进新治疗靶点的鉴定,以减轻肥胖中与星形胶质细胞活化相关的神经炎症。
除了大脑的这两种胶质细胞,外周免疫细胞也被报道在肥胖状态下浸润CNS。一项运用骨髓嵌合小鼠模型的研究表明,与对照组相比,HFD诱导的肥胖导致CNS中的外周免疫细胞数量增加30%。这些外周免疫细胞大多数为CD45+CD11b+细胞,即表现出小胶质细胞/巨噬细胞的特征[51]。在瘦素受体缺乏的小鼠模型中,BBB 的破坏促进了外周巨噬细胞浸润肥胖小鼠的大脑[52]。还有一项研究表明,长期摄入HFD 会导致下丘脑弓状核单核细胞来源的巨噬细胞池扩大,这是由于巨噬细胞的增殖增强所致[53]。这些研究表明,在肥胖状态下,外周免疫细胞可以被募集到CNS,并与大脑常驻免疫细胞一起参与神经炎症的发生发展(见图3)。
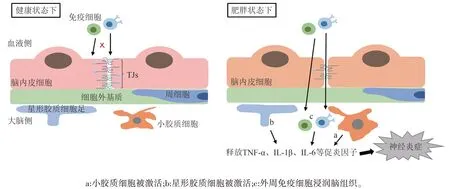
图3 肥胖引起神经炎症的表型和机制示意图
5 总结和展望
本文从BBB 通透性改变、转运功能障碍和神经炎症3 个方面,分析了肥胖背景下BBB 功能障碍的具体表现和调控机制,强调了肥胖对BBB 功能的有害影响。但目前尚不清楚BBB功能障碍是否为肥胖的普遍特征,或是与肥胖的程度、持续时间、年龄、性别和遗传易感性等因素有关,仍有待进一步研究。此外,肥胖引起的BBB 功能障碍的潜在可逆性以及实现这种可逆性的有效策略也值得探索。更为重要的是,了解BBB 功能障碍在肥胖相关神经系统疾病中的作用对未来的预防或治疗有重要的指导价值。通过更好地理解BBB功能障碍和神经系统疾病之间复杂的相互作用,我们可能会发现新的策略来减轻甚至防止肥胖对神经功能的有害影响。以BBB为靶点进行治疗干预具有巨大的潜力,不仅有望缓解肥胖引起的BBB功能障碍,而且有望减轻其下游效应,包括神经炎症和神经变性。
总之,肥胖引起的BBB 功能障碍代表了一个新兴的研究领域,其潜在影响超出了肥胖领域,延伸到广泛的神经系统疾病领域。随着我们对相关机制认识和了解的不断完善,有望更深入地了解肥胖对CNS 的影响,从而开发出针对BBB 功能障碍来治疗肥胖相关神经系统疾病的创新治疗策略。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:冯梓莹负责整理文献、起草论文、绘制图表和修改论文;方程负责修改论文;畅君雷负责指导论文撰写、修改论文并最后定稿。

