在不同养殖背景下鳜mc1r组织表达差异和启动子转录调控分析
贾晓丹 梁旭方 何 珊
(1.华中农业大学水产学院,华中农业大学鳜鱼研究中心,武汉 430070;2.农业农村部淡水生物繁育重点实验室/农业动物遗传育种与繁殖教育部重点实验室,武汉 430070)
体色在动物的生存繁衍、逃避敌害、信号交流和光保护等方面起着重要作用,是脊椎动物多样性最丰富的形态之一[1]。鱼体颜色不仅会随着生命周期的改变而改变,紫外线、摄食及水体背景颜色也会影响鱼体颜色[2]。例如斑马鱼(Danio rerio)会迅速通过细胞中黑色素的聚集或分散来适应环境的变化[3]。鱼类之所以拥有五彩斑斓的体色,是由于鱼体中存在无数的色素细胞,而黑色素细胞是目前研究最为广泛且深入的色素细胞类型[4,5]。
黑素皮质素 1 受体基因(Melanocortin 1 receptor,mc1r)属于黑素皮质素家族成员,最早在黑色素细胞中被发现,是皮肤黑色素合成的关键基因[1],mc1r无内含子且其蛋白包含7个跨膜结构域,mc1r可以与促黑素细胞激素(α-MSH)与促肾上腺皮质激素(ACTH)结合形成偶联受体,并且α-MSH与mc1r的亲和力更高,是皮肤黑色素合成主要信号通路[7,8]。目前,mc1r结构、功能及毛色表型在人、鼠、猪和牛等哺乳动物中已有较为深入研究,在大菱鲆(Scophthalmus maximus)、虹鳟(Oncorhynchus mykiss)、欧洲鲈(Dicentrarchus labrax)和斑马鱼等少数鱼类中也进行了初步研究[4,9,10]。有研究显示鱼类体色的深浅与mc1r基因的表达量呈负相关[11]。斑马鱼mc1r基因敲除导致其背部和腹侧皮肤色素沉着显著减少[12]。mc1r基因的改变与穴居鱼(Astyanax)色素沉积减少有关[13]。瓯江彩鲤(Cyprinus carpio var.color)在敲除mc1r基因后,会改变皮肤斑块形成模式[14]。在日本比目鱼(Paralichthys olivaceus)中发现mc1r在色素沉着区域具有高的基因表达量[15]。同时mc1r可以作为鱼类系统发育研究的良好分子标记。
鳜(Siniperca chuatsi)隶属于鲈形目,真鲈科,鳜属,是主要原产湖北的我国传统名贵肉食性鱼,肉质细嫩,营养价值高,是我国淡水养殖的理想选择[16]。养殖过程发现,同种鳜在不同的养殖环境中其体色及色彩图案有明显区别。为了清楚mc1r在不同表型鱼体中的表达模式,以及转录调控机制,本实验拟以鳜为研究对象,从鳜基因组数据库中获取mc1r基因序列并进行相关的生物信息学分析,其次通过实时荧光定量PCR分析不同养殖背景下产生的深浅色鳜组织表达差异。最后通过对mc1r基因5′-侧翼区启动子序列进行克隆和转录活性分析,鉴定鳜mc1r基因核心启动子区域及关键转录因子,从而为鱼类mc1r基因的表达调控及后续研究提供理论依据。
1 材料与方法
1.1 实验用鱼及实验条件
实验所用鳜来自华中农业大学鳜研究中心,将实验鱼分别放入黑、白背景并带有连续水过滤和通风系统的圆形鱼缸中,鱼缸直径为1 m,水深1.2 m,光照为自然光。每个鱼缸12尾鱼(80±5) g,每组3个重复,正常饲养3个月。在养殖结束后,从每个鱼缸中随机选取6尾鱼,150 mg/L MS-222麻醉后解剖以获得肝脏、肠道、肌肉、背部皮肤、腹部皮肤、鳃、心脏、眼睛、大脑和肾脏组织,并在液氮中快速冷冻,随后在-80℃冰箱保存,用于后续基因表达分析。
1.2 mc1r生物信息学分析
鳜mc1r基因序列来自笔者所在课题组翘嘴鳜基因组数据库,利用NCBI (https://www.ncbi.nlm.nih.gov/) 检索人(NP_002377.4)、鼠(NP_032585.2)、欧洲鲈(CAY39344.1)、大口黑鲈(XP_038556432.1)、尼罗罗非鱼(XP_005467175.1)、青鳉(XP_01149 0066.1)、斑马鱼(NP_851301.1)、虹鳟(NP_00118 2107.1)、河豚(NP_001127927.1)、大西洋鲑(XP_013982515.1)、大菱鲆(XP_035485284.1)、日本比目鱼(XP_019954259.1)、尖吻鲈(XP_01852 3508.1)、鸡(NP_001026633.2)氨基酸序列。使用SMART(https://smart.embl-heidelberg.de/)分析蛋白质结构域,使用SOPMA(https://npsa-prabi.ibcp.fr/)和SWISS-MODEL(http://www.swissmodel.expasy.org/)分析蛋白质二级和三级结构,利用Clustal分析氨基酸序列一致性,并利用MEGA10.0软件以邻接法(neighbor-joining)构建系统发育进化树(bootstrap=1000)。
1.3 组织表达分析
利用NCBI设计mc1r的特异性引物mc1r-F和mc1r-R,并以鳜核糖体蛋白L13a(rpl13a)作内参基因用于组织表达分析,所用引物见表1。使用RNAiso Plus (TaKaRa)提取鳜不同组织总RNA,然后用多功能酶标仪(Bio-Tek)和1.2%琼脂糖凝胶电泳检测提取RNA的纯度和浓度。使用HiScript®ⅡReverse Transcriptase (Vazyme)反转录合成cDNA,置于-20℃ 冰箱保存。以cDNA为模板,使用SYBR qPCR Master Mix试剂盒(Vazyme)进行RT-qPCR,RT-qPCR反应体系为模板cDNA 1 μL,上游引物和下游引物各0.4 μL,SYBR 10 μL,用ddH2O将反应体系补足到20 μL。反应程序为95℃,预变性3min,95℃变性10s,57℃退火30s,进行39个循环,72℃延伸45s。并使用2-ΔΔCt值法测定mc1r基因的相对表达量[17]。

表1 组织表达分析所用引物Tab.1 Primers for tissue expression analysis
1.4 mc1r基因启动子不同片段克隆和分析
通过在线软件JASPAR(http://jaspar.genereg.net)、AliBaba2.1(http://gene regulation.com/pub/programs/alibaba2/index.html)预测潜在的转录因子结合位点。转录起始位点(TSS)和TATA盒由BDGP(http://www.fruitfly.org/seqtools/promoter.html) 和Promoter 2.0 (http://www.cbs.dtu.dk/services/Promoter/)预测。以鳜仔鱼DNA为模板,选择鳜mc1r第一外显子之前的启动子序列作为研究对象,设计启动子不同长度片段的扩增引物,所设计的引物见表2,进行普通PCR扩增。PCR反应体系为20 μL: 鳜基因组DNA 1 μL,ddH2O 8 μL,高保真酶10 μL,上下游引物各0.5 μL。反应程序: 95℃预变性5min,95℃变性30s,57℃退火15s,72℃延伸(2 kb/min),35个循环;72℃延伸5min。
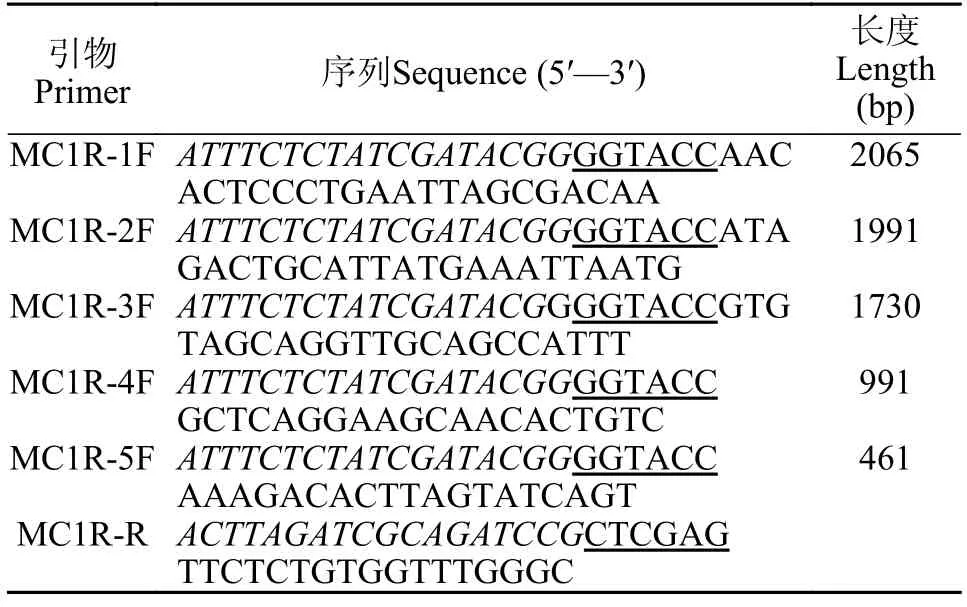
表2 鳜鱼基因启动子不同长度片段的扩增引物Tab.2 Primers used for fragments amplification of Chinese perchmc1rpromoter
1.5 双荧光素酶质粒构建
将pGL3-Basic质粒用kpnⅠ和XhoⅠ内切酶双酶切。将扩增正确的PCR产物胶回收后克隆到双酶切的pGL3-Basic质粒中,选择阳性重组质粒进行测序。测序正确的重组质粒分别命名为pGL3-2065、pGL3-1903、pGL3-1730、pGL3-991和pGL3-461。
1.6 细胞培养、瞬时转染及双荧光素酶活性测定
如前所述,进行了细胞培养、瞬时转染和双荧光素酶活性测定[18]。HEK 293T细胞在转染前在24孔板中铺板,并在37°C的充满5% CO2的培养箱中过夜培养,使转染当天的细胞总量达到75%。然后按照制造商的说明使用lip2000 (Promega) 以pGL3-basic载体作为阴性对照,转染鳜mc1r不同启动子片段重组质粒。每孔转染液为opti-MEM培养基100 μL,质粒500 ng,pRL-TK 20 ng,lip2000 1.5 μg。培养24h后,将转染后的细胞用1x DPBS洗涤两次后用裂解缓冲液(Promega)裂解细胞,之后收集细胞,并根据制造商说明书使用双荧光素酶检测试剂盒(Promega)检测mc1r启动子相对活性。启动子的相对活性用萤火荧光素酶的值/海肾荧光素酶的值表示。
1.7 数据分析
采用SPSS 25.0软件进行统计学分析。以鳜rpl13a作为内参基因,采用2-ΔΔCt方法计算相对基因表达水平[17],单因素方差分析(One-way ANOVA)用来检测样本之间的差异性。使用GraphPad Prism 7软件进行绘图。统计学上的显著性水平设置为P<0.05。
2 结果
2.1 鳜体色
鳜体色如图1所示,在黑色和白色背景鱼缸中养殖3个月后,黑色背景鱼缸中养殖的鳜体色较深(图1A),而白色背景鱼缸中养殖的鳜体色较浅(图1B)。

图1 黑、白色养殖背景产生的深色鳜和浅色鳜Fig.1 Black and white tank backgrounds produced the dark and light-colored Chinese perch phenotype
2.2 鳜mc1r基因序列和系统发育分析
根据鳜基因组数据库和NCBI下载的基因序列可知,mc1r基因开阅读框为978 bp,编码325个氨基酸且3′末端具有1 bp的Poly(A)尾巴,但不含脊椎动物典型的加尾信号(AATAAA)。通过TMHMM和Conserved Domains分析发现鳜mc1r基因的蛋白也为7跨膜结构域,其他报道物种相符。二级结构分析显示Mc1r蛋白包含169个α螺旋(52.00%)、10个β折叠(3.08%)、98个无规卷曲(27.38%)和57个延伸结构(17.54%)。三级结构分析表明,该蛋白也主要以α螺旋和无规卷曲为主(图2)。氨基酸序列比对和系统发育分析显示,鳜mc1r基因与大口黑鲈(Micropterus salmoides)同源性高达95.7%,与欧洲鲈(Dicentrarchus labrax)同源性为95.4%,且聚为一支;其他鱼类如斑马鱼(Danio rerio)、虹鳟(Oncorhynchus mykiss)和大西洋鲑(Salmo salar)聚为另一支;而与人类(Homo sapiens)及小鼠(Mus musculus)的同源性较低(图3)。
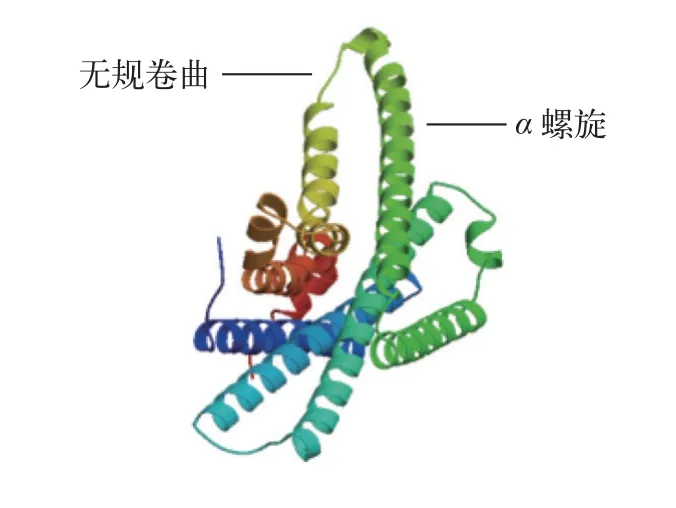
图2 鳜Mc1r蛋白的三级结构Fig.2 Tertiary structure of Mc1r protein in Chinese perch
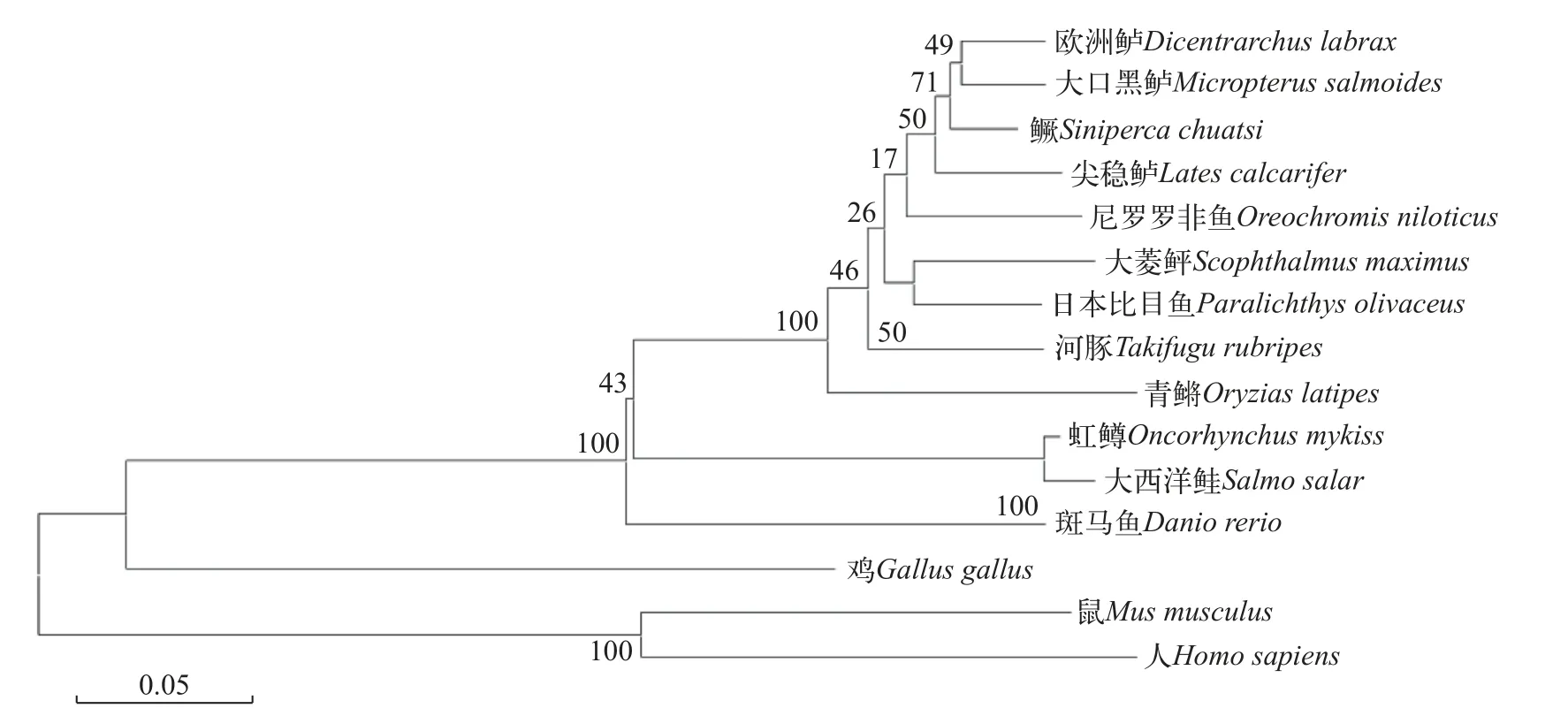
图3 鳜与其他脊椎动物mc1r基因氨基酸序列系统进化树Fig.3 Phylogenetic tree of amino acid sequence ofmc1rgene in andarin fish and other vertebrates
2.3 表达差异分析
如图4所示,对于深色体表鳜,其表达量由高到低依次为背部皮肤、腹部皮肤、肝脏、眼、脑、肾脏、肌肉、心脏、鳃和肠,且背部皮肤表达量最高,显著高于其他组(P<0.05)。在浅色体表鳜中,脑中表达量最高,其次是腹部皮肤,且显著高于其他组(P<0.05)。
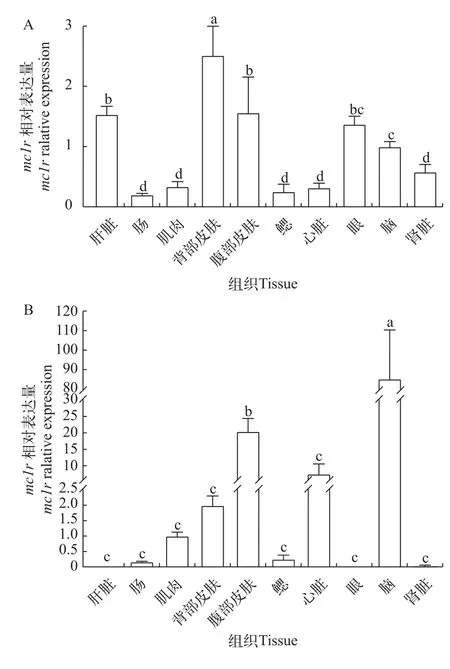
图4 鳜mc1r在不同组织中的表达分析Fig.4 Analysis ofmc1rexpression among different tissues in Chinese perch
2.4 mc1r基因启动子表达载体构建
将构建成功的pGL3-2065、pGL3-1903、pGL3-1730、pGL3-991和pGL3-461重组质粒电泳检测发现,目的条带与PCR产物条带一致,经测序与启动子序列一致,表明重组质粒构建成功,并可以用于启动子活性分析。
2.5 mc1r启动子报告基因活性检测
将构建好的鳜mc1r重组质粒和pGL3-basic对照质粒分别与pRL-TK瞬时共转染到HEK 293T细胞,培养24h后收集细胞,并检测各重组质粒和对照质粒的荧光值,分析各个重组质粒的活性。结果显示,重组质粒荧光活性与对照质粒pGL3-Basic均有显著性差异(P<0.05),其中pGL3-461的相对荧光活性最高,提示-159∽+292为鳜mc1r基因启动子的核心区域。随着启动子区域逐渐截短,pGL3-991荧光素酶活性明显低于pGL3-461,说明-159∽+292 bp可能存在转录激活子结合位点或正向调控元件;-698∽-160 bp可能具有转录抑制因子结合位点或负调控元件(图5)。通过在线软件JASPAR和AliBaba 2.1预测可知预测出的核心启动子区域存在小眼畸形相关转录因子(MITF)和SP-1等关键转录因子结合位点(图6)。
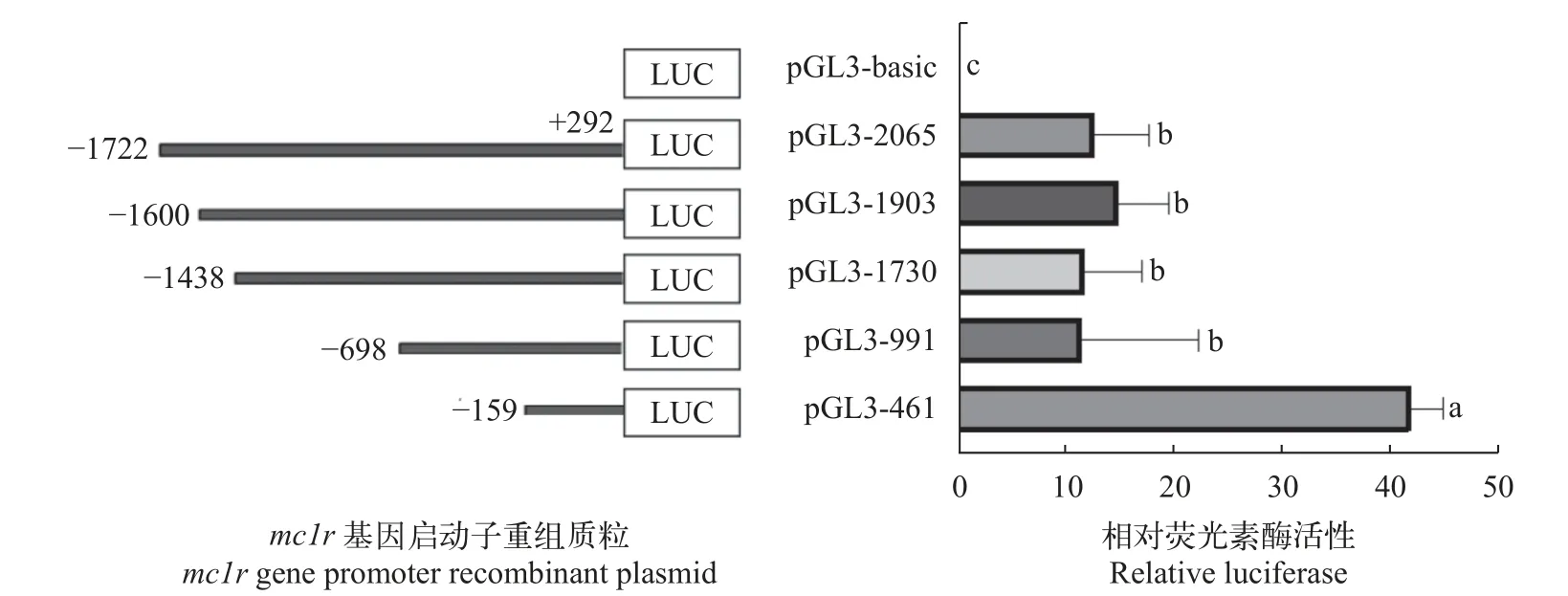
图5 鳜mc1r基因不同启动子重组质粒的相对荧光素酶活性Fig.5 Relative luciferase activity of recombinant plasmid ofmc1rgene in Chinese perch

图6 转录因子结合位点Fig.6 Transcription factor binding sites
3 讨论
3.1 鳜mc1r分子特征及系统发育
尽管已有100多个基因位点被确定与脊椎动物色素沉着有关,但黑皮质素系统始终是色素表型的关键决定因素[19,20]。有大量的研究表明mc1r与动物毛色、肤色等紧密相关,其在参与色素合成及色素沉积方面发挥了重要作用。哺乳动物和鸟类的皮肤和毛发颜色变化缓慢,通常需要数周时间。然而,在不同的养殖环境中,鱼类可以通过黑色素颗粒的快速运动迅速改变身体颜色[21]。在本研究中,通过对鳜mc1r序列分析可知mc1r基因开阅读框为978 bp,编码325个氨基酸,属于G蛋白偶联受体超家族,在鱼类及哺乳动物序列中高度保守,有7个跨膜结构域,与其他报道物种相符[21,22]。mc1r在迄今为止分析的所有鱼类和四足动物物种中以单拷贝基因存在[12,24]。通过氨基酸序列同源比对和系统发育进化树分析发现,鳜mc1r在硬骨鱼类和哺乳动物间呈现不同的同源性及亲缘关系。其中,鳜与欧洲鲈和大口黑鲈序列相似性最高,亲缘关系更近,与哺乳动物亲缘关系最远,这与鳜隶属于鲈形目相符合。
3.2 不同养殖背景下鳜体色及mc1r组织表达差异
本研究将鳜分别养殖在黑、白色背景鱼缸中,与白色养殖背景中的浅色体表鳜相比较,在深色鱼缸中鳜体色呈现黄绿色,头部的细长条纹、躯干部纵宽的条纹、斑块及鳍上的斑点都更清晰可见,与野生型鳜更为接近。鳜是生活在江河、湖泊、水库中的底栖性鱼类,通常白天栖息于水底或草丛茂密的地方,到晨昏或夜间才到临岸的草丛中觅食,因此黄绿色体色及体表的斑块或条纹更有利于隐藏自身来达到躲避敌害和顺利捕食的目的[23,24]。因此,从生活习性角度考虑鳜可能更适合于养殖在黑色或深色背景中,这可能也有利于获得健康优质鳜,促进鳜产业健康可持续发展。
本研究采用 RT-qPCR 方法检测了鳜mc1r在不同养殖环境中的组织表达差异,结果显示,在深色和浅色体表中鳜mc1r基因表达有很大差异。对于深色体表鳜,其背部皮肤表达量最高,其次是腹部皮肤、肝、眼、脑、肾,在心、鳃、肌肉和肠道表达量最低;对于浅色体表鳜,其在脑中表达量最高,其次是腹部皮肤和心,在背部皮肤、肌肉、鳃、肠道、肾、眼和肝中表达量最低,且脑中mc1r表达量与其他组织相比差异极显著。这与mc1r基因参与色素沉积及与黑素皮质激素(α-MSH和ACTH)结合在鱼类黑素生成途径中发挥重要作用相一致。通过对不同背景颜色培养的东星斑 (Plectropomus leopardus)背部皮肤组织进行转录组分析,揭示mc1r表达量随着背景颜色的加深而增加[25]。有研究表明,明亮的背景会导致鱼体的黑色素聚集,从而导致皮肤颜色变浅;而背景颜色加深会使得黑色素分散,从而使得整个皮肤颜色加深[26]。然而,在不同鱼类中,mc1r基因有着不同的表达模式。斑马鱼在大脑、眼睛、皮肤和精巢中表达,但在鳃、肝脏、肌肉和卵巢中不表达[25]。青鳉在所有组织中都有表达,包括大脑、眼睛、肌肉和皮肤等[24]。在锦鲤(Cyprinus carpio)中,其在黑色皮肤和眼中有最高的表达量,在白色皮肤、脑和肌肉表达量稍低,鳃、肾和肝脏表达量最低[26]。一些研究表明,在长期适应亮或暗背景的过程中,鱼也可以通过减少或增加黑色素细胞的数量和大小来改变其颜色[21,27]。研究显示在硬骨鱼类中,背侧和腹侧区域颜色之间的明显分界通过色素细胞的图案化分布实现[20]。
3.3 鳜核心启动子区域及关键转录因子分析
为了探究鳜mc1r启动子区域的转录活性,根据在线软件初步预测的核心启动子区域,构建了5个5′端序列缺失报告基因载体,结果显示不同缺失片段启动子活性之间存在显著差异,且-159∽+292 bp启动子区域荧光活性最高,推测该区域为核心启动子区域。通过在线软件预测出核心启动子区域存在SP-1、MITF等关键转录因子。有研究表明,在黑色素瘤细胞中,人的mc1r启动子在-517∽-282 bp区域具有最高的荧光素酶活性,且该区域内的SP-1转录因子结合位点删除后其荧光活性显著降低[28]。在小鼠中,MITF共转染情况下,其mc1r启动子区域从-483 bp荧光活性显著增加,表明MITF可以调控mc1r基因的表达[29]。MITF被认为是黑色素细胞的主要调节因子,因为它调节细胞分化、生长、存活和黑色素合成。同时,MITF也被证明参与mc1r的转录[30,31],一致的,有研究表明MITF可以通过黑色素细胞特异性基因(mc1r)中的E-box结合位点直接激活转录来调控黑色素细胞的分化[35]。因此,SP-1和MITF可能通过与mc1r启动子区域转录因子结合位点结合后调控转录过程,促进黑色素细胞的分化与黑色素颗沉积,从而改变体色。
综上所述,本研究中鳜mc1r基因在深浅色体表鳜组织表达存在显著差异,深色体表鳜在背部皮肤和腹部皮肤高表达,浅色体表鳜在脑中和腹部皮肤高表达。报告基因显示-159∽+292 bp启动子区域荧光活性最高,推测该区域为核心启动子区域。本研究首次克隆了鳜mc1r基因启动子区域并进行了转录活性分析,并且对潜在的转录因子进行了预测,为鱼类mc1r基因分子机制表达调控及表皮颜色可控性研究提供了理论依据。

