玉米须总黄酮抗大鼠高尿酸血症及肾脏保护作用
黄宇涵,徐 莎,房 伟,宋 玮,贺雅静,张玉霞,马振勇
1)商丘医学高等专科学校药学院 河南商丘 476005 2)商丘医学高等专科学校基础医学院 河南商丘 476005 3)河南中医药大学第一附属医院药学部 郑州 450000 4)商丘市第一人民医院病理科 河南商丘 476100 5)商丘医学高等专科学校临床医学院 河南商丘 476005
高尿酸血症(hyperuricemia,HUA)主要由体内嘌呤代谢紊乱,尿酸(uric acid,UA)生成增加和(或)排泄减少引起。长期的高UA水平会诱发痛风性关节炎,导致肾脏损伤[1]。近年来研究[2]显示,我国HUA患病率已高达18.4%,且逐渐年轻化。目前,控制HUA主要依靠别嘌呤醇、苯溴马隆、非布司他等药物,但长期应用可诱发超敏变态反应综合征、胃肠道功能失调、肝脏毒性等不良反应[3-5]。因此,寻找无毒副作用的抗HUA药物已成为药学研究的一个热点[6-7]。
玉米须是禾本科植物玉蜀黍的花柱和柱头,是传统的中药材,味甘、性平、无毒,具有利尿、解热、平肝、利胆等作用。玉米须总黄酮(total flavonoids from corn silk,TFCS)是玉米须的主要功能成分[8],可用于治疗糖尿病、高血脂、肝脏肿瘤等疾病[9-10]。研究[11-12]发现TFCS可降低血清UA水平,但具体机制尚不明确。本研究建立HUA大鼠模型,分析TFCS对UA合成关键酶活性及代谢相关转运蛋白表达的影响,探讨TFCS对HUA的治疗价值及安全性,以期为进一步开发抗HUA药物提供参考。
1 材料与方法
1.1 实验动物SPF级雄性SD大鼠60只,体重180~200 g,由郑州市华兴实验动物中心提供,动物合格证号:SCXK(豫)2019-0002。温度20~25 ℃,湿度50%~60%,每日照明12 h,单笼适应性饲养7 d。
1.2 主要试剂与仪器TFCS浸膏粉,由贵州中医药大学药学院实验室提取,使用紫外光分光度法(中国药典总黄酮测定方法)测量,以芦丁为对照的总黄酮的质量分数为42.86%,实验时用蒸馏水溶解配制成所需浓度,现用现配。
乙胺丁醇(批号S31547)、腺嘌呤(批号S18012)、别嘌呤醇(批号B27249)均购自上海源叶生物科技有限公司,UA、肌酐(Cr)、尿素氮(BUN)、黄嘌呤氧化酶(XOD)检测试剂盒均购自南京建成生物工程研究所,HE染色试剂购自武汉赛维尔生物科技有限公司。UA转运体1(URAT1)一抗购自Affinity公司,HRP标记的山羊抗兔二抗购自Bioworld公司。PBS购自北京索莱宝科技有限公司,BSA购自上海雅酶生物科技有限公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司,反转录试剂盒和qPCR试剂盒购自安诺伦(北京)生物科技公司,RNA提取试剂购自上海雅酶生物科技有限公司。核酸定量仪为赛默飞世尔科技公司产品,LightCycler480型qPCR仪为罗氏公司产品。
1.3 实验分组和HUA大鼠模型的建立60只SD大鼠适应性饲养7 d后,随机分成正常对照组,模型组,别嘌呤醇组和TFCS低、中、高剂量组,每组10只。除正常对照组外,其余各组给予250 mg/(kg·d)乙胺丁醇和100 mg/(kg·d)腺嘌呤的混悬液灌胃,用于构建HUA大鼠模型[7],正常对照组给予相同体积的生理盐水,14 d后检测大鼠血清UA水平,参考文献[13]的标准判断是否成功建立HUA大鼠模型。造模成功后,别嘌呤醇组给予50 mg/(kg·d)别嘌呤醇灌胃,TFCS低、中、高剂量组分别给予0.5、1.0、2.0 mg/(kg·d) TFCS灌胃,正常对照组和模型组给予等体积的生理盐水,共灌胃14 d。
1.4 大鼠一般情况观察每天观察大鼠精神状态、毛色、垫料及饮食等情况,测量并记录给药后第1、5、10、14天大鼠的体重。
1.5 大鼠血清中UA、Cr、BUN、XOD及尿液中UA水平检测末次给药后当天,收集大鼠24 h尿液,酶比色法检测UA水平。末次给药后第2天,大鼠乙醚麻醉后经心脏取血并分离血清,酶比色法检测UA水平,肌氨酸氧化酶法检测Cr水平,脲酶法检测BUN水平,双抗体夹心法测定血清XOD水平。
1.6 大鼠肾脏指标检测末次给药后第2天处死大鼠,取其左侧肾脏,一部分用40 g/L多聚甲醛固定,另一部分液氮急冻后保存于-80 ℃冰箱备用。
1.6.1肾组织形态观察 取经40 g/L多聚甲醛固定的大鼠肾脏组织,乙醇梯度脱水、二甲苯透明、浸蜡包埋、切片、HE染色、中性树胶封片,光镜下(×400)观察组织形态学改变。
1.6.2肾组织中URAT1蛋白表达的免疫组化SP法检测 取经40 g/L多聚甲醛固定的大鼠肾组织,乙醇梯度脱水、二甲苯透明、浸蜡包埋、切片、中性树胶封片,3 μm厚连续切片。血清封闭30 min后加URAT1一抗(按1∶700稀释),4 ℃孵育过夜;加HRP标记的山羊抗兔二抗,孵育50 min。阴性对照使用PBS代替一抗。DAB显色,苏木精复染。细胞核呈棕黄色为URAT1表达阳性细胞。利用Image-Pro Plus6.0图像分析系统半定量URAT1蛋白的表达[6],结果以平均积分光密度表示。
1.6.3肾组织中GLUT9 mRNA的qRT-PCR法检测 取冷冻保存的肾组织,用Trizol提取总RNA,微量紫外分光光度计测定其浓度及纯度,反转录成cDNA。使用qRCR仪进行基因扩增。GLUT9上游引物序列: 5’-GGGACTTTGGACGAGACGTT-3’,下游引物序列:5’-TGGTCGTAAACCCAGC CATC-3’,产物大小为178 bp;内参β-actin上游引物序列:5’-TGACGATATCGCTGCGCTC-3’,下游引物序列:5’-CAGTTGGTGACAATGCCGTG-3’,产物大小为178 bp。反应体系20 μL:上、下游引物均1 μL,2×NovoStart SYBR High-Sensitivy SuperMix 10 μL,模板1 μL,RNase Free Water 7 μL。反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,40个循环;最终72 ℃ 10 min中止。采用2-ΔΔCt法计算目的基因的表达,实验重复3次。
1.7 统计学处理采用SPSS 26.0分析。6组血清UA、Cr、BUN、XOD水平,尿液UA水平,以及URAT1蛋白、GLUT9 mRNA表达水平的比较采用单因素方差分析和Dunnett-t检验。检验水准α=0.05。
2 结果
2.1 6组大鼠一般情况比较6组大鼠体重变化情况见图1。给药后第1、5、10、14天,与正常对照组大鼠比较,其他各组体重降低; 给药后第10、14天,与模型组比较, TFCS中剂量组大鼠体重增加。实验过程中正常对照组大鼠精神状态良好,毛色光滑,活动自如。模型组进食较少,精神较差,毛色晦暗,排尿增多,垫料潮湿。与模型组比较,别嘌呤醇组及TFCS各剂量组大鼠的精神状态及毛色等情况好转。
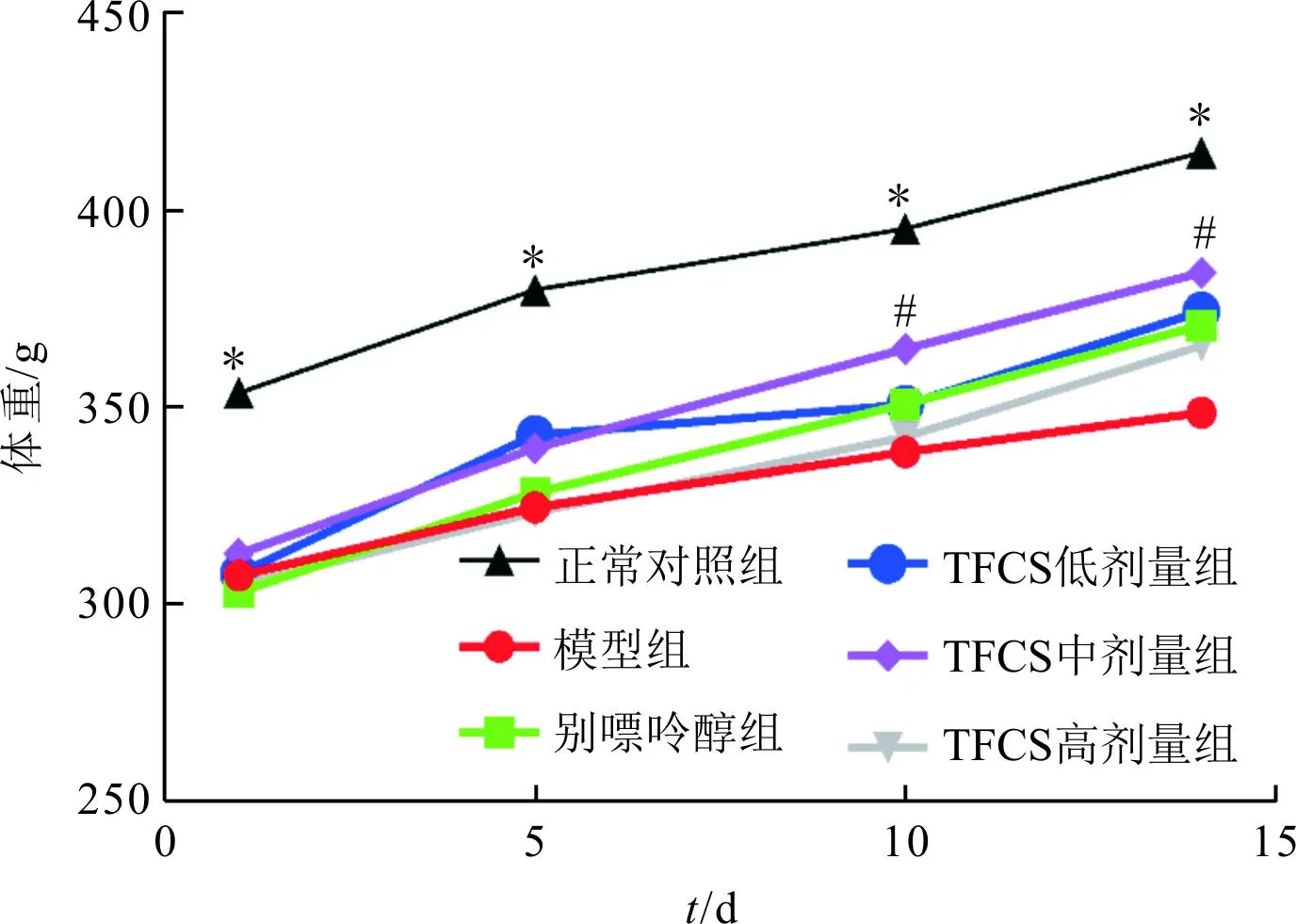
F组间=12.870,P<0.001;F时间=16.495,P<0.001;F交互=12.688,P<0.001;*:与其他组比较,P<0.05;#:与模型组比较,P<0.05。
2.2 6组大鼠UA及XOD水平比较与正常对照组比较,模型组血清UA、XOD水平升高,尿液UA水平降低;与模型组比较,别嘌呤醇组与TFCS低、中、高剂量组血清UA、XOD水平降低,尿液UA水平升高(表1)。

表1 6组大鼠血清UA、XOD和尿液UA水平比较(n=10)
2.3 6组大鼠血清Cr和BUN水平比较与正常对照组比较,模型组大鼠血清Cr及BUN水平升高;与模型组比较,别嘌呤醇组与TFCS低、中、高剂量组血清Cr及BUN水平均降低(表2)。

表2 6组大鼠血清Cr和BUN水平比较(n=10)
2.4 6组大鼠肾组织病理学变化正常对照组大鼠肾小球、肾小管结构正常,边界清晰。模型组大鼠肾小球肿胀;肾小管上皮边界不清,细胞肿胀、变性,肾间质可见炎性细胞浸润。与模型组比较,别嘌呤醇组及TFCS各剂量组大鼠肾小管上皮损伤程度减轻,TFCS高剂量组大鼠肾组织损伤最轻,其次是TFCS中剂量组和别嘌呤醇组(图2)。

A:正常对照组;B:模型组;C:别嘌呤醇组;D、E、F:分别为TFCS低、中、高剂量组。
2.5 6组大鼠肾组织URAT1蛋白和GLUT9 mRNA表达比较与正常对照组比较,模型组大鼠URAT1蛋白和GLUT9 mRNA表达升高;与模型组比较,TFCS低、中、高剂量组及别嘌呤醇组大鼠URAT1蛋白和GLUT9 mRNA表达降低(图3、表3)。

表3 6组大鼠肾组织URAT1蛋白和GLUT9 mRNA表达水平的比较(n=10)
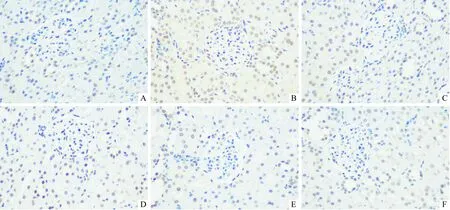
A:正常对照组;B:模型组;C:别嘌呤醇组;D、E、F:分别为TFCS低、中、高剂量组。
3 讨论
本研究利用乙胺丁醇和腺嘌呤复制HUA大鼠模型,分析TFCS对HUA大鼠的影响,结果显示,TFCS能够降低HUA大鼠的血清UA水平,促进肾脏UA排泄。此外,HUA模型大鼠肾组织发生病理变化,TFCS可以降低血清Cr及BUN水平,改善肾组织损伤,对肾功能有一定的保护作用。
HUA的病因与机体内UA的合成量增加和(或)排泄降低相关。动物和人的肝脏均能合成XOD并释放到血液中,XOD是机体内合成UA的关键酶。腺嘌呤核苷首先被转化为次黄嘌呤,XOD将次黄嘌呤氧化成黄嘌呤,继而又将黄嘌呤氧化成UA。梁圆等[14]发现抑制XOD活性能够有效降低小鼠UA水平。本研究结果显示,TFCS能够提高HUA大鼠的抗氧化能力,推测可能与抗氧化活性物质有关系。
肾脏是机体排泄UA的主要器官,肾小管上皮通过UA转运蛋白参与UA盐的代谢,对UA盐进行分泌和重吸收。UA转运蛋白是促进机体UA排泄药物的主要作用靶点[15],URAT1和GLUT9是肾小管上皮重吸收UA盐的主要运载体。有机和无机阴离子可以在肾小管上皮与管腔之间形成电化学梯度或者浓度差,URAT1利用所产生的浓度差将肾小管管腔内UA重吸收到上皮细胞,完成重吸收的第一步;同时,GLUT9对UA有高亲和力,可以将UA从肾小管管腔重吸收至上皮细胞内,也能将细胞内的UA转运到肾间质,完成重新收入血的过程[15]。谭珊等[16]研究表明,通过下调HUA小鼠肾脏URAT1的表达水平,可以有效降低UA水平,并改善HUA引起的肾损伤。本研究结果显示TFCS各剂量组的大鼠肾组织URAT1蛋白和GLUT9 mRNA表达水平降低,这与既往文献报道[12]结果一致。本研究结果亦显示,TFCS对于HUA大鼠肾功能有一定的保护作用,推测可能与其抗炎作用及促进UA排泄有关。
综上所述,TFCS可以降低XOD水平,减少UA生成;抑制肾组织URAT1蛋白和GLUT9 mRNA表达,提高肾脏的UA排泄量,有效调控血清UA水平,从而达到治疗HUA的目的。