pH敏感载体负载三氯生纳米粒对耐甲氧西林金黄葡萄球菌生物被膜的清除作用
黄菁华 林逸飞 陈相君 李文婷 郑淑娜 王长荣 李珂珂
滨州医学院药学院 山东 烟台 264003
细菌感染是疾病和死亡的重要原因之一,对全球公共卫生构成威胁[1]。细菌可以在胞外聚合物上形成生物被膜,生物被膜一旦形成后再使用常规剂量便无法达到预期的效果,这也是细菌感染疾病难以治愈的重要原因[2]。三氯生(triclosan,TCS)是广谱抗菌药物,对常见的革兰氏阳性菌及阴性菌均具有很好的疗效,但长期高剂量使用仍然无法有效穿透生物被膜,清除内部细菌[3]。因此,迫切需要开发新的载体负载TCS,用于穿透生物被膜屏障,达到治疗的目的。pH敏感型载体可以在生理环境下负载抗菌药物,在细菌感染形成的酸性环境中释放抗菌药物,使抗菌药物精准到达感染部位,提高抗菌药物穿透生物被膜的能力,进而增强生物被膜清除效果。pH敏感型载体还具有良好的药物缓释能力,能够减少抗菌药物的毒副作用和耐药性,进一步提高其疗效[4]。
本研究选用耐甲氧西林金黄葡萄球菌(methicillin-resistantstaphylococcusaureus,MRSA)感染形成的生物被膜作为研究对象,应用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)考察pH敏感的两嵌段共聚物(聚乙二醇单甲醚2000-b-聚甲基丙烯酸二丙基氨基乙酯-r-甲基丙烯酸二丁基乙酯,mPEG2k-b-Poly-DPAx-r-DBAy,PEPBx/y)清除MRSA生物被膜的能力,筛选出最优载体PEPB36/35,并采用纳米沉淀法制备PEPB36/35@TCS,考察其在不同pH环境下体内外清除MRSA生物被膜及内部细菌的能力,为治疗细菌感染疾病提供新的方法。
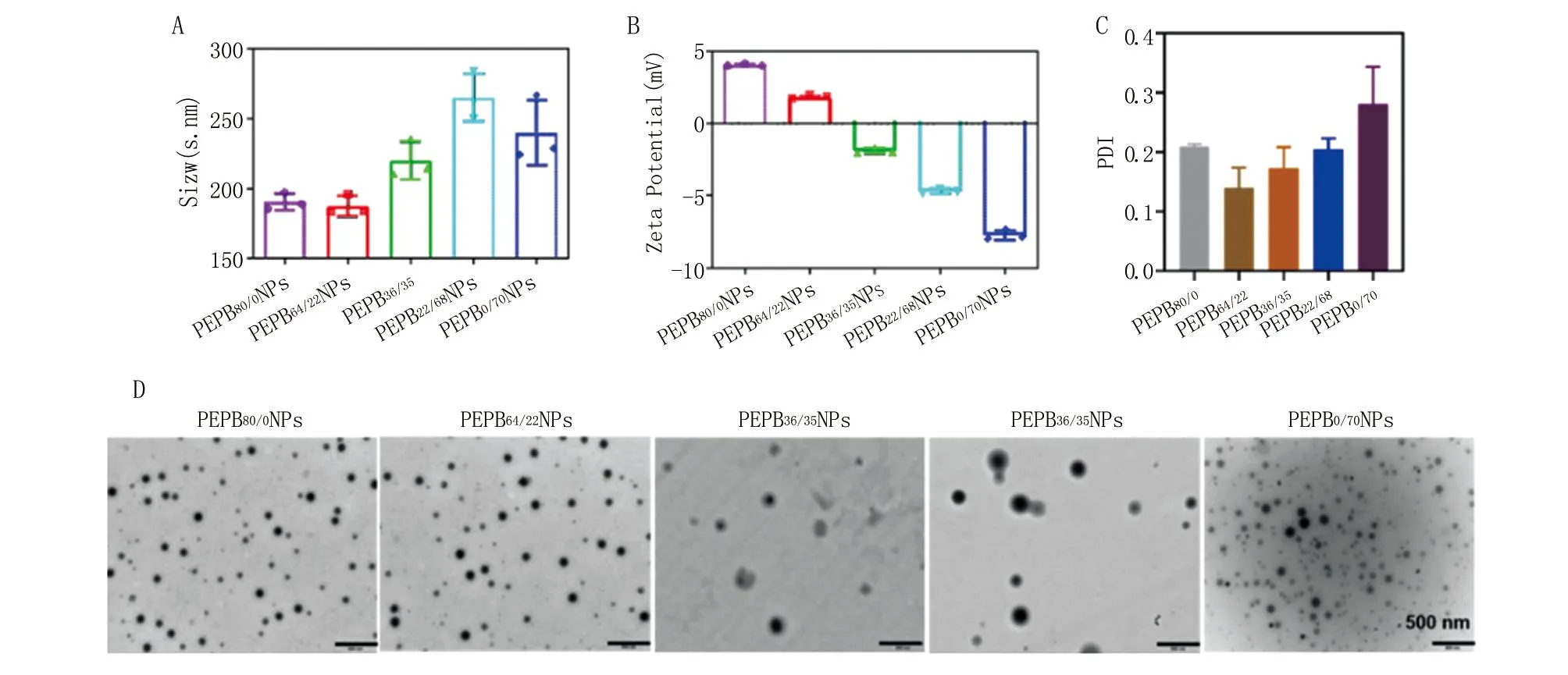
A.粒径;B.Zeta电位;C.PDI;D. TEM图。
1 材料与方法
1.1 材料
1.1.1 仪器 TU-1810紫外可见分光光度计(北京普析通用仪器有限公司);Malvern Zetasizer Nano ZS9激光粒度分析仪(英国Malvern公司);JEM-1400透射电子显微镜(日本电子株式会社);LSM 900激光共聚焦显微镜(德国蔡司有限公司);Synergy H1酶标仪(美国伯腾仪器有限公司);U-LH100HG荧光倒置显微镜(日本奥林巴斯株式会社);TDL-60B低速离心机(上海安亭科学仪器厂)。
1.1.2 药品与试剂 TCS(上海麦克林生化科技有限公司,批号为C10404798,纯度为97%);四氢呋喃(tetrahydrofuran,THF)(国药集团试剂有限公司,批号为GB20201102,分析纯);N,N-二甲基甲酰胺(n,n-dimethylformamide,DMF)(上海麦克林生化科技有限公司,批号为C14878669,纯度为99%);聚乙二醇单甲醚2000(polyethylene glycol monomethyl ether 2000,MPEG-2000)(上海麦克林生化科技有限公司,批号为C15427549,纯度为98%);偶氮二异丁腈(azobisisobutyronitrile,AIBN)(上海麦克林生化科技有限公司,批号为C15784717,纯度为98%)。
1.1.3 细菌与动物 MRSA标准菌株33591,购自美国模式培养物研究所。雌性昆明小鼠,体质量为16~20 g,购自济南朋悦实验动物繁育有限公司。
1.2 实验方法
1.2.1 细菌培养 将MRSA细菌培养至对数生长期,稀释为大约1×106CFU/mL的菌液备用,分别调整pH值至7.4和5.6。
1.2.2 筛选PEPBx/y最优载体
1.2.2.1 PEPBx/y的制备与表征 采用纳米沉淀法制备PEPBx/y纳米粒[5]。称取117 mg MPEG-2000,分别加入不同比例的nDPA-MA 和nDBA-MA置于Shelenk管中,再加入4 mL DMF使其充分溶解,抽真空后通氩气,加入1.64 mg AIBN,在70 ℃反应24 h,透析冻干,即得PEPBx/y纳米粒。考察其粒径分布、电位和外观形态。
1.2.2.2 PEPBx/y的pKa值测定 通过酸碱滴定法测定PEPBx/y的pKa值。称取40 mg PEPBx/y,加入20 mL HCl超声溶解,使其浓度为2 mg/mL,转移至烧杯中,在磁力搅拌作用下,加入0.18 g的NaOH,再滴入0.1 M的NaOH溶液,记录pH值。以消耗NaOH的体积为横坐标,pH值为纵坐标,绘制曲线作图,得到PEPBx/y的pKa值。
1.2.2.3 PEPBx/y体外清除MRSA生物被膜 应用CLSM考察PEPBx/y体外清除表达绿色荧光蛋白的MRSA生物被膜的能力[6]。在玻璃皿中加入1 mL含有绿色荧光蛋白的MRSA菌液,于37 ℃条件下培养3 d,以确保生物被膜的形成。加入1 mL PEPBx/y溶液(浓度为960 μg/mL),在37 ℃下培养12 h,弃去皿中液体,在CLSM下观察生物被膜的清除效果。
1.2.2.4 PEPBx/y生物安全性研究 应用溶血实验考察PEPBx/y的生物安全性。取5 mL兔子动脉血,加入10 mL生理盐水充分混匀,1 000 rpm离心10 min,得到压积红细胞。用生理盐水将压积红细胞稀释为2%的红细胞悬液,分别取200 μL稀释后的红细胞悬液与200 μL受试溶液混合,以蒸馏水组为阳性对照组,生理盐水组为阴性对照组,用酶标仪在波长为570 nm时测定OD值,并计算溶血率。
1.2.3 PEPB36/35@TCS的制备及其质量评价
1.2.3.1 PEPB36/35@TCS的制备 采用纳米沉淀法制备PEPB36/35@TCS载药纳米粒。称取40 mg PEPB36/35和20 mg TCS置于2 mL THF中,超声溶解,缓慢滴入20 mL蒸馏水中,搅拌挥发去除THF,离心,加入蒸馏水定容至20 mL,即得PEPB36/35@TCS载药纳米粒。考察其粒径分布、电位和外观形态。
1.2.3.2 PEPB36/35@TCS的体外释放性能考察 采用动态膜透析法考察PEPB36/35@TCS体外释放性质[7]。吸取3 mL PEPB36/35@TCS混悬液2份,分别置于透析袋中,再将其分别置于含30 mL pH值为7.4和5.6的PBS缓冲液(含0.5%吐温-80)的离心管中,于37 ℃、100 rpm条件下进行释放,在预设的时间节点上每次取出3 mL释放介质,同时补充3 mL新鲜释放介质。用紫外可见分光光度计(UV-Vis)在282 nm处测量吸光度值,以时间为横坐标,累积释放百分率为纵坐标,绘制释放曲线。
1.2.4 PEPB36/35@TCS体外清除MRSA生物被膜的研究
1.2.4.1 PEPB36/35@TCS体外清除MRSA生物被膜内部细菌 通过平板菌落计数法考察PEPB36/35@TCS体外清除MRSA生物被膜及内部细菌的能力[8]。在8孔板中每孔分别加入1 mL的MRSA菌液,在37 ℃培养3 d,待MRSA生物被膜形成之后,分别加入1 mL TCS、PEPB36/35和PEPB36/35@TCS(PEPB36/35浓度为72.5 μg/mL,TCS浓度为64 μg/mL),培养18 h。每孔加入1mL PBS缓冲液,振荡混匀,转移至离心管中,加入9 mL PBS缓冲液,稀释至1×10-1菌悬液。再吸取1 mL 1×10-1菌悬液,加入9 mL PBS缓冲液,稀释至1×10-2菌悬液,依次类比稀释至1×10-5菌悬液,吸取100 μL 1×10-5菌悬液,用涂布器均匀的涂布在固体平板表面,在37 ℃培养24 h,取出进行菌落计数。
1.2.4.2 PEPB36/35@TCS体外清除MRSA生物被膜 应用结晶紫染色法考察PEPB36/35@TCS体外清除MRSA生物被膜的能力[9]。按照“1.2.4.1”项下MRSA生物被膜与受试溶液共培养方法,用0.2%结晶紫染色液染色30 min,PBS缓冲液清洗3次,在荧光倒置显微镜下观察染色后的生物被膜。每孔加入95%乙醇,置于37 ℃摇床中洗脱1 h,用UV-Vis在595 nm下测定各孔的吸光度值。
1.2.5 PEPB36/35@TCS体内清除MRSA生物被膜的研究 通过小鼠背部创面愈合实验考察PEPB36/35@TCS体内清除MRSA生物被膜及内部细菌的能力[10]。在16只雌性昆明小鼠背部建立1.5 cm×1.5 cm 的局部伤口,滴加50 μL的MRSA菌液建立创面MRSA生物被膜感染模型。将小鼠随机分为4组,每组4只,分别滴加50 μL PBS、PEPB36/35、TCS和PEPB36/35@TCS(PEPB36/35浓度为72.5 μg/mL,TCS浓度为64 μg/mL)溶液进行治疗,每隔1 d治疗1次,测量创面面积,称量小鼠体质量,于第9 d处死小鼠,取创面处皮肤,采用平板菌落计数法,测定创面菌落数量。
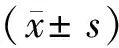
2 结果
2.1 筛选PEPBx/y纳米粒最优载体
2.1.1 PEPBx/y的药剂学性质表征 由图1可知,PEPB80/0、PEPB64/22、PEPB36/35、PEPB22/68和PEPB0/70纳米粒的粒径分别为(190.5±4.98) nm、(187.6±5.99) nm、(220.3±10.99) nm、(265.3±14.03) nm和(240.2±18.99) nm,电位分别为(3.98±0.15) mV、(1.85±0.22) mV、(-1.95±0.31) mV、(-4.73±0.33) mV和(-7.86±0.62) mV,PDI分别为(0.209±0.003)、(0.140±0.028)、(0.173±0.029)、(0.205±0.015)和(0.281±0.051)。TEM结果显示,5种PEPBx/y均形成了比较均匀的纳米球形结构。这表明,5种PEPBx/y纳米粒载体已经成功合成,可用于后续的药物递送。
2.1.2 PEPBx/y的pKa值 由图2可知,PEPB80/0、PEPB64/22、PEPB36/35、PEPB22/68和PEPB0/70的pKa值分别为6.2、6.0、5.6、5.3和5.0,随着nDBA-MA含量的增加,纳米粒的pKa值逐渐降低。PEPBx/y具有5种不同的pKa值。这表明,PEPBx/y可以在不同pH值下进行解离,释放药物,为后续清除MRSA生物被膜的研究提供了可行性。

图2 PEPBx/y酸碱滴定曲线图
2.1.3 PEPBx/y的MRSA生物被膜清除率 由图3可知,与对照组比较,PEPB80/0组、PEPB64/22组、PEPB36/35组、PEPB22/68组和PEPB0/70组在pH 值为7.4和5.6时的MRSA生物被膜清除率分别约为5%和30%,10%和20%,65%和90%,68%和90%,10%和15%。这表明,PEPB36/35和PEPB22/68在酸性环境下均具有较好的生物被膜清除效果。在酸性环境下,PEPB36/35和PEPB22/68发生了质子化改变、电荷反转,进而纳米粒解体以及烷基链暴露,可以增强其清除MRSA生物被膜的能力。
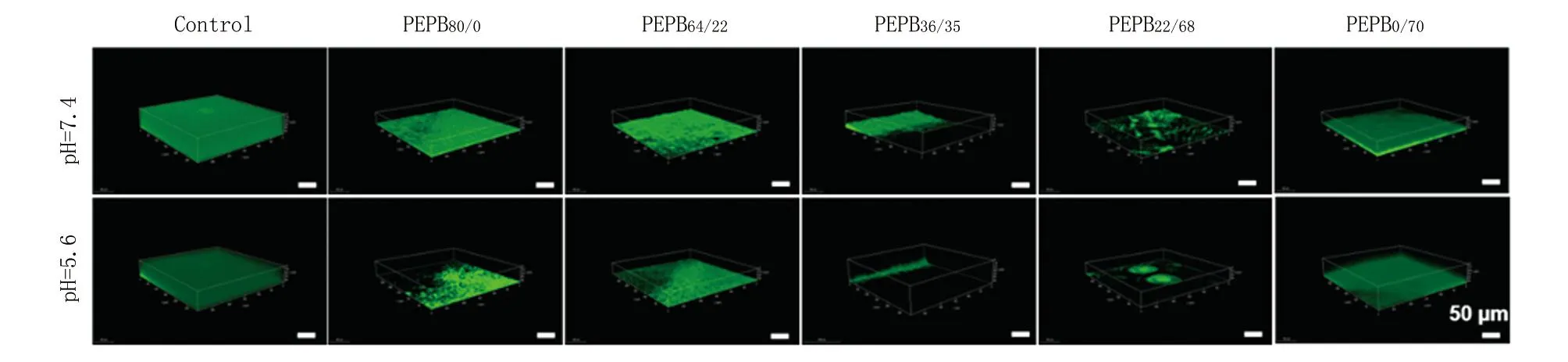
图3 PEPBx/y在不同pH环境下清除MRSA生物被膜的CLSM图像
2.1.4 PEPBx/y的生物安全性 由图4可知,当溶血率超过10%时,PEPB80/0、PEPB64/22、PEPB36/35、PEPB22/68和PEPB0/70的最低浓度分别为240、480、960、120和240 μg/mL。这表明,PEPB36/35具有最高的生物安全性。考虑到PEPB36/35也具有较好清除MRSA生物被膜的能力,故选择PEPB36/35作为TCS递送的最优载体。
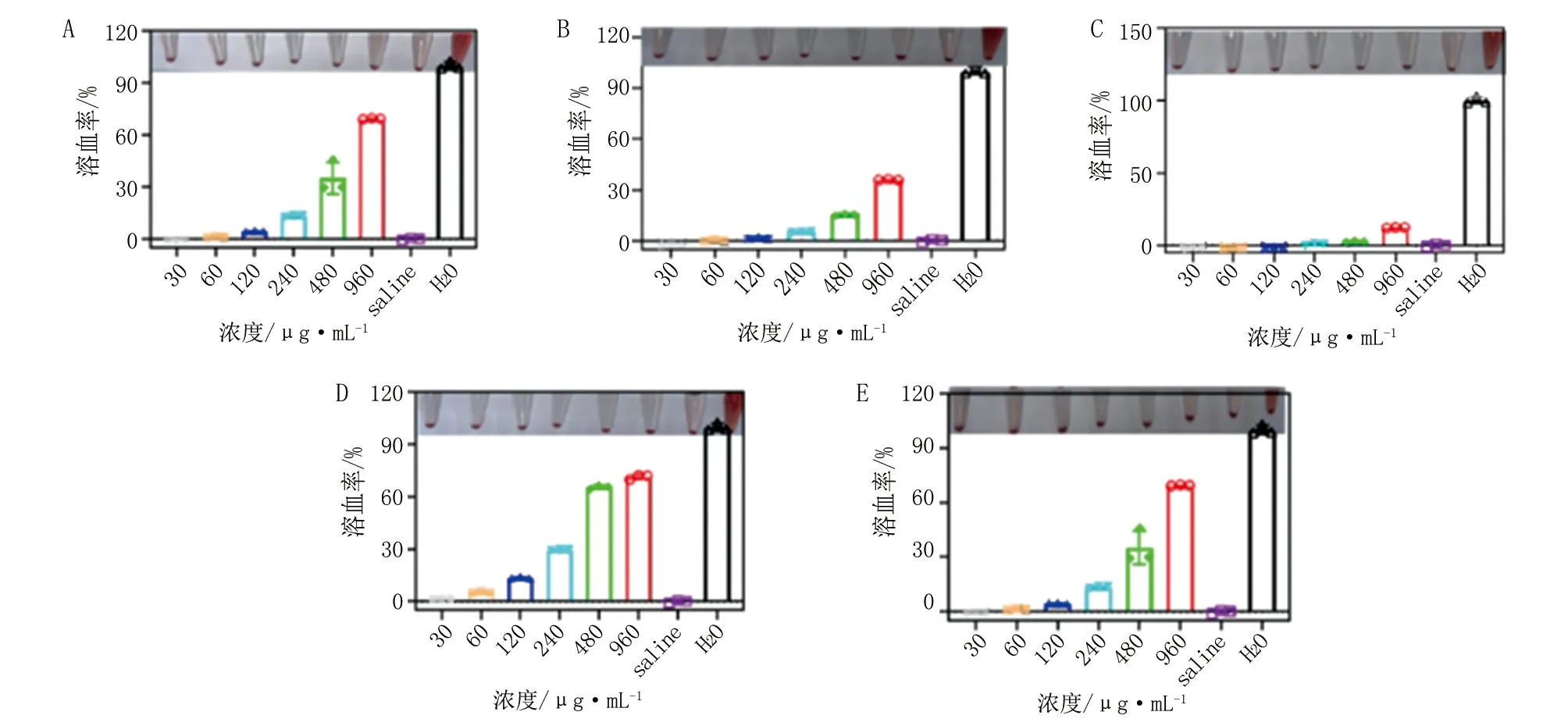
A.PEPB80/0;B.PEPB64/22;C.PEPB36/35;D.PEPB22/68;E.PEPB0/70。
2.2 PEPB36/35@TCS的质量评价
2.2.1 PEPB36/35@TCS的药剂学性质表征 由图5可知,PEPB36/35@TCS载药纳米粒的粒径为(190.6±4.05) nm,电位为(0.317±0.18) mV,PDI为(0.172±0.017)。TEM结果显示,PEPB36/35@TCS形成了均匀的纳米球形结构。这表明,PEPB36/35@TCS载药纳米粒已成功合成。
2.2.2 PEPB36/35@TCS的体外释放曲线 由图6可知,在生理环境下,PEPB36/35@TCS中TCS在72 h内累积释放率为31%。在酸性环境下,TCS在72 h的累积释放率为73%。这表明,PEPB36/35@TCS在酸性环境下发生了质子化改变,纳米粒解体,从而加速了TCS的释放。
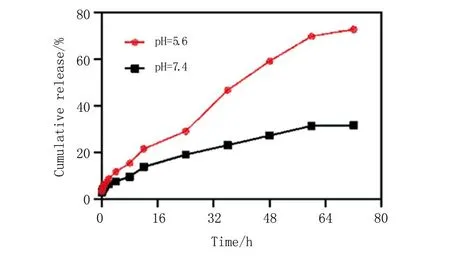
图6 PEPB36/35@TCS在不同pH环境下的释放曲线
2.3 PEPB36/35@TCS体外清除MRSA生物被膜的研究
2.3.1 PEPB36/35@TCS体外清除MRSA生物被膜内部细菌 由图7可知,与对照组比较,PEPB36/35@TCS组在生理环境和酸性环境下生物被膜内部细菌存活率均显著降低(P<0.01)。与PEPB36/35组、TCS组比较,PEPB36/35@TCS组在生理环境和酸性环境下生物被膜内部细菌存活率均降低(P<0.05)。与生理环境下的PEPB36/35@TCS组比较,酸性环境下的PEPB36/35@TCS组生物被膜内部细菌存活率降低(P<0.05)。这表明,PEPB36/35@TCS组在酸性环境下具有较好的清除MRSA生物被膜内部细菌的效果,PEPB36/35@TCS能够将TCS转运到MRSA生物被膜内部发挥清除细菌的作用。
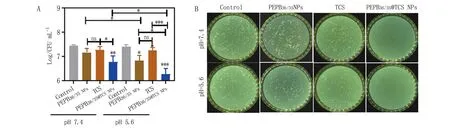
A.菌落直方图;B.平板菌落计数图。*P<0.05,**P<0.01,***P<0.001。
2.3.2 PEPB36/35@TCS体外清除MRSA生物被膜 由图8可知,与对照组比较,PEPB36/35@TCS组在生理环境和酸性环境下剩余生物被膜量均显著降低(P<0.001)。与PEPB36/35组、TCS组比较,PEPB36/35@TCS组在生理环境和酸性环境下剩余生物被膜量均显著降低(P<0.001)。与生理环境下的PEPB36/35@TCS组比较,酸性环境下的PEPB36/35@TCS组剩余生物被膜量显著降低(P<0.001)。这表明,PEPB36/35@TCS组在酸性环境下具有较好的清除MRSA生物被膜的效果。PEPB36/35可以清除MRSA生物被膜,TCS可以清除内部细菌,从而使PEPB36/35@TCS具有更好的清除生物被膜及内部细菌的能力。
2.4 PEPB36/35@TCS体内清除MRSA生物被膜的研究 由图9A~D可知,与PBS组、PEPB36/35组、TCS组比较,PEPB36/35@TCS组具有较好的促进创面愈合的作用。由图9E、F可知,与对照组比较,PEPB36/35@TCS组创面细菌存活率显著性降低(P<0.001)。与PEPB36/35组、TCS组比较,PEPB36/35@TCS组创面细菌存活率显著性降低(P<0.01)。这表明,PEPB36/35@TCS组具有较好清除MRSA生物被膜内部细菌的作用。在体内细菌感染形成生物被膜的酸性环境下,PEPB36/35@TCS具有较好的清除MRSA生物被膜及内部细菌的效果,可以发挥一定的促进感染创面愈合的作用。
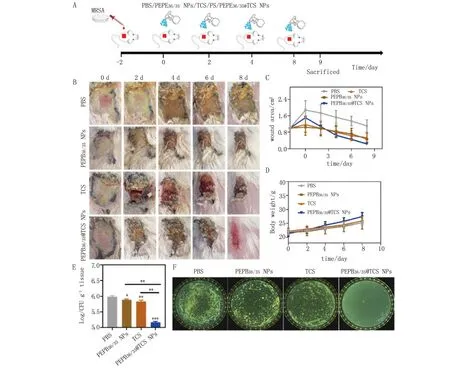
A.实验过程示意图;B.创面照片;C.创面面积变化;D.小鼠体质量变化;E.创面菌落直方图;F.创面菌落计数图。*P<0.05,**P<0.01,***P<0.001。
3 讨论
细菌生物被膜是指在细菌生长过程中黏附于生物或者非生物的表面,由细菌自身产生的胞外聚合物形成的高度组织化的三维立体结构膜样物[11]。生物被膜可起到天然物理屏障保护作用,使细菌能够逃避抗菌药物的杀灭,降低机体免疫细胞对细菌的吞噬作用[12]。因此,本研究选择MRSA生物被膜作为研究对象,通过CLSM图像、平板菌落计数法、结晶紫染色法以及小鼠背部创面感染模型法,考察清除MRSA生物被膜及内部细菌的效果。
纳米载体可以很好地递送抗菌药物,但是在药物靶向和清除生物被膜方面效果欠佳,因此需要更好的方法来解决这一问题[13]。本研究选用pH敏感型纳米载体,在生理环境下保持纳米粒的结构完整,在细菌感染形成的酸性环境下纳米粒解体,释放药物,可达到清除MRSA生物被膜和内部细菌的靶向效果。
TCS是广谱抗菌药物,但对于具有形成生物被膜能力的细菌,抑制效果甚微[14]。体外实验结果表明,在酸性环境下,PEPB36/35@TCS的生物被膜内部细菌存活率、剩余生物被膜量降低(P<0.05)。体内实验结果表明,在微生物感染形成的酸性环境下,PEPB36/35@TCS的创面愈合较快、创面细菌存活率显著降低(P<0.01)。这表明,PEPB36/35@TCS在酸性环境下发生了质子化改变、电荷反转,进而纳米粒解体以及烷基链暴露,可以增强其清除MRSA生物被膜及促进创面愈合的能力。
综上所述,PEPB36/35@TCS在酸性环境下具有较好地清除MRSA生物被膜及内部细菌的效果,可以发挥一定的促进感染创面愈合的作用。但PEPB36/35@TCS广谱抗菌应用还需要进一步研究,为抗菌药物更好的发挥临床疗效提供更有效的策略。

