替加氟-焦脱镁叶绿酸A胶束的制备
李逸龙,郭艺彬,王琛,段美涛,张志强
(厦门医学院药学系,福建 厦门 361023)
目前,应用于临床的癌症治疗方式主要有手术、化疗、放疗[1]。其中化疗药物氟尿嘧啶及其衍生物(如替加氟,TF)相对于其他化疗药物心脏毒性较小,肾毒性和骨髓抑制较弱[2]。然而,氟尿嘧啶类药物给药剂量较大,存在一定副作用。对氟尿嘧啶药物进行结构修饰可以提高其抗肿瘤活性并减少副作用,进而改善其临床应用[3-4]。
光动力疗法是一种新兴的抗肿瘤疗法,由于其非侵入性、靶向治疗特性和低毒或无毒性而备受关注[5],化疗药物与光敏剂共同负载的递药系统可实现化疗与光动力治疗联合抗肿瘤效果。光动力治疗不仅可辅助化疗,增强靶向特异性,二者协同作用还可清除残余肿瘤细胞并抑制损伤血管的再生,能够有效增强抗肿瘤效果并降低副作用[6]。但是化疗药物与光敏剂共同负载的递药系统存在一定局限性,化疗药物的突释往往导致化疗失败或副作用增强,光敏剂的突释导致光毒性和光动力治疗无效[7]。国内外研究表明通过化学键将化疗药物与光敏剂连接不仅可以提高药物半衰期以增加药效,还可实现药物缓释、按需药物释放、降低副作用等优势[8]。
焦脱镁叶绿酸A(PPA)为第二代光敏剂,常用作光动力治疗的光敏材料。相较于第一代光敏剂,其激发波长更长,组织穿透性更强,因此荧光成像效果与活性氧产生量都有所提高。将TF与焦PPA化学键合,对于PPA在增加其体内作用时间的基础上,可避免因聚集引起的荧光淬灭效果;对于TF不仅可实现通过激光照射控制药物释放,还可延长其体内循环时间,避免提前释药引起的毒副作用[9]。
两亲性聚合物自组装形成的聚合物胶束具有内部疏水和外部亲水的核-壳结构,可同时负载亲水性药物和疏水性药物,是抗肿瘤药物的良载体[10]。其中聚合物材料泊洛沙姆、DSPE-PEG等中PEG结构可增加药物递送系统在体内的稳定性并延长体内循环时间,常用来延长所负载药物的体内半衰期[11];聚乙二醇维生素E琥珀酸酯(TPGS)不仅具有两亲性结构,不但能形成胶束负载药物,还可有效抑制p糖蛋白外排作用,进而实现肿瘤多药耐药的抑制效果[12]。虽然TF相较于其他种类抗肿瘤药物副作用较弱,但是仍然具有较明显的骨髓抑制、胃肠道反应,基于化疗药物和光敏剂化学结合特点和聚合物胶束递药系统用于抗肿瘤药物递送的优势,本研究通过Eschweiler-Clarke反应、酸酐开环反应及两步酯化合成TF-PPA前药,并将其制备成胶束用于肿瘤化疗联合光动力治疗,实现降低副作用的同时增强抗肿瘤效果。目前已有化疗药物与光敏剂化学结合的相关研究,但是针对替加氟化学修饰研究较少,且尚无替加氟与光敏剂结合的其它研究,本研究为改善氟尿嘧啶类化疗药物疗效及降低其毒作用提供了有效解决手段与研究思路。
1 仪器与试药
1.1 仪器C-MAG HS7 digital加热磁力搅拌器(德国IKA集团);R-100旋转蒸发仪(瑞士BUCHI公司);LCMS-8050三重四极杆质谱仪、LC-20AP制备液相色谱仪、LC-16高效液相色谱仪(日本岛津公司);Nano ZS90激光粒度仪(英国马尔文帕纳科公司);HT7700EXALEN透射电子显微镜(日本日立公司);Infinite M1000 PRO酶标仪(瑞士帝肯公司)。
1.2 试药替加氟、丁二酸酐(SA)、甲醛、泊洛沙姆F68、聚乙二醇维生素E琥珀酸酯(TPGS)购自上海阿拉丁生化科技股份有限公司;焦脱镁叶绿酸A(PPA)购自上海源叶生物科技有限公司;CCK-8试剂、小鼠乳腺癌4T1细胞购自上海中乔新舟生物科技有限公司;其他试剂购自厦门市绿茵试剂玻仪有限公司。
2 方法
2.1 替加氟-焦脱镁叶绿酸A复合物的合成及表征通过Eschweiler-Clarke反应将TF与甲醛连接,生成含有末端-OH结构的TF-OH,再通过酯化反应,分别连接丁二酸酐(SA)和乙二醇(EG),生成末端含有-COOH的TF-SA和末端含有-OH的TF-SA-OH,最后,再通过酯化反应使TF-SA-OH与PPA连接,形成含有光敏剂PPA和化疗药物TF的TF-PPA前药。合成路径如图1所示。

图1 TF-PPA合成路线
2.1.1 TF-SA的合成精密称取TF 2.0 g,置于厚壁耐压瓶,加入甲醛溶液10 mL,于60 ℃油浴下反应12 h。反应完成后,加入甲醇旋蒸除水,每次加入50 mL直至水被完全除尽,即得羟基化替加氟衍生物TF-OH。精密称取TF-OH 5.40 g,以适量四氢呋喃(THF)溶解,精密称取丁二酸酐(SA)12.50 g,以THF溶解后滴加至TF-OH溶液中,量取三乙胺(TEA)17.50 mL,滴加至上述反应液中,于室温下搅拌反应24 h,并以薄层色谱法(TLC)监测反应进度。反应完成后,旋蒸除去溶剂,剩余物以10 mL 二氯甲烷(DCM)复溶后,以硅胶色谱柱层析分离,流动相为甲醇∶ DCM = 1∶50 (V/V),收集目标产物,合并之后旋蒸除去溶剂,得替加氟丁二酸衍生物TF-SA 3.48 g,产率37.24%。TF-SA的核磁归属如下:1H-NMR(600 MHz,DMSO-d6):12.23(s,1H,COOH),8.02(d,1H,C=CH),5.96(ddd,1H,CH),5.78(q,2H,CH2),4.27(q,1H,CH2),3.82(q,1H,CH2′),2.52(t,2H,CH2),2.46(t,2H,CH2),2.25(m,1H,CH2),2.04(m,1H,CH2′),1.93(m,2H,CH2)。
2.1.2 TF-SA-OH的合成精密称取TF-SA 400.0 mg,加入15 mL THF溶解。另取EDC·HCl 697.0 mg、DMAP 148.1 mg,以5 mL THF溶解后滴加至TF-SA溶液中,室温下活化30 min后,量取乙二醇(EG)5.0 mL,加入至反应溶液中,于30 ℃下反应24 h,TLC监测反应进度。反应完成后,旋蒸除去溶剂,以10 mL DCM复溶,以硅胶色谱柱层析分离,流动相比例为甲醇∶DCM=1∶50(V/V),合并目标产物有机相,旋蒸除去溶剂,得TF-SA-OH 298.9 mg,产率为65.93%。TF-SA-OH核磁归属如下:1H-NMR(600 MHz,DMSO-d6):8.02(d,1H,C=CH),5.95(ddd,1H,CH),5.78(q,2H,CH2),4.78(t,1H,OH),4.26(q,1H,CH2),4.01(t,2H,CH2),3.82(q,1H,CH2′),3.55(q,2H,CH2),2.57(dt,4H,CH2and CH2),2.26(m,1H,CH2),2.05(m,1H,CH2′),1.93(m,2H,CH2)。
2.1.3 替加氟-焦脱镁叶绿酸A的合成精密称取PPA 200.0 mg,以二甲基亚砜(DMSO)1.5 mL溶解,避光备用。精密称取EDC·HCl 408.8 mg,DMAP 86.9 mg,以DCM溶解后加入至PPA溶液中,室温下避光孵育30 min。精密称取TF-SA-OH 531.9 mg,以DCM溶解后加入至上述反应液,室温下避光反应24 h,以TLC监测反应进度,待反应结束后,旋蒸除去溶剂,以5 mL DCM复溶后,以硅胶色谱柱层析分离,流动相比例为甲醇∶DCM=1∶200(V/V),收集目标产物有机相,合并后旋蒸除去有机溶剂后,再以乙腈将粗产物溶解,使用制备液相进行纯化,流动相比例为乙腈∶水(97∶3),流速:15 mL·min-1,制备柱:Inspire HILIC (21.2 mm × 250 mm,5 μm),波长:271 nm和400 nm。收集含目标产物的流动相,合并后旋蒸除去乙腈,经冻干后得到TF-PPA粉末,产率15.3%。TF-PPA的核磁归属如下:1H-NMR(600 MHz,DMSO-d6)δ 9.71(d,1H,PPA),9.43(d,2H,PPA),8.89(s,1H,PPA),8.26-8.16(m,1H,PPA),7.94-7.84(m,1H,TF),6.38(d,1H,PPA),6.21(d,2H,PPA),5.75(s,1H,TF),5.75(s,1H,TF),5.52(q,2H,PPA),5.25-5.08(m,1H,TF),4.58(d,2H,TF),4.33(d,2H,TF),4.24-4.12(m,2H,PPA),3.69(d,2H,TF),3.60(s,3H,PPA),3.43(s,4H,TF),3.29(d,1H,PPA),3.21(d,3H,PPA),2.70-2.61(m,2H,PPA),2.40(d,2H,PPA),2.11(s,3H,TF),1.90(s,1H,TF),1.77(d,6H,TF),1.61(s,3H,PPA),0.23(s,2H,PPA)。
2.2 TF-PPA胶束的制备及测定
2.2.1 胶束的制备采用溶剂挥发法制备载药胶束:精密称取DSPE-PEG 10.0 mg、维生素E琥珀酸酯 5.0 mg、泊洛沙姆 F68 15.0 mg,TF-PPA 6.0 mg,溶于3 mL无水乙醇,逐滴滴加至20 mL 60 ℃的去离子水中,避光搅拌24 h,至无水乙醇完全挥发,既得TF-PPA载药胶束溶液。
2.2.2 粒径和ζ电位的测定以马尔文激光粒度仪对所制备的胶束进行粒径和ζ电位进行测定:吸取胶束溶液1 mL,以去离子水稀释至浓度为1 mg·mL-1,取稀释后的溶液1 mL,置于样品测定池内,以马尔文激光粒度仪进行扫描测定。
2.2.3 形貌学表征以透射电子显微镜对所制备的载药胶束进行成像分析,具体如下:取TF-PPA载药胶束1滴,加入磷钨酸染液适量染色15 min后,滴于铜网,自然晾干后,使用透射电镜对胶束微观形态观测并拍摄记录。
2.3 体外药效学评价
2.3.1 体外释药研究按“2.2.1”项下方法制备TF胶束,取TF胶束、TF-PPA胶束(2份),置于1 000 kDa透析袋内,并向其中加入5 mL pH值为7.4的磷酸盐缓冲液。将透析袋浸入30 mL磷酸盐缓冲液中并开始计时。为考察激光照射条件下TF-PPA胶束产生的活性氧对药物释放的影响,使用660 nm激光器对激光照射组进行照射(660 nm,150 mW·cm-2),激光器工作模式为连续模式,每次照射5 min,分别于1、12、36、60 h进行激光照射。分别于1、2、4、6、8、10、12、24、36、48、60、72 h取1 mL释放介质并补充空白释放介质,于12 000 r·min-1离心10 min后,取20 L上清液使用HPLC检测。
2.3.2 体外抗肿瘤活性研究将对数生长期的4T1细胞以胰酶消化,离心除去培养基,将细胞重悬于3 mL培养基内,取20 μL细胞悬液,以台盼蓝染色并以细胞计数器计数,计算细胞浓度。将计数后的细胞稀释至2 × 104mL-1,以每孔100 μL接种于96孔板,置于培养箱内培养12 h至细胞贴壁生长。将细胞分为空白组(含培养基,不含细胞);对照组(含细胞和培养基)和实验组(含细胞、培养基、药物),除去培养基,实验组分别加入200 μL以完全培养基稀释的TF胶束溶液、TF-PPA胶束溶液、TF-PPA胶束溶液+660 nm激光照射(30 mW·cm-2,100 s)(按照负载TF计浓度为0.015、0.15、0.75、1.5、15、75、150 g·mL-1),其他各组加入200 μL空白培养基。培养24 h后向每孔加入CCK-8试剂10 μL,继续培养4 h后以酶标仪于450 nm下测定吸光度值。并按照公式(1)计算细胞存活率。
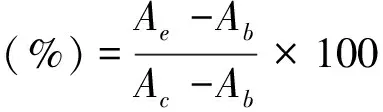
(1)
其中Ae为实验组吸光度;Ab为空白组吸光度;Ac为对照组吸光度。
3 结果与讨论
3.1 TF-PPA的合成结构确证图2为TF-PPA的1H-NMR图谱。如图2所示,芳香区同时出现了PPA的特征峰(8.89、9.43、9.71 ppm)和TF-SA-EG的特征峰(7.90 ppm),在脂肪区同时出现了PPA的特征峰(3.60、4.24ppm)和TF-SA-EG的特征峰(3.69、3.43、2.11、1.90、1.77 ppm)且其积分相对应。谱图中同时还存在PPA的特征峰 6.21 ppm和6.38 ppm以及TF的特征峰 5.75、5.25 ppm,说明TTP的成功合成。

图2 TF-PPA核磁共振氢谱图
3.2 胶束制备及测定
3.2.1 粒径和电位由于肿瘤组织部位血管形成速度较快,血管致密性和完整性较差,存在50~400 nm孔隙,当一定粒径范围内纳米粒子经过该血管部位后,会通过血管孔隙而到达肿瘤部位,并滞留在肿瘤部位,形成高渗透和长滞留(EPR)效应。所制备的胶束粒径为143.9 nm,可通过EPR效应实现药物递送系统的被动靶向效果。
所制备的纳米胶束ζ电位为-5.04 mV,为负电位,与血液电性一致,因此有利于保持胶束溶液在给药后的稳定性。
3.2.2 透射电镜如图3所示,所制备胶束粒径在100~200 nm之间,粒径较为均一,与马尔文激光粒度仪测定结果一致,该载药胶束溶液可通过EPR效应实现肿瘤部位的被动靶向效果。

图3 TF-PPA胶束透射电镜图
3.3 体外药效学
3.3.1 体外释药研究TF半衰期仅为2.6 h[13],将TF与PPA连接并负载于胶束体系后,可通过缓慢释药和酯键的断裂释放TF,延长TF的释放时间进而延长TF作用时间。TF-PPA胶束在未经激光照射的释放介质中释放较为缓慢,72 h内累积释放量为70.33%,而经激光照射后释放加速,72 h内释放82.50%。释放介质中加入了10 mmoL·L-1的H2O2(肿瘤微环境活性氧浓度约为10 mmoL·L-1),其产生的ROS促进了TF从TF-PPA的解离,使TF-PPA即使在无激光照射条件下也可较快断裂酯键进而释放TF。经激光照射后,TF-PPA自身产生一定量的ROS,具有自我促进ROS响应性释药特点,激光照射产生的ROS在前药微环境体系内促进酯键断裂,因此进一步加速了药物的释放。
3.3.2 细胞毒性试验PPA、TF-PPA可以在激光照射下产生能够促进细胞凋亡的ROS,从而可以加速激光照射下的药物释放。因此本文研究了TF-PPA胶束在激光照射和非激光照射下的细胞毒性。选择替加氟胶束作为对照品对载药胶束体外抗肿瘤能力进行评价。
如图4和表1所示,TF-PPA胶束对4T1细胞的毒性较替加氟胶束强,且为浓度依赖性,当TF浓度为150 μg·mL-1时,替加氟胶束、TF-PPA胶束、TF-PPA胶束+激光照射与4T1细胞共孵育24 h后的细胞存活率分别为31.56%±2.64%、20.74%±1.39%、2.11%±0.50%。TF-PPA可在细胞内代谢为TF、甲醛和PPA,TF和甲醛具有协同的化疗作用[14],因此增加了细胞毒性。相同给药浓度下,激光照射组TF-PPA胶束较非激光照射组胶束细胞毒性较强,说明激光照射促进ROS的产生,产生的ROS与释放的TF共同作用促进细胞凋亡,因此在激光照射下,TF-PPA可以发挥PDT和化疗的协同抗肿瘤作用,从而促进细胞凋亡。

表1 TF、TF-PPA、TF-PPA+激光照射组IC50值

图4 TF、TF-PPA、TF-PPA+激光照射组细胞存活率
4 结论
本研究合成了替加氟和光敏剂焦脱镁叶绿酸A的缀合物前药,并将其制备成载药胶束。所制备的胶束粒径为143.9 nm,可实现血管内给药后的肿瘤部位被动靶向效果,ζ电位为-5.04 mV,可保证其在血液中保持胶束结构稳定。体外释药与抗肿瘤试验结果表明,TF-PPA胶束可缓慢释药,且激光照射可促进TF的释放,在激光照射下TF-PPA可发挥光动力治疗与化疗协同抗肿瘤作用。激光照射下的TF-PPA具有以下优点:①光动力促进TF的释放;②TF-OH在细胞内的代谢产物具有协同化疗作用;③化疗和PDT协同促进细胞凋亡。
总之,TF-PPA胶束可通过缓慢释药、激光照射加速释药、被动靶向至肿瘤部位等特性效提抗肿瘤活性并降低对正常组织的副作用。本研究将为化疗药物与光敏剂的偶联以降低化疗药物毒性并增强抗肿瘤效果提供科研依据和参考。

