浅析医用妇科凝胶产品的注册概况及审评要求
闫芳 柴谦 王晓晨 王亚琳 杜文新 杜旭 张璐 山东省食品药品审评查验中心 (山东 济南 250014)
内容提要: 通过对国家药品监督管理局的境内医疗器械注册产品数据库(截至2023年9月初)进行检索,对目前已注册的456个医用妇科凝胶产品的注册概况进行介绍,梳理产品存在的问题,然后结合审评要求对产品的管理属性和管理类别、产品名称、结构组成、适用范围、产品技术要求、临床评价等内容进行分析探讨,以期为注册申请人以及技术审评人员提供思路,同时也为产品上市后的监管提供参考。
随着时代的发展,女性对于自身健康越来越重视,医用妇科凝胶产品成为医疗领域一个新的关注热点[1-3]。医用妇科凝胶产品通常是由高分子增稠成分、辅助成分、溶剂组成的凝胶剂[4]。在《医疗器械分类目录》[5](国家总局2017第104号公告)中属于“18-01-13”,是第Ⅱ类医疗器械。产品描述为“通过在阴道壁形成一层保护性凝胶膜,将阴道壁与外界细菌物理隔离,从而阻止病原微生物定植”。近年来,部分“医用妇科凝胶”被冠以“神药”,市面上多宣称可用于治疗各种妇科疾病,特别是近几年比较“火爆”的抗人乳头瘤病毒(Human Papilloma Virus,HPV)产品,往往声称具有“预防宫颈病变发生,预防治疗HPV感染,预防治疗HPV引起的皮肤病,降低物理治疗后尖锐湿疣复发率”等预防治疗作用。该类产品既有“消字号”产品,也有“械字号”产品,经查询,目前尚无针对性的国家、行业标准以及指导原则,产品的生产、研发、检验、审评乃至上市后的监管难度较大。因此,本文介绍医用妇科凝胶产品的注册概况,并梳理目前已注册产品存在的问题,然后结合审评要求针对存在的问题进行分析探讨,以期为注册申请人和技术审评人员提供思路。
1.医用妇科凝胶产品的注册概况
1.1 产业分布情况
在国家药品监督管理局网站输入“妇科凝胶”“HPV”等关键词,截至2023年9月初,共筛选出医用妇科凝胶产品456个,涉及医疗器械生产企业229余家。其中,湖南省72家,吉林省43家,江西省20家,江苏省、湖北省各11家,山东省、山西省、海南省各8家,广西壮族自治区6家,辽宁省、河南省各5家,广东省4家,四川省、福建省各3家,安徽省、黑龙江省各2家,内蒙古自治区、青海省、宁夏回族自治区、重庆市各1家。
1.2 产品注册情况
表1是按照所含成分进行分类后的产品及生产企业的分布情况,在查询到的456个产品中,按照所含成分不同将其分为以下5类:①传统妇科凝胶产品。这里所说的传统妇科凝胶产品是指组成成分在《医疗器械分类目录》中可以明确查到的,如卡波姆、明胶、低聚异麦芽糖等,这类产品不含特殊成分。目前已获批产品数量299个,占比65.6%,涉及医疗器械生产企业159家。其中以吉林省药品监督管理局审评审批产品数量最多,共165个产品,涉及医疗器械生产企业43家。②含壳聚糖成分产品。产品组分中添加壳聚糖或壳聚糖衍生物(如羧甲基壳聚糖)作为主要成分。目前已获批产品数量37个,占比8.11%,涉及医疗器械生产企业35家。从产品数量看,以湖南省药品监督管理局和江西省药品监督管理局审评审批产品数量居多,其他省份产品数量1~3个不等;从产品涉及的医疗器械生产企业看,此类产品涉及的生产企业较为分散。③含重组胶原蛋白成分产品。产品组分中添加重组胶原蛋白作为主要成分。目前已获批产品数量23个,占比5.04%,涉及医疗器械生产企业18家,产品主要集中在湖南省。④含透明质酸钠成分产品。产品组分中含有透明质酸钠。目前已获批产品数量3个,占比0.66%,涉及医疗器械生产企业3家,分别由湖南省药品监督管理局和海南省药品监督管理局审评审批。⑤抗HPV产品。该类产品成分中多添加褐藻酸盐、海藻酸钠、酸酐化牛β-乳球蛋白、生物功能蛋白、贻贝足丝蛋白、茶酸性蛋白、β-葡聚糖等作为主要成分。目前已获批产品数量94个,占比20.61%,涉及医疗器械生产企业86家,其中,以湖南省药品监督管理局审评审批产品数量最多,共69个产品,其次为广西壮族自治区和吉林省。
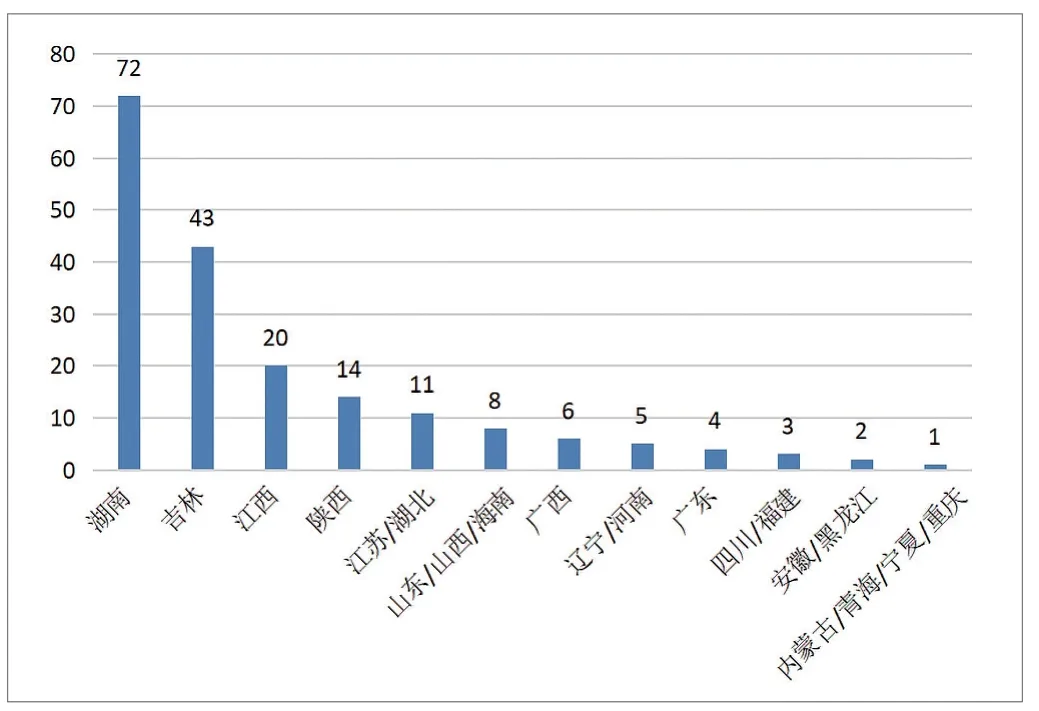
图1.生产企业分布情况(家)
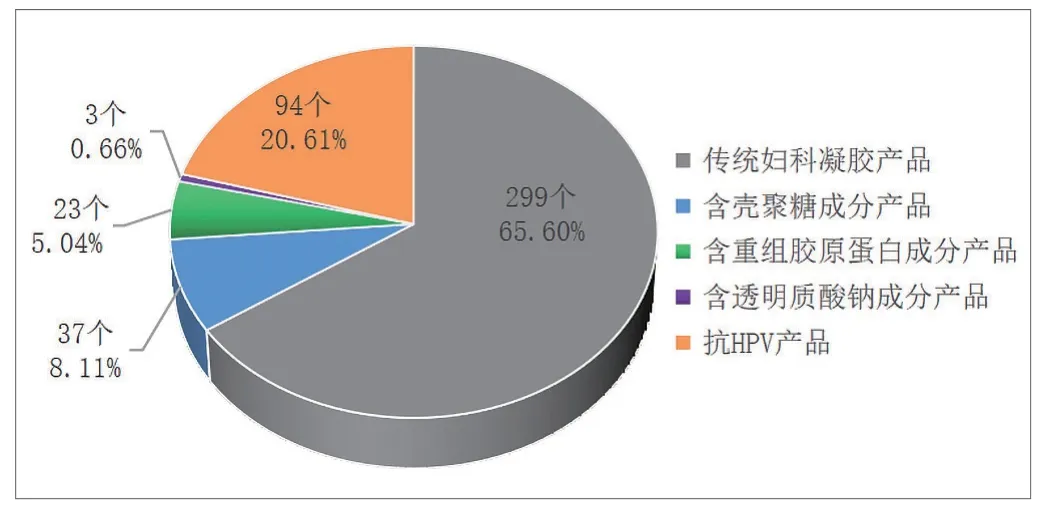
图2.各类医用妇科凝胶产品占比情况
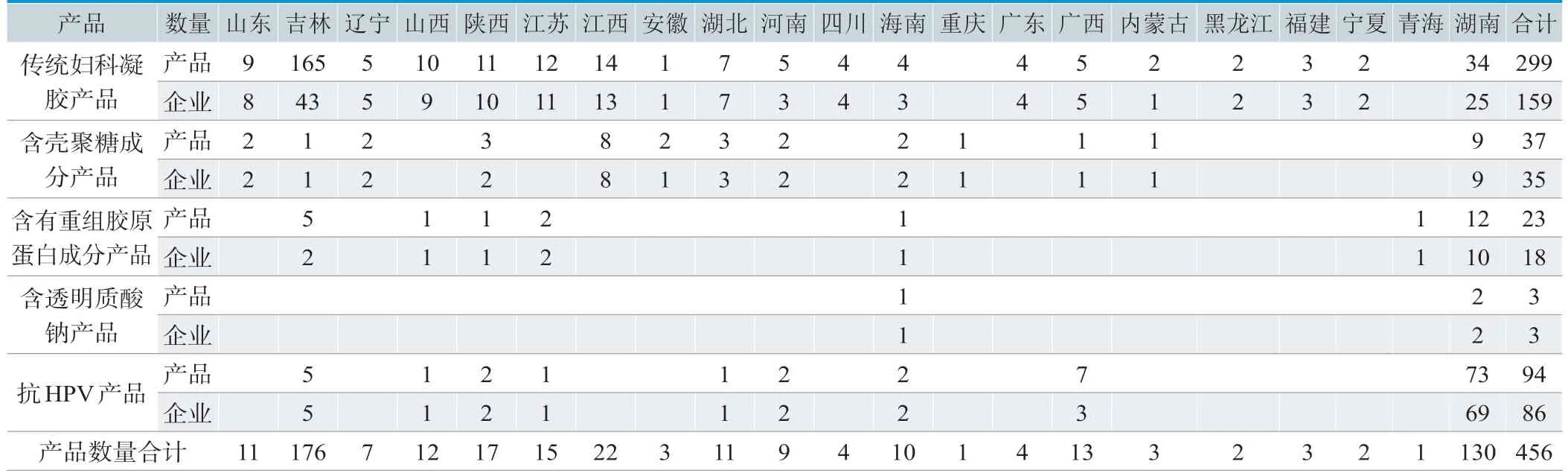
表1.产品及生产企业分布情况(n)
2.审评要求及存在问题探讨
由于缺乏具体的相关标准和注册技术审查指导原则,产品的生产、研发、检验、审评乃至上市后的监管难度较大。本文通过搜索相关公开资料,结合既往该类产品的技术审评经验,梳理了比较容易出现问题的审评关注点,主要包括产品的管理属性和管理类别、产品名称、结构组成、适用范围、产品技术要求、临床评价,尤其是产品的管理属性和管理类别、临床评价资料,是注册申报的关注重点。
2.1 产品的管理属性和管理类别
2023年8月,为规范医用妇科凝胶产品注册管理工作,引导产业健康发展,国家药品监督管理局医疗器械标准管理中心发布了《医用阴道凝胶(液、栓)类产品分类界定指导原则》(征求意见稿)[6](以下简称《界定原则》)。《界定原则》对医用阴道凝胶(液、栓)产品的管理属性和管理类别进行了明确规定,其中,产品的管理属性应当依据产品预期用途、作用机制等进行综合判定;产品的管理类别应当不低于第二类,作为医用妇科凝胶应用时,若产品仅通过在阴道壁形成一层保护性凝胶膜,将阴道壁与外界细菌物理隔离,从而阻止病原微生物定植,按照第二类医疗器械管理;若产品仅通过产品表面所带有的负电荷,与HPV的正电荷发生静电吸附,在一定程度上于细胞外阻断HPV病毒进入宿主靶细胞,仅用于降低局部HPV载量,按照第二类医疗器械管理。《界定原则》的发布解决了各省级药监部门对医用妇科凝胶产品分类界定原则不统一的问题,也为上市后产品的监督检查提供了可执行的依据。
注册申请人需要根据自身产品的预期用途和作用机制,提交相关的佐证资料。如宣称形成保护性的凝胶膜,应提供适用于申报产品的成膜性研究测试资料。如宣称通过正负电荷吸附,阻断HPV病毒进入宿主靶细胞,仅用于降低局部HPV载量,应提供试验资料证明符合宣称的工作原理。
2.2 产品名称
产品名称应符合《医疗器械通用名称命名规则》(总局令第19号)[7]的相关规定,还应参考《注输、护理和防护器械通用名称命名指导原则》[8]以及其他相关法规、规范性文件的具体要求,由一个核心词和一般不超过三个特征词组成,未发挥主要作用的成分,不应选取为核心词或特征词。
2.3 产品的结构组成
医用妇科凝胶产品所含成分涉及很多种类,通常由高分子增稠成分、辅助成分、溶剂组成。高分子增稠成分通常为卡波姆、纤维素衍生物等高分子化合物,申请人根据产品预期功能和用途不同还会添加一些辅助成分,如调节剂、保湿剂、防腐剂、助溶剂等,溶剂通常为纯化水或注射用水。
注册申请人在提交此部分资料时,应注意以下几点:①产品结构组成中应列明所有组分的名称且组分名称应规范,不可使用“凝胶基质”“等”比较含糊的词汇,不仅导致药监部门无法判断产品组分属性,也给产品上市后监管部门的监管造成很大的困扰。②产品所有成分都应不发挥药理学、免疫学或者代谢作用。申报产品如果含有药品、活性成分、植物提取物、抗菌成分,并宣称不发挥药理学、免疫学或者代谢作用,但未提供充分证明材料证明其成分未发挥药理学、免疫学或者代谢作用的,不应作为第二类医疗器械管理。③为了抑制微生物生长延长产品的保质期,大多数产品组分中都会添加防腐剂。防腐剂类型多样,目前已上市产品常添加的防腐剂有尼泊金酯类(如对羟基苯甲酸甲酯)、醇类(如苯氧乙醇)、有机酸及其盐类(如山梨酸)等[9]。加入防腐剂后是否会通过抑菌作用实现其预期用途?目前,有些省份通过要求企业提供抑菌性试验证明材料来排除相应可能,而大部分省份并无具体要求。
2.4 产品的适用范围
从获批产品的适用范围来看,各省级药监部门批准的产品适用范围的描述各有不同,大体分为以下几类:①生产企业依据《医疗器械分类目录》中的描述确定适用范围,即通过在阴道壁形成一层保护性凝胶膜,将阴道壁与外界细菌物理隔离,从而阻止病原微生物定植。②大多生产企业对适用范围进行了扩充,详细列举了产品适应症,如适用于各种病原微生物导致的宫颈炎、阴道炎,缓解白带增多,改善疼痛、血样、脓样带下症状等一系列症状。③通过保湿作用对阴道表面进行护理,提高阴道湿润度,用于缓解阴道干涩及瘙痒、灼热或阴道干燥等。④通过调节阴道pH值,达到抑制阴道有害菌生长的目的,用于辅助治疗细菌性阴道炎等疾病。⑤用于阴道创面保护,促进伤口愈合;或适用于宫颈黏膜损伤的防护。⑥用于妇女阴道润滑用。⑦抗HPV产品。此类产品的适用范围多描述为局部HPV载量。除此之外,有的产品还宣称具有“预防宫颈病变发生,预防治疗HPV感染,预防治疗HPV引起的皮肤病,降低物理治疗后尖锐湿疣复发率”等预防治疗作用。
夸大的宣传把这类产品吹嘘成了“神药”,笔者认为宽泛的适用范围不利于医用妇科凝胶产品的行业发展,有些适用范围超出了分类目录中的描述,甚至需要重新进行分类界定。尤其是抗HPV产品无可以参考的具体法规条款,各省级药监部门批准的产品适用范围不统一。临床医生存在一些担忧,因为缺少确切的临床疗效评价数据尤其是高危HPV转阴率的数据,故不宜过度宣传其预防治疗效果和高危HPV转阴率,预期用途在有充分的临床证据支撑前,宜限定为“用于降低局部人类乳头瘤病毒(HPV)载量”。
2.5 产品技术要求
目前,该类产品尚无参考的国家标准或行业标准,如何制定科学合理的性能指标和检验方法是注册工作中最大的难点。注册申请人应根据产品设计特点和实际临床需求进行制定,如外观、装量、黏度、有效成分鉴别、酸碱度、重金属、无菌或微生物限度、配合使用的附件性能等指标。此外,若产品的作用机制为通过在阴道壁形成保护性凝胶膜,将阴道壁与外界细菌物理隔离,从而阻止病原微生物定植,建议将成膜性制定在产品技术要求中,因为产品的物理隔离作用主要是由成膜性决定的。
2.6 临床评价
该类产品的临床评价门槛相对较低,只因18子目录下Ⅱ类无源产品均免于进行临床评价。注册申请人只需提交申报产品相关信息与《免于临床评价医疗器械目录》[10](2023年第33号)(以下简称《目录》)所述内容的比对资料,以及与《目录》中获准境内注册医疗器械的对比说明即可。
若无法证明申报产品与《目录》产品具有等同性,则应按照《医疗器械临床评价技术审查指导原则》[11](2021年第73号)提交临床评价资料。大部分生产企业主要是采用同品种对比路径进行临床评价,在选择对比器械时需要注意以下几点:①对比器械应为境内已上市产品;②引用的对比器械相关临床文献显示对比器械的作用机制与申报产品的作用机制应一致;③对比器械的组成成分与申报产品的组成成分应相似;④应提交对比器械与申报产品适用范围相一致的临床文献;⑤若对比器械的临床适用范围和管理类别不符合医疗器械定义或超出第二类医疗器械范畴,则不可作为申报产品临床评价的审评审批依据。
在企业提交的临床评价资料中存在的问题是基于目前已经审批的产品,大部分企业只要进行境内已上市同品种产品的对比、分析、评价,证明差异不对产品的安全有效性产生不利影响,即可免临床试验,缺少临床真实数据的收集、评估和分析。针对差异性部分,不能仅通过文献资料证明这些差异不会产生不可接受的临床使用风险,应提交充分的科学证据证明二者的差异性。以抗HPV产品为例,HPV临床上根据其致癌能力分为高危型和低危型,只有当高危型HPV持续感染,一般指感染一年以上,才有可能发展成宫颈癌前病变甚至宫颈癌[12,13]。实际上70%~80%的女性都感染过,但大部分人可以依靠自身免疫力,在6个月~1年半的时间内,人体可自动清除HPV。对于此类产品,更多要关注的是HPV病毒载量降低多少算有效?如果不采取干预措施,是否可以自动转阴?建议注册申请人即使取得医疗器械注册证,后续也要继续收集临床数据,尤其是高危HPV转阴率这一关键指标。
3.小结
随着时代的发展,女性对于自身健康越来越重视,临床需要推出更多安全、有效的产品来满足不同受众群体,同时生产企业也有经济发展的迫切需要,从而共同推动了妇科医疗器械产业的发展,而这类产品虚假宣传和夸大功效的情况时有发生,更应该关注的是临床是否有效,有效率有多少。由于缺乏相关的标准及指导原则,此类产品存在管理属性和管理类别错误、产品名称、结构组成、适用范围不规范、临床评价资料不充分等问题。
本文基于目前已注册产品的概况,梳理了产品存在的问题,然后结合审评要求针对存在的问题进行了分析探讨,以期为注册申请人和技术审评人员提供思路,同时也为产品上市后的监管提供参考。

