当归散改善克罗米芬诱导子宫内膜血管发育不良的生物机制探讨*
张楚欣,程宇立,胡红林,胡瑞瑶,高琳
(1.北京中医药大学,北京 100029;2.杭州树兰医院中医科,杭州 310015)
克罗米芬(Clomiphene Citrate)是改善女性排卵功能的一线药物,常用于治疗排卵功能障碍造成的女性不孕症。其作用效果明显,促排卵率可达70%~80%,而实际妊娠率只有30%~40%,妊娠后的流产率更是高达10%~25%[1]。各种人工辅助生殖技术给不孕不育人群带来了希望,但如此低的妊娠率同时也给患者带来焦虑与挫败感。研究表明,克罗米芬与雌激素竞争受体位点,抑制内源性雌激素作用,导致子宫内膜分泌期内膜血管发育不良,迂曲细小,循环迟缓,造成着床窗期子宫内膜容受性下降,最终导致临床妊娠率的降低[2-3]。
当归散出自《金匮要略》,由当归、芍药、川芎、白术、黄芩5 味药物组成,是经典的清热安胎方剂。其中白术、黄芩清热健脾、止血安胎,使内膜血不妄行;当归、川芎、白芍养血活血,使胞宫得养。从药物功效而言,本方可从养血活血与清热止血的角度拆分为川芎-当归-白芍(简称:芎归芍)和黄芩-白术(简称:黄芩白术)两组药物。现代研究表明[4-7],当归、川芎、白芍具有很好的激素样作用,并可促进血管的新生发育,增强血液循环。而白术、黄芩这一清热止血药对以及当归散全方对子宫内膜血管生成的影响尚不明晰。故为探究当归散安胎助孕功效的机制,明确方中药物配伍作用的差异与关联,本研究基于网络药理学和动物实验,对当归散及其拆方干预克罗米芬所造成的子宫内膜血管发育不良的有效成分、活性靶点、潜在机制进行探讨。
1 材料与方法
1.1 网络药理学
1.1.1 有效成分收集与作用靶点筛选 通过中药系统药理学数据库与分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php)[8]检索当归散(当归、白芍、川芎、白术、黄芩)有效活性成分,以口服利用度(OB)≥30%、类药性(DL)≥0.18 作为筛选标准[9],并补充文献报道中常见成分[10-14]。使用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)对其化合物名称和分子结构进行核对,再利用Swiss Target Predicition 数据库(http://www.swisstargetprediction.ch/)[15]对其活性成分进行靶点预测,以Probability≥0.1 作为筛选标准。将靶点导入UniProt 数据库(https://www.uniprot.org/)[16]进行基因名标准化,去重,获得最终靶点。
1.1.2 疾病靶点筛选 以 “recurrent spontaneous abortion”“implantation dysfunction”“angiogenesis”为检索词,利用人类基因数据库(GeneCard)数据库(http://www.genecards.org)、人类孟德尔遗传(OMIM)数据库(http://www.omim.org/)检索疾病靶点,以Relevance score≥5 作为GeneCard 数据库靶点筛选标准,使用Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html) 对上述3 个关键词检索得到的靶点取交集,得到疾病靶点,再与当归散及其拆方活性成分相应靶点取交集,分别获得当归散及其拆方治疗子宫内膜血管发育不良的作用靶点。
1.1.3 核心蛋白互作(PPI)网络的构建 将筛选得到的作用靶点以gene symbol 形式上传到String 数据库11.5(https://cn.string-db.org/),限定研究物种为“Homo sapiens”,进行核心PPI 网络分析,并运用R 软件绘制排名前10 的核心靶点Degree 值条形图。
1.1.4 “中药-成分-靶点”调控网络的构建 通过Cytoscape 3.8.0 软件构建中药-成分-靶点网络图,运用Network Analyzer 功能进行网络拓扑学分析。
1.1.5 基因本体论(GO)功能、京都基因和基因组百科全书(KEGG)通路富集分析 使用R 4.2.2 软件,借助R 包“clusterProfiler”“pathview”[17-18]等,设定P<0.05,进行GO 功能富集分析与KEGG 通路富集分析。GO 富集分析包括生物过程(BP)、细胞成分(CC)和分子功能(MF)。
1.2 动物实验
1.2.1 动物 60 只SPF 级9 周龄健康性成熟雌性未孕SD 大鼠,体质量200~220 g,购于北京维通利华实验动物技术有限公司,动物质量合格许可证号为SCXK(京)2021-0006。所有动物提前1 周购入,每笼5 只,光照节律12 h 光∶12 h 暗(6:00-18:00),相对湿度50%±5%,温度20~25℃,普通饲料饲养,自由饮水摄食。研究方案获北京中医药大学动物伦理委员会批准(批准文号:BUCM-1-2022121001-0009)。
1.2.2 试剂与药物 当归散:当归30 g,黄芩10 g,白术30 g,川芎30 g,芍药30 g(北京同仁堂药业有限公司供应,经鉴定均符合2020 年版《中国药典》相关规定),购于北京中医药大学国医堂门诊部;枸橼酸克罗米芬法地兰片(塞浦路斯高特制药有限公司,批号:F0203,《进口药品注册证》 证号:H20091079HK-24713);阿司匹林肠溶片(Bayer HealthCare Manufacturing S.r.l 公司,批号:BJ11641,《进口药品注册证》证号:H20090978);10%福尔马林溶液(益利化工有限公司,020126);磷酸盐缓冲液(PBS)粉末(索莱宝生物科技有限公司,P1010-2);兔抗酪氨酸激酶2(Tie2)抗体(Santa Cruz 公司,sc-9026);抗血管内皮生长因子A(VEGFA)抗体[VG-1]、抗血管内皮生长因子受体1(FLT1) 抗体[Y103]、抗血管内皮生长因子受体2(KDR)抗体、抗血管生成素1(Ang1)抗体、抗血管生成素2(Ang2)抗体(Abcam 公司,货号分别为ab1316、ab32152、ab39256、ab133425、ab153934);羊抗兔IgG-辣根过氧化物酶(HRP)二抗、羊抗小鼠IgG-HRP 二抗、兔抗羊IgG-HRP 二抗(Abcam 公司,货号分别为ab97051、ab6789、ab6741)。
1.2.3 仪器 PL6001-S 型电子天平(梅特勒-托利多仪器(上海)有限公司);LEICA RM2245 切片机(莱卡上海分公司);LEICA EG1150C 包埋机(莱卡上海分公司);LEICAASP300S 蜡块脱水机(莱卡上海分公司);OLYMPUS-IX71 显微镜(奥林巴斯公司)。
1.2.4 供试液制备 当归散、芎归芍、黄芩白术供试液制备:分别按2∶2∶2∶2∶1 比例称取打碎后的当归、川芎、白芍、黄芩、白术粗粉;按2∶2∶2 比例称取当归、川芎、白芍粗粉;按2∶1 比例称取黄芩、白术粗粉。分别混合,用10 倍药材剂量的冷水浸泡约20 min,加热,微微沸腾30 min,过滤药渣,药渣加8 倍量水煮沸20 min,过滤;合并两次煎煮后的药汁,室温调浓度分别为0.039、0.013、0.026 g/mL。阿司匹林溶液、克罗米芬溶液制备:分别将阿司匹林片、克罗米芬片放入研磨皿粉碎,将粉末定量转移至含有蒸馏水的烧杯,以蒸馏水清洗研磨皿和搅拌棒3 次,并合并入烧杯中,振荡器加速溶解混匀,室温调浓度分别为0.65、0.975 mg/mL。
1.2.5 动物分组、造模及给药 60 只大鼠适应性喂养1 周后,按体质量随机分为正常组、模型组、阿司匹林组、当归散组、芎归芍组和黄芩白术组,每组10 只。依据《药理实验方法学》[19]中人与大鼠体表系数法换算法折算各用药组给药剂量,克罗米芬、阿司匹林临床剂量分别依50、75 mg/60 kg 计算,则大鼠用药剂量分别为5.21、7.812 5 mg/kg;当归散、黄芩白术、芎归芍的临床剂量依3、1、2 g/60 kg 计,则大鼠用药剂量分别为0.312 5、0.104、0.208 g/kg。动情期后第1 天起,模型组及各给药组每日上午给予克罗米芬溶液灌胃,连续5 d,制造稳定的子宫内膜发育不良模型;各给药组于每日下午给予相应药液治疗,持续8 d(即动情期后第1 天至造模结束后第3 天);正常组大鼠灌胃等剂量去离子水。
为确定大鼠动情周期和排卵日,连续7 d,于每日上午7~9 时,棉签蘸取少许生理盐水获取阴道分泌物做涂片,涂片干燥后用瑞-吉氏复合染液,镜下观察细胞数量及特点。大鼠的动情周期分为排卵前期、排卵期、排卵后期、排卵间期,据《动物实验方法学》[20],排卵前期:有核上皮细胞占多数,偶有角化细胞和白细胞;排卵期:角化上皮细胞堆聚,极少数白细胞和上皮细胞;排卵后期:角化上皮细胞、白细胞及有核上皮细胞堆集,比例无明显差异;排卵间期:白细胞占多数,角化细胞和有核上皮细胞基本消失。
1.2.6 标本采集 造模结束后第4 日早晨8 时左右(着床窗期),水合氯醛麻醉大鼠后,于腹主动脉取血。室温静置2 h,1 000×g 离心15 min,分离血清,备用。取各组大鼠一侧子宫,磷酸盐缓冲液冲洗后,放入10%缓冲中性福尔马林溶液,固定48 h 后,常规方法石蜡包埋、切片(厚度4 μm)。
1.2.7 指标检测 免疫组化(SP 法) 测定VEGFA及其受体FLT1、KDR,Ang1、Ang2 及其受体Tie2 的表达,并计算子宫内膜微血管密度。
石蜡切片60 ℃烤片60 min,进行脱蜡、复水、抗原修复操作,滴加正常山羊血清封闭液,室温条件下孵育30 min;各实验组滴加一抗(Tie2 稀释浓度1∶50,Ang2、KDR 稀释浓度1∶100,VEGFA、Ang1 稀释浓度1∶200,FLT1 稀释浓度1∶250),4 ℃过夜,阴性对照组以磷酸盐缓冲液代替一抗;第2 日取出室温放置40 min,PBS 冲洗3 次,每次5 min;滴加二抗,室温条件孵育1 h;PBS 冲洗3 次,每次5 min;滴加辣根过氧化物酶标记链霉亲和素溶液,室温孵育30 min;PBS 冲洗后,滴加DAB 显色剂显色,自来水充分洗涤后复染、脱水,中性树脂封片。
每组选取10 张切片,每张切片随机取3 个不同视野,在背景一致、曝光时间等一致的情况下,于400 倍显微镜下拍照各待测指标切片,并用image-Pro Plus 软件测定棕黄色阳性表达部位的平均光密度[IOD(sum)/area(sum)];在200 倍视野下计数所有染色的微血管,取其平均值作为微血管密度。
1.2.8 统计学方法 采用SPSS 22.0 软件进行数据统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较若方差齐时选择LSD 检验,若方差不齐采用Dunnett’s T3法。P<0.05 为差异具有统计学意义。
2 结果
2.1 当归散活性成分与靶点 截至2022 年4 月,共筛选出当归散相关有效成分73 个,其中当归7 个、白芍12 个、川芎14 个、白术8 个、黄芩32 个,去重后得到当归散有效成分67 个,芎归芍有效成分30 个,黄芩白术有效成分40 个。通过SwissTargetPredicition数据库进行靶点预测,经校正和去重,最终共获得当归散药物作用靶点629 个,芎归芍靶点480 个,黄芩白术靶点441 个。见表1。
2.2 疾病靶点 通过GeneCards 数据库及OMIM数据库筛选,截至2022 年4 月,得到“recurrent spontaneous abortion”“implantation dysfunction”“angiogenesis”共同疾病靶点66 个。当归散与疾病交集靶点24 个;芎归芍与疾病交集靶点18 个;黄芩白术与疾病交集靶点21 个。芎归芍与黄芩白术重合靶点15 个。
2.3 PPI 网络分析 PPI 网络分析结果显示,当归散作用靶点PPI 网络含有24 个节点,209 条边,平均节点Degree 值为17.4。其中,Degree 值排名前5 的靶点分别为VEGFA、表皮生长因子受体(EGFR)、成纤维细胞生长因子2(FGF2)、KDR、原癌基因酪氨酸蛋白激酶(SRC)。黄芩白术作用靶点Degree 值排名前5 的分别为:SRC、信号转导和转录激活因子3(STAT3)、EGFR、KDR、丝氨酸/苏氨酸蛋白激酶1(AKT1)。芎归芍作用靶点Degree 值排名前5 的分别为:VEGFA、EGFR、FGF2、KDR、基质金属蛋白酶9(MMP9)。见图1、2。

图1 当归散核心靶点PPI 网络图Fig.1 PPI network diagram of core target of Danggui Powder

图2 当归散及其拆方核心靶点互作Degree 值Fig.2 Degree value of core target of Danggui Powder and its disassembled prescriptions in interaction
2.4 当归散“中药-成分-靶点”调控网络 将药物活性成分、核心作用靶点等导入Cytoscape 3.8.0,得到“中药-成分-靶点”调控网络图,共包括64 个节点(40 个中药成分节点、24 个核心靶点节点)及209 条边。节点Degree 越大,表明该节点在整个网络中发挥的作用越大。其中,Degree≥10 的靶点分别为环加氧酶2(PTGS2)、MMP9、诱导型一氧化氮合酶(NOS2)、基质金属蛋白酶2(MMP2)、EGFR、KDR、SRC、原癌基因酪氨酸蛋白激酶kit(KIT)、纤溶酶原(PLG)。见图3。

图3 当归散中药-成分-靶点调控网络Fig.3 Drug-component-traget network of Danggui Powder
2.5 GO 功能和KEGG 通路富集分析结果 GO 功能富集结果显示,当归散、芎归芍、黄芩白术作用靶点分别富集于1 524、1 309、1 380 个生物学过程(BP),当归散主要富集于创伤愈合(wound healing)、磷脂酰肌醇3-激酶信号(phosphatidylinositol 3-kinase signaling)、磷脂酰肌醇介导的信号途径(phosphatidylinositol-mediated signaling)、肌醇脂质介导的信号途径(inositol lipid-mediated signaling)、蛋白质自磷酸化(protein autophosphorylation);排名前5的BP 中,除共同富集于phosphatidylinositol 3-kinase signaling、phosphatidylinositol -mediated signaling、inositol lipid-mediated signaling,芎归芍富集于上皮细胞迁移的正调控(positive regulation of epithelial cell migration)、对紫外线A 的响应(response to UV-A),黄芩白术富集于protein autophosphorylation、肌细胞增殖(muscle cell proliferation)。三者分别富集于36、27、33 个细胞组分(CC),当归散富集结果主要包括膜筏(membrane raft)、膜微区(membrane microdomain)、囊泡腔(vesicle lumen)、膜小凹(caveola)、质膜筏(plasma membrane raft);排名前5 的CC中,除共同富集于membrane raft、membrane microdomain、caveola、plasma membrane raft,芎归芍富集于vesicle lumen,黄芩白术富集于黏着斑(focal adhesion)。三者分别富集于94、79、86 个分子生物学功能(MF),排名前5 的MF 均为蛋白酪氨酸激酶活性(protein tyrosine kinase activity)、跨膜受体蛋白酪氨酸激酶活性(transmembrane receptor protein tyrosine kinase activity)、跨膜受体蛋白激酶活性(transmembrane receptor protein kinase activity)、生长因子结合(growth factor binding)、血红素结合(heme binding)。软件筛选出排名前5 的生物学过程、细胞组分、分子生物学功能并绘制气泡图,泡泡节点越大则富集基因数量越多,颜色越红则富集越显著。
KEGG 通路富集分析结果显示,当归散、芎归芍、黄芩白术作用靶点分别富集于118、101、121 条通路,当归散主要富集于癌症中的蛋白聚糖(Proteoglycans in cancer)、磷脂酰肌醇3-激酶-蛋白激酶信号通路(PI3K-Akt signaling pathway)、Rap1 信号通路(Rap1 signaling pathway)、表皮生长因子受体酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)、松弛素信号通路(Relaxin signaling pathway);排名前10 的通路中,除共同富集于Proteoglycans in cancer、Relaxin signaling pathway、Rap1 signaling pathway、EGFR tyrosine kinase inhibitor resistance、糖基化终末产物-糖基化终末产物受体信号通路(AGE-RAGE signaling pathway in diabetic complications)、低氧诱导因子1 信号通路(HIF-1 signaling pathway)、流体剪切力与动脉粥样硬化(Fluid shear stress and atherosclerosis),芎归芍富集于卡波氏肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、化学致癌-受体激活(Chemical carcinogenesis - receptor activation),黄芩白术富集于PI3K-Akt signaling pathway、脂质和动脉粥样硬化(Lipid and atherosclerosis)、内分泌耐药(Endocrine resistance)。软件筛选出排名前20 的通路并绘制气泡图,泡泡节点越大则富集基因数量越多,颜色越红则富集越显著。见图4、5。

图4 GO 功能富集分析图Fig.4 GO function enrichment analysis

图5 KEGG 通路富集分析图Fig.5 KEGG pathway enrichment analysis
2.6 各组大鼠子宫内膜微血管密度 与正常组相比,模型组大鼠的子宫内膜微血管密度显著降低(P<0.01)。与模型组相比,各给药组大鼠子宫内膜微血管密度提高(P<0.05 或P<0.01)。除黄芩白术组,其他给药组宫内膜微血管密度均恢复正常水平(P>0.05)。见表2、图6。
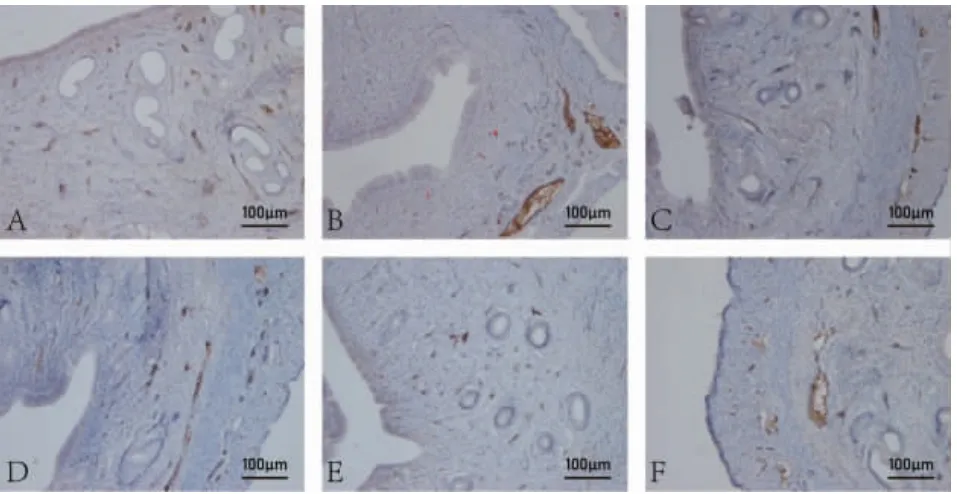
图6 大鼠子宫内膜微血管密度染色(IHC,×200)Fig.6 Endometrial microvascular density staining of rats(IHC,×200)
表2 大鼠子宫内膜微血管密度(±s)Tab.2 Endometrial microvessel density of rats(±s)
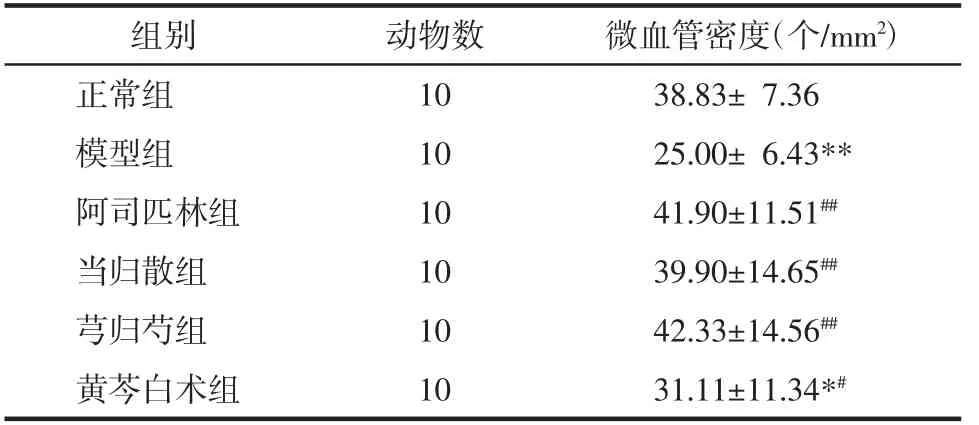
表2 大鼠子宫内膜微血管密度(±s)Tab.2 Endometrial microvessel density of rats(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 动物数 微血管密度(个/mm2)正常组 10 38.83± 7.36模型组 10 25.00± 6.43**阿司匹林组 10 41.90±11.51##当归散组 10 39.90±14.65##芎归芍组 10 42.33±14.56##黄芩白术组 10 31.11±11.34*#
2.7 各组大鼠子宫内膜VEGFA、FLT1、KDR 表达水平 VEGFA 在大鼠子宫内膜的腔上皮细胞、腺体上皮细胞,间质细胞和血管内皮细胞中均有表达,以血管内皮细胞、腔上皮、腺上皮细胞中表达明显。FLT1 主要表达于大鼠子宫内膜上皮细胞、腺体细胞以及间质细胞,在子宫内膜腔上皮表达强烈。KDR在大鼠子宫内膜腺体上皮细胞、腔上皮细胞、间质细胞均有表达,其中在腔上皮细胞的表达最为显著。见图7、8、9。

图7 大鼠子宫内膜VEGFA 免疫组化染色(IHC,×400)Fig.7 Immunohistochemical staining of VEGFA in endometrium of rats(IHC,×400)

图8 大鼠子宫内膜FLT1 免疫组化染色(IHC,×400)Fig.8 Immunohistochemical staining of FLT1 in endometrium of rats(IHC,×400)

图9 大鼠子宫内膜KDR 免疫组化染色(IHC,×400)Fig.9 Immunohistochemical staining of KDR in endometrium of rats(IHC,×400)
与正常组相比,模型组大鼠子宫内膜VEGFA、FLT1、KDR 水平显著降低(P<0.01)。与模型组相比,各用药组大鼠子宫内膜FLT1、KDR 水平均升高(P<0.05 或P<0.01),除黄芩白术组,其余各用药组大鼠子宫内膜VEGFA 水平均显著升高(P<0.01)。与阿司匹林组、黄芩白术组,当归散组、芎归芍组大鼠子宫内膜FLT1 的表达水平显著升高(P<0.01)。见表3。
表3 大鼠子宫内膜VEGFA、FLT1、KDR 表达水平(±s)Tab.3 Expression levels of VEGFA,FLT1 and KDR in endometrium of rats(±s)

表3 大鼠子宫内膜VEGFA、FLT1、KDR 表达水平(±s)Tab.3 Expression levels of VEGFA,FLT1 and KDR in endometrium of rats(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿司匹林组比较,△P<0.05,△△P<0.01;与当归散组比较,▽P<0.05,▽▽P<0.01;与芎归芍组比较,▲▲P<0.01。
KDR IOD(sum)/area(sum)正常组 10 0.058±0.027 0.058±0.017 0.060±0.021模型组 10 0.002±0.004** 0.004±0.002** 0.021±0.008**阿司匹林组 10 0.042±0.015*## 0.030±0.018**## 0.058±0.033##当归散组 10 0.035±0.018**## 0.061±0.022##△△ 0.055±0.022##芎归芍组 10 0.060±0.010##△△ 0.059±0.020##△△ 0.066±0.023##黄芩白术组 10 0.004±0.007**△△▽▽▲▲0.040±0.012**##▽▽▲▲0.041±0.015*#△▲▲组别 动物数 VEGFA IOD(sum)/area(sum)FLT1 IOD(sum)/area(sum)
2.8 各组大鼠子宫内膜Ang1、Ang2、Tie2 表达水平 Ang1 在大鼠子宫内膜间质细胞表达明显,在腺体、上皮细胞表达较弱。Ang2 在大鼠子宫内膜的腺上皮细胞、腺体细胞以及间质细胞均有表达,其中在腺上皮细胞表达最为显著。Tie2 在大鼠子宫内膜的腔上皮细胞、腺体细胞、间质细胞均有表达,在腔上皮细胞表达更为显著。见图10、11、12。

图10 大鼠子宫内膜Ang1 免疫组化染色(IHC,×400)Fig.10 Immunohistochemical staining of ANG1 in endometrium of rats(IHC,×400)

图11 大鼠子宫内膜Ang2 免疫组化染色(IHC,×400)Fig.11 Immunohistochemical staining of ANG2 in endometrium of rats(IHC,×400)

图12 大鼠子宫内膜Tie2 免疫组化染色(IHC,×400)Fig.12 Immunohistochemical staining of Tie2 in endometrium of rats(IHC,×400)
与正常组相比,模型组大鼠子宫内膜Ang1、Ang2、Tie2 水平显著降低(P<0.01)。与模型组相比,各给药组大鼠子宫内膜Ang1、Ang2、Tie2 的表达水平升高(P<0.05 或P<0.01)。与阿司匹林组、当归散组、黄芩白术组相比,芎归芍组大鼠子宫内膜Ang1升高(P<0.05)。阿司匹林组、芎归芍组大鼠子宫内膜Tie2 恢复至正常水平(P>0.05)。见表4。
表4 大鼠子宫内膜Ang1、Ang2、Tie2 表达水平(±s)Tab.4 Expression levels of Ang1,Ang2 and Tie2 in endometrium of rats(±s)

表4 大鼠子宫内膜Ang1、Ang2、Tie2 表达水平(±s)Tab.4 Expression levels of Ang1,Ang2 and Tie2 in endometrium of rats(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿司匹林组比较,△P<0.05,△△P<0.01;与当归散组比较,▽P<0.05;与芎归芍组比较,▲P<0.05。
Tie2 IOD(sum)/area(sum)正常组 10 0.048±0.015 0.081±0.019 0.067±0.018模型组 10 0.015±0.013** 0.043±0.012** 0.029±0.009**阿司匹林组 10 0.037±0.015## 0.071±0.018**# 0.058±0.012##当归散组 10 0.044±0.018## 0.094±0.016##△△ 0.052±0.010**##芎归芍组 10 0.057±0.015##△▽ 0.095±0.023##△△ 0.057±0.011##黄芩白术组 10 0.038±0.013##▲ 0.080±0.023##△△ 0.043±0.018**#△△▽▲组别 动物数Ang1 IOD(sum)/area(sum)Ang2 IOD(sum)/area(sum)
3 讨论
子宫内膜容受性的良好呈现与多种因素有关,其中,血管生成的状态被认为是衡量子宫内膜容受性的标准之一[21-22]。研究表明,克罗米芬在发挥促排卵作用的同时,会使子宫内膜微血管密度、血液灌注量出现降低趋势[2],螺旋动脉血流受阻[23],导致子宫动脉血流阻力指数(RI)明显增加[24],影响子宫内膜容受性,最终造成着床障碍及妊娠率的降低。
故本研究借助网络药理学研究方法,以“recurrent spontaneous abortion (复发性流产)”“implantation dysfunction (着床障碍)”“angiogenesis (血管生成)”3 个关键词共同描述克罗米芬造成的子宫内膜血管发育不良状态,查找疾病靶点,并与当归散及其拆方有效成分作用靶点取交集,得到当归散及其拆方干预克罗米芬所致子宫内膜血管发育不良的核心作用靶点,并进一步预测相关功能及信号通路。研究结果显示,当归散干预子宫内膜血管发育不良可能有VEGFA、EGFR、FGF2、KDR、SRC、FLT1 等关键靶点的参与,涉及创伤愈合、PI3K 信号、磷脂酰肌醇介导的信号途径等生物学功能,膜筏、膜微区、囊泡腔等细胞组分,蛋白酪氨酸激酶活性、跨膜受体蛋白酪氨酸激酶活性、跨膜受体蛋白激酶活性等分子生物学功能,以及PI3K-AKT 信号通路、Rap1 信号通路、松弛素信号通路等信号通路。芎归芍与黄芩白术两部分拆方共同靶点15 个,芎归芍特有靶点VEGFA、FGF2、凝血因子3(F3),排名前10 的通路中特有的为Kaposi sarcoma-associated herpesvirus infection、MAPK signaling pathway、Chemical carcinogenesis - receptor activation,作用集中于调节血管生成(VEGFA、FGF2)及凝血功能(F3)[25-27];黄芩白术特有靶点PLG、KIT、血小板衍生生长因子受体β(PDGFRB)、内皮型一氧化氮合酶(NOS3)、丝氨酸/苏氨酸-蛋白激酶(mTOR)、磷脂酰肌醇3 激酶催化亚基α(PIK3CA),排名前10 的通路中特有的为PI3K -Akt、Lipid and atherosclerosis、Endocrine resis tance,作用集中于信号转导(PIK3CA、MTOR、KIT)[28-30]、血管生成(NOS3、PDGFRB)[31-32]及凝血功能(PLG)[33]。从上述结果可以发现,当归散全方的预测结果是两部分拆方协同作用的综合体现,两部分拆方部分靶点重合,作用均与血管生成密切相关。而两部分拆方相比,芎归芍可能通过直接影响相关因子水平,对血管生成进行调节,而黄芩白术作用于多个信号转导的关键蛋白,可能通过调控信号转导通路的激活程度,间接影响血管生成过程。两部分拆方作用的差异与联系,既与两部分拆方中医功效的差异相应,也反映出同一方剂中各药物配伍的相互协同作用。
VEGFA 是重要的血管生成因子,与受体KDR结合,能诱导血管内皮细胞增殖、迁移及管腔样结构的形成,促进血管生成;与受体FLT1 结合,可促进血管内皮细胞之间的相互作用,提高毛细血管的通透性。在雌、孕激素等因素作用下,围着床期子宫内膜VEGF 及其受体FLT1、KDR 的局部高表达促进了内膜毛细血管新生及血管网的建立完善,利于胚胎着床及早期绒毛血管的形成,为胚胎进一步发育提供了必要条件[34-35]。
另有研究显示,Ang1、Ang2 及其共同的受体Tie2 是特异性作用于血管内皮细胞的调节因子,是子宫内膜血管生成的第2 套重要系统,在围着床窗期与VEGF 协同调节子宫内膜血管的生成。其中,Ang1与Tie2 结合可以促进新生血管的维持及稳定,Ang2与Tie2 结合则会导致内皮细胞间及内皮细胞与支持细胞间出现解离,减少血管的稳定性,但同时可使子宫内膜血管接受足够浓度雌激素、VEGF 等分子提供的出芽信号,从而促进血管重构及新生[36-37]。Ang1 和Ang2 于胚胎着床窗口期呈现高表达,参与着床期绒毛生成及胎母毛细血管网建立,促进胚胎植入以及毛细血管的新生、成熟和稳定[38]。
本研究通过对当归散及其拆方的成分靶点分析发现,当归散及拆方中所含成分均能直接或间接影响VEGF 及其受体FLT1、KDR,但并未显示出与Ang1、Ang2 及其受体间可能的相互作用。由于网络药理学本身是建立在现有研究数据基础上的分析手段,极大依赖于现有研究基础,这也使其所能提供的信息具有一定的局限性、滞后性。故本研究在网络药理学结果基础上,结合已有实验研究及相关文献报道,除选定以VEGFA 及其受体FLT1、KDR此类公认作用靶点外,另对血管内皮细胞特异性调节因子Ang1、Ang2 及其受体Tie2 进行了研究,并以微血管密度作为效应指标进行考察,通过网络药理学与动物实验相结合的方法,探究当归散对子宫内膜血管发育的影响。此外,为考察两组功效不同的拆方对子宫内膜血管发育的影响水平是否存在差异,拆方同样被纳入动物实验进行探究。
对克罗米芬的研究也发现,克罗米芬通过竞争性抑制内源性雌激素的负反馈作用,使垂体促卵泡刺激素和促黄体生成素分泌增多,从而发挥其促排卵功能。而雌激素可诱导VEGF 产生、抑制Ang1 合成,增加胚胎干细胞(ESC)的Ang2/Ang1 比例[35,39];且VEGF 及雌激素等可促进Ang2 的表达[40-41]。在本实验结果显示,动情期后连续5 d 给予大鼠5.2 mg/kg克罗米芬灌胃量,明显导致大鼠子宫内膜微血管密度,VEGFA 及其受体FLT1、KDR,Ang1、Ang2 及其受体Tie2 表达水平下降。从雌激素、VEGFA 和Ang2之间的关系推测,克罗米芬可能正是通过降低雌激素的表达,间接抑制了VEGF 及Ang2 的表达。而模型组大鼠子宫内膜Ang1 表达水平的下降则提示,克罗米芬在影响子宫内膜血管新生的同时,可能对血管的稳定性也产生干扰,这与前文所述雌激素与Ang1 的调节关系不相符,说明克罗米芬可能同时通过其他途径对Ang1 的表达造成影响,具体机制有待研究。
实验结果显示,当归散及其拆方都能在一定程度上缓解克罗米芬对子宫内膜血管生长的损害,上调子宫内膜血管生成的相关因子VEGFA、Ang1、Ang2 及其受体的表达,与网络药理学整体的预测结果相符。其中,芎-归-芍对大鼠子宫内膜血管生成的促进作用优于当归散,而黄芩-白术的作用又明显低于当归散。究其原因,当归、川芎、白芍是妇科常用的活血养血安胎药,既有很好的雌激素样作用,又能改善血液循环、促进血管发育[4-7];黄芩、白术为安胎圣药,以止血作用为主[42-43],故对血管生成的促进作用略逊一筹。不过其他研究表明,黄芩能够抗炎、抑制超促排卵后多种细胞因子的异常升高、增强淋巴细胞的增殖及吞噬细胞的功能[44-46];白术也有抗凝血、促淋巴细胞增殖、改善免疫的功能[47-49],这些都是黄芩白术促进子宫内膜血管生成因子表达的可能途径,这与网络药理学预测黄芩白术可能作用于多个信号转导关键蛋白,从多个途径发挥广泛作用的结果相一致。而当归散的作用介于黄芩白术和芎归芍之间,融合了两者的功效,既增强了黄芩白术在促进血管生成方面的作用,又抑制了芎归芍可能引起的血管异常增生、过度增殖的作用,整体作用更为平和。这对于指导临床用药具有重要意义,对于患者胎动不安的少量出血,可以增加黄芩白术的用量,达到清热安胎的效果;而对于气血亏虚者则可以适当调整芎归芍的配伍,达到养血活血的功效。
综上所述,当归散及其拆方可以不同程度地改善克罗米芬造成的大鼠子宫内膜微血管密度下降,恢复VEGFA 及其受体FLT1、KDR,Ang1、Ang2 及其受体Tie2 表达水平,提高子宫内膜的容受性。综合网络药理学及动物实验结果,芎归芍促进血管生成效果最突出;黄芩白术同样对子宫内膜血管发育有促进作用,其机制可能以间接途径为主;当归散全方则综合了两部分拆方的协同效果,整体作用更为平和,对临床用药具有一定的指导意义。本研究仅通过网络药理学及整体实验得出的初步结论,今后将深入探究当归散对围着床窗期子宫内膜血管的确切作用机制,进一步验证EGFR、SRC 等潜在靶点的作用,并结合PI3K-AKT 信号通路、Rap1 信号通路等可能参与其中的信号通路,进一步挖掘其方中配伍的协同作用及差异药效机制,以为临床应用提供更明确的实验依据。