基于术前资料的肝细胞癌微血管侵犯风险评分模型的建立
董碧菁 王莉 刘治坤
[摘要] 目的 基于肝細胞癌(hepatocellular carcinoma,HCC)患者的术前资料建立微血管侵犯(microvascular invasion,MVI)风险评分模型。方法 回顾性分析2000年1月至2021年12月于杭州市第一人民医院行肝切除术的1153例HCC患者的临床资料。采用随机抽样的方法以3∶1的比例将样本分为建模组(n=864)和验证组(n=289)。建模组采用Logistic回归分析模型探讨MVI的独立危险因素并据此建立预测模型。绘制受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)和校正曲线评价风险模型的预测能力和性能。结果 建模组患者MVI的发生率为24.1%(208/864)。多因素Logistic回归分析发现甲胎蛋白(alpha-fetoprotein,AFP)>160ng/ml、总肿瘤体积(total tumor volume,TTV)>30cm3均是患者发生MVI的独立危险因素(P<0.05)。建立的风险评分模型总分6分,0~1分为低危,2~3分为中危,4~6分为高危。该模型预测建模组患者发生MVI的曲线下面积(area under the curve,AUC)为0.714,验证组AUC为0.731。校准图显示该预测模型性能良好。结论 基于TTV和AFP建立的HCC患者MVI风险预测模型简单、易用,有利于术前选择治疗决策和医患沟通。
[关键词] 肝细胞癌;微血管侵犯;风险模型;甲胎蛋白;总肿瘤体积
[中图分类号] R735.7 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.04.010
Construction of a microvascular invasion risk scoring model for hepatocellular carcinoma based on preoperative data
DONG Bijing1, WANG Li2, LIU Zhikun2
1.Forth Clinical Medical College, Zhejiang Chinese Medical University, Hangzhou 310053, Zhejiang, China; 2.Department of Hepatobiliary Surgery, Hangzhou First Peoples Hospital, Hangzhou 311199, Zhejiang, China
[Abstract] Objective Microvascular invasion (MVI) risk scoring model was established based on the preoperative data of hepatocellular carcinoma (HCC) patients. Methods The clinical data of 1153 HCC patients who underwent hepatectomy in Hangzhou First Peoples Hospital from January 2000 to December 2021 were retrospectively analyzed. Random sampling method was used to divide the samples into modeling group (n=864) and verification group (n=289) at a ratio of 3:1. The modeling group used Logistic regression analysis model to explore the independent risk factors of MVI and established a prediction model accordingly. Receiver operating characteristic (ROC) curve and correction curve were drawn to evaluate the predictive ability and performance of the risk model. Results The incidence of MVI was 24.1% (208/864) in modeling group. Multivariate Logistic regression analysis showed that alpha-fetoprotein (AFP)>160ng/ml and total tumor volume (TTV)>30cm3 were independent risk factors for MVI (P<0.05). The total score of risk scoring model was 6 points, 0-1 was classified as low risk, 2-3 was classified as medium risk, and 4-6 was classified as high risk. The model predicted that the area under the curve (AUC) of MVI was 0.714 in modeling group and 0.731 in verification group. The calibration diagram showed that the prediction model had good performance. Conclusion The MVI risk prediction model for HCC patients based on TTV and AFP is simple and easy to use, which is conducive to preoperative treatment decision-making and doctor-patient communication.
[Key words] Hepatocellular carcinoma; Microvascular invasion; Risk model; Alpha-fetoprotein; Total tumor volume
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌之一。据统计,2020年全球约80万人死于肝癌[1]。肝切除是可切除HCC的主要根治方法,但术后5年复发率仍高达58.4%~100%[2]。研究显示,微血管侵犯(microvascular invasion,MVI)是HCC肝切除术后复发和不良生存结局的危险因素之一[2-3]。但MVI需通过病理学检查才能证实,在术前无法用于评估结局并辅助临床决策。因此,术前预测MVI对评估结局、医患沟通并共同制订医疗决策具有重要意义。既往有研究者使用术前的临床特征、实验室和影像学资料建立风险评分模型預测MVI,但并未取得突破性进展,仍存在较多争议[3-8]。本研究旨在回顾性分析接受肝切除术的HCC患者的术前临床资料,建立HCC的MVI风险评分模型,以期为术前进行预后判断提供数据支持。
1 资料与方法
1.1 研究对象
回顾性分析2000年1月至2021年12月于杭州市第一人民医院肝胆外科住院并行肝切除术的1153例HCC患者的临床资料。纳入标准:①术后病理组织学报告符合HCC病理特征[9];②年龄≥18岁。排除标准:①合并其他恶性肿瘤;②有射频消融、术前肝动脉化疗栓塞或放疗等治疗史;③切缘阳性;④病理报告证实的大血管侵犯;⑤TNM分期为Ⅵ期;⑥病历资料不完整。采用随机抽样的方法以3∶1的比例将样本分为建模组(n=864)和验证组(n=289)。本研究经杭州市第一人民医院伦理委员会批准(伦理审批号:2022-04-03L)。
1.2 数据采集
收集患者的人口学和临床及实验室检查资料,包括年龄、性别、术前CT、实验室检查、手术特征、病理学特征等。根据术前CT明确肿瘤数量并测量各肿瘤最大径计算总肿瘤体积(total tumor volume,TTV)。TTV的分类临界值参考文献[10],甲胎蛋白(alpha-fetoprotein,AFP)的分类临界值参考文献[8]。MVI诊断标准[9]:影像学或术中标本解剖均未发现肉眼血管内癌栓,但显微镜下可见血管腔内的癌细胞巢团且周边有明确的血管内皮细胞环绕。
1.3 统计学方法
采用SPSS 23.0软件对数据进行统计学分析。符合正态分布的连续变量以均数±标准差(![]() )表示,组间比较采用t检验;不符合正态分布的连续变量采用中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验;分类变量以频数(百分率)[n(%)]表示,比较采用χ2检验。采用多因素Logistic回归分析模型分析MVI的独立危险因素。根据多因素Logistic回归结果,参考Sullivan等[11]的逻辑评分法,以最小的β为基准,计算得出各影响因素的赋值分数(βx/βmin并四舍五入取整数),根据各参数的赋值分数形成预测模型。绘制受试者操作特征曲线(receiver operating characteristic curve,ROC曲线),采用曲线下面积(area under the curve,AUC)和校正曲线评价风险模型的预测能力和性能。P<0.05为差异有统计学意义。
)表示,组间比较采用t检验;不符合正态分布的连续变量采用中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验;分类变量以频数(百分率)[n(%)]表示,比较采用χ2检验。采用多因素Logistic回归分析模型分析MVI的独立危险因素。根据多因素Logistic回归结果,参考Sullivan等[11]的逻辑评分法,以最小的β为基准,计算得出各影响因素的赋值分数(βx/βmin并四舍五入取整数),根据各参数的赋值分数形成预测模型。绘制受试者操作特征曲线(receiver operating characteristic curve,ROC曲线),采用曲线下面积(area under the curve,AUC)和校正曲线评价风险模型的预测能力和性能。P<0.05为差异有统计学意义。
2 结果
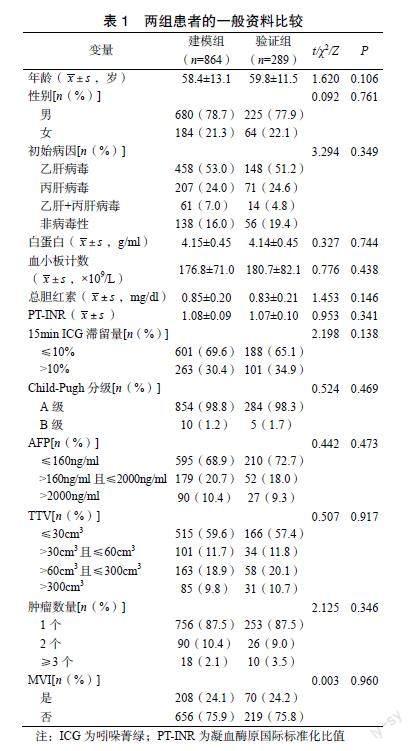
2.1 两组患者的一般资料比较
两组患者的一般资料比较差异均无统计学意义(P>0.05),见表1。
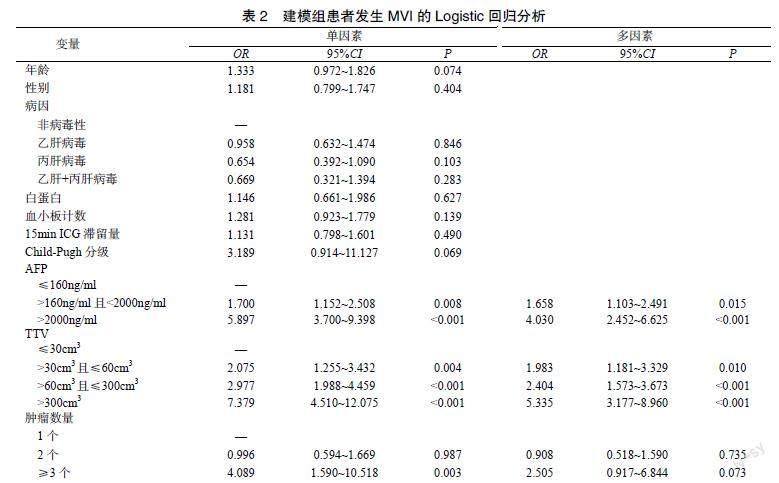
2.2 建模组患者发生MVI的危险因素
单因素分析结果显示高AFP(>160ng/mL)、高TTV(>30cm3)和多发性肿瘤(≥3个)均是患者发生MVI的可疑风险因素(P<0.05)。多因素Logistic回归分析发现,AFP>160ng/ml、TTV>30cm3均是患者发生MVI的独立危险因素(P<0.05),见表2。
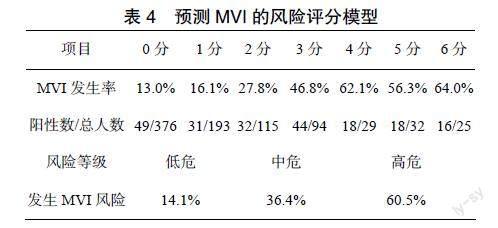
2.3 MVI风险评分模型的构建
根据多因素Logistic回归分析结果,以最小的β为基准,得出各参数的赋分,见表3。模型总分6分,在0~6分的每个评分中,MVI的发生率分别为13.0%、16.1%、27.8%、46.8%、62.1%、56.3%和64.0%。按照MVI的发生风险,模型评分0~1分为低危,2~3分为中危,4~6分为高危,见表4。
2.4 MVI风险评分模型的验证
使用建立的模型预测建模组和验证组患者的MVI并绘制ROC曲线,建模组AUC为0.714,验证组AUC为0.731,说明模型具有较高的识别率,见图1。校准图显示预测模型性能良好,平均绝对误差较低,为0.023。该模型在中危的情况下,可略低估发生率,见图2。
3 讨论
MVI是HCC行肝切除术后复发公认的风险因素。但诊断MVI的金标准仍是手术切除后的组织病理学检查。术前准确预测MVI对临床决策和医患沟通具有重要价值。本研究结果发现TTV和AFP水平是MVI的独立预测因子,可用于构建有效的MVI发生风险评分模型。
既往研究证实肿瘤直径与MVI的发生率呈正相关[7]。肿瘤体积越大,肿瘤血管直径越大,肿瘤供血越豐富。充足的供血可提供足够的营养以供肿瘤生长,并改变免疫微环境,加速肿瘤的恶性进程,是实体肿瘤生长和转移的病理基础和必要条件[12]。但既往研究或选择单个肿瘤的病例,或以多个肿瘤中最大肿瘤直径作为考察指标,忽略多发性肿瘤对结局的影响[5,13]。另外,肿瘤一般为形状不规则病灶,相同直径的肿瘤在体积上可能差异很大[14]。TTV是肿瘤大小和肿瘤数量的组合,可更全面地反映肿瘤负荷,是肝切除或肝移植后HCC复发的强预后因素[3]。本研究依据既往研究结果[8,10]对TTV进行半定量分类,既方便临床操作,又减少因二分类变量造成的信息损失。AFP是广泛使用的肝癌标志物之一。高水平AFP提示肝癌恶性程度高及侵袭性强。肿瘤的侵袭性越强,发生MVI的概率越大[4]。有研究认为AFP>400ng/ml可独立预测MVI[15]。Zhang等[6]报道HCC患者血清AFP≥232.3ng/ml是MVI的危险因素。本研究发现随着AFP水平的升高,MVI风险亦逐渐上升。在HCC患者中,AFP水平与肿瘤负荷有关,AFP的变化可反映肿瘤负荷的变化[16]。因此肿瘤体积和AFP联合应用理论上可提高MVI的预测效能[17]。本研究建立的模型预测HCC患者发生MVI的AUC>0.71,具有较好的预测价值。校准图结果显示该模型的预测性能良好,绝对误差较低。
术前预测MVI可优化HCC的治疗方案。刘驰等[18]发现MVI阳性同时切缘较窄增加HCC肝切除术后复发的风险,针对MVI患者应选择中宽切缘。对MVI高危患者,肝移植应优于肝切除术,以清除可能的肝内微转移[19]。MVI风险可纳入肝移植的扩展标准,用于术前评价肝移植的获益和风险。
本研究为回顾性研究,部分肿瘤较小的低风险患者因肿瘤大小数据缺失而未能纳入研究,这可能带来选择偏倚。另外,本研究只对风险评分模型进行内部验证,该模型尚需要外部验证来检验其对不同人群的适用性。
综上,基于TTV和AFP建立的HCC患者术前预测MVI风险模型具有简单、易用的特点,有利于术前选择治疗决策和医患沟通。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209–249.
[2] 韦滔, 吴飞翔, 黎乐群, 等. 肝细胞癌术后预防复发的研究进展[J]. 中华肝胆外科杂志, 2021, 27(4): 316–320.
[3] HONG S B, CHOI S H, KIM S Y, et al. MRI features for predicting microvascular invasion of hepatocellular carcinoma: A systematic review and Meta-analysis[J]. Liver Cancer, 2021, 10(2): 94–106.
[4] MA L D, DENG K, ZHANG C, et al. Nomograms for predicting hepatocellular carcinoma recurrence and overall postoperative patient survival[J]. Front Oncol, 2022, 12(5): 843589.
[5] PARK S G, KIM J H, KIN J, et al. Development of a deep learning-based auto-segmentation algorithm for hepatocellular carcinoma (HCC) and application to predict microvascular invasion of HCC using CT texture analysis: Preliminary results[J]. Acta Radiol, 2022, 23(12): 1505–1518.
[6] ZHANG W, LIU L J, WANG P, et, al. Preoperative computed tomography and serum α-fetoprotein to predict microvascular invasion in hepatocellular carcinoma[J]. Medicine (Baltimore), 2018, 97(27): e11402.
[7] YANG J R, ZHU S G, YONG J J, et al. A nomogram for preoperative estimation of microvascular invasion risk in hepatocellular carcinoma: Single-center analyses with internal validation[J]. Front Oncol, 2021, 11(5): 616976.
[8] LIN S T, YE F, RONG W Q, et al. Nomogram to assist in surgical plan for hepatocellular carcinoma: A prediction model for microvascular invasion[J]. J Gastrointest Surg, 2019, 23(12): 2372–2382.
[9] 張小晶, 王琳. 微血管侵犯在肝癌综合诊断与治疗中的临床意义[J]. 中华消化外科杂志, 2019, 18(4): 336–341.
[10] LI M X, ZHAO H, BI X Y, et al. Total tumor volume predicts survival following liver resection in patients with hepatocellular carcinoma[J]. Tumour Biol, 2016, 37(7): 9301–9310.
[11] SULLIVAN L M, MASSARO J M, AGOSTINO R B. Presentation of multivariate data for clinical use: The framingham study risk score functions[J]. Stat Med, 2004, 23(10): 1631–1660.
[12] 金赟, 李江涛. 肝癌细胞侵犯微血管的临床相关因素及分子标志物的研究进展[J]. 临床肝胆病杂志, 2013, 29(7): 550–553.
[13] ZHANG L N, CHEN J B, JIANG H, et al. MR elastography as a biomarker for prediction of early and late recurrence in HBV-related hepatocellular carcinoma patients before hepatectomy[J]. Eur J Radiol, 2022, 152(3): 110340.
[14] XU C C, JIANG D, TAN B B, et al. Preoperative diagnosis and prediction of microvascular invasion in hepatocellularcarcinoma by ultrasound elastography[J]. BMC Med Imaging, 2022, 22(1): 88.
[15] 刘连凤, 刘军杰, 罗涛, 等. 术前超声联合血清甲胎蛋白水平预测肝癌微血管侵犯的价值[J]. 广西医科大学学报, 2018, 35(9): 1260–1263.
[16] JIANG H Y, WEI J W, FU F F, et al. Predicting microvascular invasion in hepatocellular carcinoma: A dual-institution study on gadoxetate disodium-enhanced MRI[J]. Liver Int, 2022, 42(5): 1158–1172.
[17] AI A Y, ROUANET E, HENDRIX R J, et al. Segmental distribution of hepatocellular carcinoma correlates with microvascular invasion in liver explants undergoing transplantation[J]. J Cancer Epidemiol, 2019, 25(5): 8534372.
[18] 劉驰, 杨启, 秦长岭. 微血管侵犯对早期肝癌肝切除术切缘选择及患者预后的影响[J]. 肝胆外科杂志, 2017, 25(5): 353–357.
[19] HU S Y, GAN W, QIAO L, et al. A new prognostic algorithm predicting HCC recurrence in patients with barcelona clinic liver cancer stage B who received PA-TACE[J]. Front Oncol, 2021, 11(2): 239–248.
(收稿日期:2023–02–14)
(修回日期:2024–01–06)

