基于生物信息学与分子对接技术探讨苦参通过调节免疫相关基因治疗溃疡性结肠炎的分子机制
赵香妍,罗卫华,姚海涛,闫晓媛,王雅丽,刘宇博
(北京市和平里医院药剂科,北京 100013)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病中的一种慢性长期疾病,发病机制尚不明确,主要症状为腹痛、腹泻甚至血便等,长期的慢性炎症状态显著增加了患者结直肠癌的发病风险[1]。再过去的数十年中,虽然UC的死亡率较低,但在欧美发达国家的发病率和患病率仍然很高,在发展中国家也呈迅速升高趋势。目前研究发现,UC与肠道黏膜屏障的损伤有关,肠道菌群紊乱、免疫功能失调及炎症细胞浸润肠道黏膜层可能是引起严重炎症反应的原因[2]。虽然如5-氨基水杨酸、皮质类固醇、免疫抑制剂和生物制剂等被广泛应用于临床治疗UC,但这些药物有限的治疗效果、较高的不良反应发生率以及较高的治疗费用等问题仍亟待解决[3-4]。
基于传统中医药理论而应用的天然药物,因其多成分、多靶点以及成本低廉等优势,是目前治疗UC的潜在药物。传统中医理论认为,UC证属湿热蕴肠证[5]。而中药苦参作为经典清热燥湿的药物,具有抗菌[6]、抗炎[7]和免疫调节[8]等药理作用。目前已有报道,苦参对于UC具有潜在的药物治疗效果[9]。但其作用机制尚待阐明。本研究通过生物信息学和分子对接的方法,全面系统地探讨了苦参通过调节免疫相关基因(IRGs)治疗UC的作用机制,为后续UC治疗药物的开发提供更多理论支撑,进一步开拓了传统中药的新视野。
1 资料与方法
1.1 苦参的化学成分及作用靶点筛选
采用中药系统药理学数据库和分析平台(https://www.tcmsp-e.com)[10]检索苦参。根据口服利用度(OB)≥50%、类药性(DL)≥0.18和肠上皮通透性(Caco-2)>-0.4为阈值,初步筛选苦参中活性化合物及相关作用靶点。此外,对已发表文献进行检索,对数据库未收录的活性成分进行补充合并。使用Cytoscape 3.9.1[11]软件将苦参-成分-靶点网络图可视化。
1.2 UC相关差异基因分析
使用“ulcerative colitis”为检索关键词,在基因表达综合数据库(GEO)[12]中下载UC相关临床试验数据集(GSE206285)[13],其中18例健康成年人作为对照组,18例诊断UC的成年患者、使用安慰剂治疗作为UC组。利用R语言对芯片原始数据进行二次分析,利用RMA算法进行背景校正和矩阵数据归一化处理。并以P<0.05,|logFC|≥1为条件对差异表达基因(DEGs)进行筛选,最终确定UC的DEGs。
1.3 苦参调节IRGs治疗UC核心靶点网络构建及功能模块识别
在免疫基因集数据库(https://www.immport.org)[14]中获取IRGs,并与苦参作用靶点和UC相关DEGs取交集,绘制交集靶点韦恩图。将交集靶点数据导入至STRING数据平台(https://string-db.org)[15]进行分析处理,隐藏无联系节点,得到蛋白质-蛋白质相互作用(PPI)网络图,将数据导入Cytoscape软件对PPI网络进行可视化。分别使用软件内置插件MCODE和cytohubba,对上述获得的PPI网络进行功能模块识别。通过MCODE插件识别出核心靶点聚类模块。进一步使用cytohubba插件计算拓扑参数,包括MCC、EPC、Betweenness和Closeness进行筛选,确定交集的hub基因。合并结果后,选择P<0.05,|logFC|≥1的靶点认定为苦参通过调节IRGs治疗UC的核心靶点。
1.4 京都基因与基因组百科全书(KEGG)通路富集分析和基因本体(GO)功能富集分析
通过Metascape数据库(http://metascape.org)[16]对苦参和UC共同作用得到的交集靶点进行KEGG通路富集分析和GO功能富集分析。以P<0.05为阈值,将其按Pvalue升序进行排序。分别使用R语言绘制通路富集气泡图和功能富集柱状图进行可视化。
1.5 苦参成分与核心靶点分子对接验证
从PubChem数据库[17]获取苦参活性成分的化学结构,并从PDB数据库下载核心靶点蛋白结构,利用CB-dock2(https://cadd.labshare.cn/cb-dock2)工具[18],计算分子中心和大小,根据查询的配体匹配对接盒,并计算结合能评分,其中结合能表示为负数,数值越小表示结合能力越强,结合越稳定。以此对苦参成分与核心靶点的结合能力进行分子对接验证。
2 结果
2.1 苦参活性成分及作用靶点获取
获取苦参所包含化学成分113个,通过OB≥50%、DL≥0.18和Caco-2>-0.4为阈值筛选后最终获得苦参相关活性成分槲皮素、木犀草素、刺芒柄花素、8-异戊烯基-山柰酚、菜豆素和怀特酮等23个。获取苦参活性成分相关靶点合计201个。苦参-成分-靶点网络图见图1。
2.2 苦参活性成分及作用靶点分析
通过GEO芯片分析,UC患者组与健康组对比,发现13 843个DEGs,通过设置|logFC|≥1的阈值进行筛选后,确定其中上调DEGs 1 199个,下调DEGs 905个,相关火山图见图2。

图2 UC差异表达基因火山图
2.3 苦参调节IRGs分析
通过数据库共获取IRGs靶点1 793个,分别与苦参相关靶点、UC疾病上调和下调DEGs取交集后绘制韦恩图,确定苦参通过调节IRGs治疗UC的潜在靶点共计68个(调节上调基因46个,调节下调基因22个),见图3。

图3 UC苦参-UC差异表达基因-免疫相关靶点韦恩图
2.4 PPI网络构建及核心靶点预测
通过STRING数据库分析潜在靶点,获得扩展的PPI网络数据,通过Cytoscape软件内置插件进行MCODE聚类分析,获得3种模块,数据可视化见图4。进一步应用Cytohubba插件分别筛选MCC、EPC、Betweenness和Closeness前20位的靶点基因,通过绘制韦恩图共确定12个hub基因(见图5),进一步筛选出P<0.05,|logFC|≥1的靶点认定基质金属蛋白酶(MMP)9、白细胞介素(IL)1β、CXC趋化因子配体8(CXCL8)、过氧化物酶体增生激活受体γ(PPARG)、前列腺素内过氧化物合成酶2(PTGS2)和IL-6为苦参通过调节IRGs治疗UC的核心靶点。

图4 MCODE模块聚类图

图5 hub基因韦恩图
2.5 KEGG和GO富集分析
KEGG富集分析结果见图6。苦参通过调节IRGs治疗UC的相关靶点主要富集于癌症相关通路、脂质与动脉粥样硬化通路、晚期糖基化终末产物(AGE)-AGE受体(RAGE)信号通路、IL-17信号通路以及肿瘤坏死因子信号通路。GO富集分析结果见图7。其中,苦参涉及UC相关靶点的生物过程主要涉及对激素的反应、细胞对脂质的反应、炎症反应以及对细胞或生物体运动的正向调节等;细胞组成主要定位于细胞膜筏、细胞膜微结构域和受体复合物等;主要影响的分子功能包括信号受体调节和激活活性、受体的配体活性和细胞因子受体结合等。
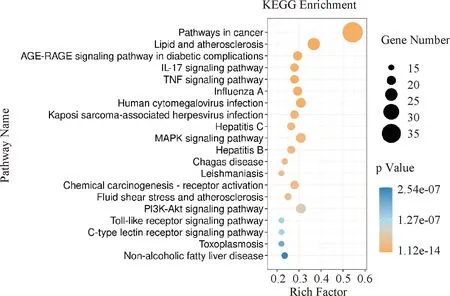
图6 KEGG通路富集分析

图7 GO功能富集分析
2.6 分子对接
根据苦参-成分-靶点分析的结果,获取Degree值居前10位的化合物结构,分别为槲皮素、木犀草素、刺芒柄花素、8-异戊烯基-山柰酚、菜豆素、怀特酮、大豆抗毒素、高丽槐素、苦参素和苦参碱,分别将之与6个核心靶点进行分子对接。全部分子对接结合能评分图见图8(A)。其中结合能评分较低的受体配体:MMP9与怀特酮,结合能为-42.7 kJ/mol;PPARG与菜豆素,结合能为-41.9 kJ/mol;MMP9与木犀草素、PTGS2与木犀草素、PTGS2与菜豆素、PTGS2与大豆抗毒素的结合能均为-40.6 kJ/mol。图8(B)—图8(O)为结合能较低的14组分子对接结果。

A.分子对接结合能评分;B.MMP9与怀特酮;C.PPARG与菜豆素;D.MMP9与木犀草素;E.PTGS2与木犀草素;F.PTGS2与菜豆素;G.PTGS2与大豆抗毒素;H.MMP9与槲皮素;I.PPARG与大豆抗毒素;J.PTGS2与槲皮素;K.PTGS2与怀特酮;L.PPARG与高丽槐素;M.MMP9与刺芒柄花素;N.PTGS2与8-异戊烯基-山柰酚;O.PTGS2与高丽槐素。
3 讨论
UC作为慢性自身免疫性疾病,在世界范围内的发病率逐年升高[19]。令人困扰的是,截至目前UC的病因仍不明确。UC的发病可能涉及免疫系统、遗传学、肠道菌群失调以及环境因素等,而该病在发达国家的发病率更高。UC严重程度随着疾病的进展而逐渐加剧。随着UC的发展,患者每日排便次数会由<6次发展至>10次,炎症指标逐渐出现异常并可能出现发热、寒战和体重变化等症状[19]。除腹泻和便血等肠道症状外,UC还会引发多种并发症,累及眼睛、骨关节、皮肤和肝脏等,极大地影响了患者的日常生活质量[20]。严重的UC患者可能出现结肠穿孔或发展为结肠癌,继而发生死亡的严重不良事件[21]。肠屏障损伤是UC的显著病理特征,肠屏障能够被各种炎症因子或肠固有层中的细胞破坏,继而发生炎症级联反应,导致UC进一步发展。因此,调节炎症因子或炎症细胞是临床治疗或缓解UC的可行策略。修复肠屏障损伤、维持肠道稳态、调控中性粒细胞及肠道固有层免疫应答、调节肠道菌群均与免疫相关蛋白水平的变化关联密切。
苦参作为传统天然药物,在中医药理论的指导下已沿用数千年,《神农本草经》《本草纲目》中均有记载。苦参所含活性成分种类繁多,包含黄酮类、生物碱类、苯丙素类和萜类等多种化学成分,因此,苦参也具有多种药理作用。多项研究结果表明,苦参具有明确的抗炎和免疫调节作用。张丽华等[22]发现,苦参能够降低豚鼠血清肿瘤坏死因子α和IL-6水平,提高IL-10水平。苦参还具有双向免疫调节作用,桑秀秀等[23]发现,氧化苦参碱能够显著提高血清IL-10和IL-27水平,还能够降低CD4+IL-17A表达,减轻炎症细胞浸润程度。杜锐等[24]发现,苦参碱能够显著提高化疗患者血清CD3+、CD4+和CD8+水平,并降低IL-6水平。以上均表明苦参具有潜在的免疫调节功能,是作为调节机体免疫功能的候选药物。
本研究基于GEO数据库UC基因表达芯片数据,应用生物信息学方法获取正常人与UC患者的结肠组织的DEGs,更加客观真实地发现了UC对于正常人体的病理改变过程中分子水平的变化。对于UC疾病的分子机制研究,GEO数据的挖掘是一种更加快速且科学的研究方法。本研究中,MMP9、IL-1β、CXCL8、PPARG、PTGS2和IL-6被认定为苦参通过调节IRGs治疗UC的核心靶点,且富集于IL-17信号通路上。同时,本研究还发现这些靶点还能够富集于reactome数据库[25]中同属于免疫相关通路的IL-4[26]、IL-13[27]以及IL-10信号通路[28]。IL-17细胞因子家族是由IL-17 A—F组成的细胞因子亚群,能够促进炎症免疫反应,在急性和慢性炎症反应中均起关键作用[29]。在IL-17家族细胞因子中,由IL-17A和IL-17E/IL-25激活的信号通路最具特征性。IL-17A与其受体复合物的结合导致核因子激活剂(ACT1)衔接蛋白的募集,该蛋白通过其共有的SEFIR结构域与IL-17受体相互作用。ACT1与IL-17受体复合物的相互作用导致肿瘤坏死因子受体相关因子(TRAF)-6和TRAF-3的募集以及一系列细胞内激酶的激活,包括转化生长因子激酶1、kappa B抑制因子激酶、胞外信号调节激酶(ERK)、糖原合成酶激酶-3β和p38丝裂原激活的蛋白激酶(MAPK)等。这些激酶共同促进核因子κB(NF-κB)、激活蛋白-1和CCAAT-增强子结合蛋白依赖的促炎细胞因子、趋化因子和抗微生物肽的表达。与IL-17A相似,IL-17E信号传导需要ACT1,激活p38 MAPK、ERK和NF-κB,并刺激促炎趋化因子和细胞因子如IL-6和IL-8的表达。然而,与IL-17A信号传导相反,IL-17E诱导的信号传导主要通过驱动IL-4、IL-5和IL-13的表达以及嗜酸性粒细胞的募集来促进Th2和Th9型免疫应答。此外,IL-17E可通过抑制Th1和Th17细胞发育所需细胞因子的分泌,发挥抗炎细胞因子的作用。因此,笔者推测苦参及其活性成分能够通过抗炎及调节机体免疫功能,来发挥治疗UC的作用。
在初步明确了苦参的作用机制后,本研究更进一步对其活性成分进行了分子对接验证。分子对接是依据配体与受体作用的钥匙与锁的原理,模拟配体小分子与受体生物大分子相互作用的一种技术方法[30]。分子对接是基于结构的药物设计中最常用的方法之一,能够预测小分子配体与合适的靶标结合位点的结合构象。结合行为的表征在药物的合理设计以及阐明基本的生化过程中起着重要的作用[31]。本研究使用分子对接工具,将筛选出的核心靶点与苦参中的活性物质进行空间匹配和能量打分,根据能量排序最终得到分子间的最优结构和结合模式。MMP9与怀特酮、PPARG与菜豆素、MMP9与木犀草素、PTGS2与木犀草素、PTGS2与菜豆素、PTGS2与大豆抗毒素的对接结果表明了它们能够结合成为更为稳定的空间结构。因此,本研究推测苦参中的活性成分怀特酮、菜豆素、木犀草素以及大豆抗毒素是苦参治疗UC的潜在的药用活性物质。
综上所述,本研究结果证明了苦参能够调控多种UC相关分子靶点,进而影响多种信号通路及生物学过程,发现苦参通过调节IRGs治疗UC具有一定的科学依据及可行性。本研究为目前临床治疗UC提供了一种新的策略,但本研究仍存在着局限性。(1)UC的疾病过程漫长,临床表现复杂,仅通过GEO数据库获取的信息无法体现UC的全貌,开展的分析也因此较为片面。(2)本研究为基于生物信息学的数据挖掘与分析,对于所得结果尚需要进一步的实际临床研究或基础实验验证。

