峨眉拟单性木兰雄性不育的细胞形态学及生理生化特性研究
余道平 李策宏 李小杰 陈绪玲 谢孔平

摘 要: 峨眉拟单性木兰(Parakmeria omeiensis)是木兰科(Magnoliaceae)拟单性木兰属(Parakmeria)的常绿乔木,属于国家Ⅰ级保护的极度濒危植物。为探究峨眉拟单性木兰两性花中雄性败育发生的时期及花药不同发育时期的生理生化特性,以两性花中的不育雄蕊和雄花中的可育雄蕊为材料,利用石蜡切片观察2种雄蕊的花药发育过程,并测定不同发育时期的可溶性糖、可溶性蛋白、脯氨酸的含量,分析过氧化氢酶(CAT)、过氧化物酶(POD)的活性。结果表明:(1)不育雄蕊与可育雄蕊在减速分裂时期出现明显差异,不育雄蕊的绒毡层致密、没有发育,四分体未形成,随后解体,花粉囊中无花粉;可育雄蕊的绒毡层和小孢子母细胞发育正常,成熟时花粉囊开裂,花粉粒溢出。(2)不育雄蕊的可溶性糖含量、可溶性蛋白含量、脯氨酸含量,在减数分裂时期、单核期和花粉成熟期都显著低于可育雄蕊。(3)不育雄蕊POD活性整体呈上升趋势,在减数分裂时期、单核期和花粉成熟期都显著高于可育雄蕊;不育雄蕊CAT活性整體呈下降趋势,显著低于同时期的可育雄蕊。综上认为,两性花中雄性败育发生在减速分裂时期,其败育的主要原因是物质能量代谢降低,绒毡层没有进一步发育,不能给小孢子母细胞提供营养物质;过氧化氢酶及过氧化物酶的活性异常,造成细胞内不能及时清除自由基,使小孢子母细胞的减数分裂受阻,无法形成四分体。该研究结果为深入开展峨眉拟单性木兰雄性不育的分子机制、性系统演化机制研究奠定了基础。
关键词: 峨眉拟单性木兰, 雄性不育, 花药发育, 生理生化特性, 形态学
中图分类号: Q944.5
文献标识码: A
文章编号: 1000-3142(2024)01-0126-11
Cytomorphology, physiological and biochemical
characteristics of male sterility plant
in Parakmeria omeiensis
YU Daoping1,2,3,4*[KG-*3], LI Cehong2,3,4, LI Xiaojie2,3,4, CHEN Xuling2,3,4, XIE Kongping1,2,3,4
( 1. Sichuan Provincial Institute of Natural Resource Science, Chengdu 610041, China; 2. Emeishan Botanical Garden, Emeishan 614200,
Sichuan, China; 3. Wild Plants Sharing and Service Platform of Sichuan Province, Chengdu 610041, China; 4. Emeishan
Biodiversity Observation and Research Station of Sichuan Province, Emeishan 614200, Sichuan, China )
Abstract: Parakmeria omeiensis an evergreen tree belonged to Parakmeria of Magnoliaceae, is listed as a critically endangered plant under the first-grade State protection. Aimed to clarify the abortion period of male sterility in bisexual flowers of P. omeiensis and its physiological and biochemical characteristics, sterile stamens of bisexual flower and fertile stamens of male flower were test materials, the anther development was observed by paraffin section, the contents of soluble sugar, soluble protein, proline were determined, and catalase (CAT) and peroxidase (POD) activities were analyzed. The results were as follows: (1)Significant difference were detected in meiosis stage in anther development between sterile stamens and fertile stamens, the tapetum layer of sterile stamens was dense and undeveloped, the microspore mother cells didnt develop into the tetrad and subsequently disintegrated, so the pollen sac was empty. The tapetum layer and the microspore mother cells of fertile stamens developed normally, most pollen sac were broken and pollen grain were export. (2)The contents of soluble sugar, soluble protein, proline of sterile stamens were significantly lower than fertile stamens during the stages of meiosis, microspore monuclear and pollen mature. (3) POD activity of sterile stamens increased overall and was significantly higher than fertile stamens during the stages of meiosis, microspore monuclear and pollen mature. CAT activity of sterile stamens decreased as a whole and was significantly lower than fertile stamens in the same stage. We conclude that the microspore abortion occurs at the stage of meiosis, the decrease in metabolism of material and energy causes the abortion of male in bisexual flowers, the tapetum layer dont develop further and it doesnt provide nutrients to the microspore mother cells. CAT and POD activities are abnormal which results in the failure of timely scavenging free radicals in cells, and meiosis of microspore mother cells is blocked, so tetrads fail to be formed.
Key words: Parakmeria omeiensis, male sterility, anther development, physiological and biochemical characteristics, cytomorphology
植物雄性不育(male sterility,MS)是指植物体不能产生正常有功能的花粉、花药或雄配子的遗传现象(范彦君等,2016)。国内外研究者分别从细胞发育、生理生化特性和分子生物学等领域对植物雄性不育材料进行了大量研究,并在禾本科(沈亚琦等,2022)、茄科(吕晓菡等,2015;雷刚等,2022)和十字花科(唐鑫等,2021)等多种作物上取得了一系列新进展,阐明了这些农作物雄性不育发生败育的时期、细胞学特征及其基因对雄性不育的调控作用。但是,对木本植物的研究相对较少,并且局限在细胞形态学和生理生化等初步研究上(张博等,2015;刘望舒等,2019;周洋等,2020)。目前,有关木兰科植物的生殖发育研究以观察大小孢子和雌雄配子体发育的细胞形态为主,探索了小孢子败育发生的时期和细胞学特征(谭金桂等,2007;王亚玲和张寿洲,2008;赵兴峰等,2008;张凤娟等,2008;潘丽琴等,2021)。对甜瓜(Cucumis melo)、高羊茅(Festuca arundinacea)和紫花苜蓿(Medicago sativa)等雄性不育材料的可溶性糖、蛋白质和脯氨酸等物质含量的研究表明,在不育株材料花器官中,出现物质代谢水平降低、脯氨酸亏损现象(盛云燕等,2016;陈伟等,2017;王莹等,2018)。小麦(Triticum aestivum)和大豆(Glycine max)等不育材料花器官中过氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)活性多数低于可育材料,而过氧化物酶(peroxidase, POD)活性高于或低于可育材料,差异较大(刘子涵等,2017; 杨龙树等,2017)。
峨眉拟单性木兰(Parakmeria omeiensis)为木兰科(Magnoliaceae)拟单性木兰属的常绿乔木,成树高为20~25 m。为峨眉山特有种,分布于海拔1 100~1 500 m的常绿阔叶林中,个体数量不到100株,被列为国家一级重点保护野生植物(国家林草局 农业农村部,2021),被世界自然保护联盟(IUCN)红色名录列为极度濒危物种(IUCN,2022),是我国亟待拯救保护的120种极小种群野生植物之一(国家林业局,2012年)。峨眉拟单性木兰为雄花两性花异株(胡先骕和郑万钧,1951;刘玉壶等,1995),是木兰科植物中两性花向单性花过渡的中间类型(徐凤霞,1998,2002)。因此,开展峨眉拟单性木兰花发育的研究对探讨该种的性别分化、木兰科植物的系统演化具有重要意义。
目前,有关峨眉拟单性木兰的研究涉及种群特征 (庄平等,1993)、開花物候及繁育系统(余道平和李策宏,2017)、组织培养技术(陈英和马明东,2008;余道平等,2011)、野外回归及迁地保育(余道平等,2010;余道平和李策宏,2017;Yu et al.,2020)。在我们前期的初步观察中,发现峨眉拟单性木兰两性花中的花药不开裂,无花粉,雌蕊发育正常,能受精结实,属于雄性不育,“两性花”在生理上实属单性(雌性),为隐形雌雄异株,繁育系统为专性异交(余道平和李策宏,2017)。然而,关于该种花发育的细胞形态学、雄性不育机制尚不清楚。因此,本研究以两性花中的不育雄蕊和雄花中的可育雄蕊为材料,采用石蜡切片观察两种雄蕊的花药发育过程,并测定不同发育时期可溶性糖、可溶性蛋白、脯氨酸的含量,分析过氧化氢酶(CAT)、过氧化物酶(POD)的活性,通过对两种雄蕊的细胞发育结构、生理生化特性的比较研究,拟探讨:(1)两性花的雄性败育发生时期;(2)绒毡层发育是否影响小孢子败育;(3)两性花的雄性败育与其物质代谢、过氧化酶活性的关系。旨在探讨两性花雄性不育的时间和原因,为后续深入开展峨眉拟单性木兰雄性不育的分子机制、性系统演化机制研究奠定基础。
1 材料与方法
1.1 材料
材料均采自峨眉山植物园内峨眉拟单性木兰雄性不育株(功能性雌株)和雄性可育植株(雄株)。植物园内的峨眉拟单性木兰种群为1989—1993年从峨眉山野外海拔1 200~1 500 m采集的种子培育而成,目前已有25株进入开花期。该植物园位于103°22′ E、29°35′ N,海拔800 m,属于亚热带湿润季风气候,年均气温为17.3 ℃,绝对最高温度为34 ℃,绝对最低温度为-3 ℃,年均降水量为1 555.3 mm,年均相对湿度为85%,年日照时数为1 398 h,无霜期为300 d。
1.2 方法
1.2.1 细胞发育观察 在2020 年11月至2021年4月底, 每7 d取1次峨眉拟单性木兰花芽3~5个,剥离出雄蕊保存于固定液FAA [V(70%乙醇)∶V(冰乙酸)∶V(甲醛)=18∶1∶1]中,并抽真空。采用常规石蜡制片方法,切片厚度 6~8 μm,先用番红—固绿(Safranin-Fast Green)对染法进行染色、脱水、透明、浸蜡、包埋、切片、树胶封片,再用Olympus BX251光学显微镜观察,并照相。
1.2.2 生理生化指标测定 随机采集两性花株和雄株不同发育时期的花蕾,根据花蕾的形态特征,结合镜检结果及发育时间将其分为小孢子母细胞时期(花蕾纵径2.0~2.5 cm)、减数分裂时期(花蕾纵径2.6~3.6 cm)、单核时期(花蕾纵径3.7~4.8 cm)、花粉成熟期(花蕾纵径≥5.0 m)4个发育时期,液氮速冻, -80 ℃冰箱保存待测。可溶性蛋白含量、可溶性糖含量及游离脯氨酸含量的测定方法参照王三根(2017)的植物生理学实验教程。采用试剂盒测定样品CAT、POD的含量,试剂盒来自上海索桥生物有限公司,按照试剂盒使用说明书进行测定,每个样品重复测定3次,取平均值。
2 结果与分析
2.1 雄蕊形态结构
峨眉拟单性木兰为单花顶生,具佛焰苞1枚,花被片9~12枚,分内、中、外3层,乳白色。 雄花具雄蕊34~42枚,长2.0~2.5 cm,宽2.0~2.5 mm,花丝鲜红色,花药饱满,花粉量多,成熟时内向开裂散粉(图1:B);两性花具雄蕊18~25枚,长1.5~1.8 cm,宽2.0~2.4 mm,较雄花的短小且扁化,花丝红棕色,花药隔紫色,不开裂,绿色的雌蕊群呈椭圆状卵圆形,具短柄(图1:A,C)。
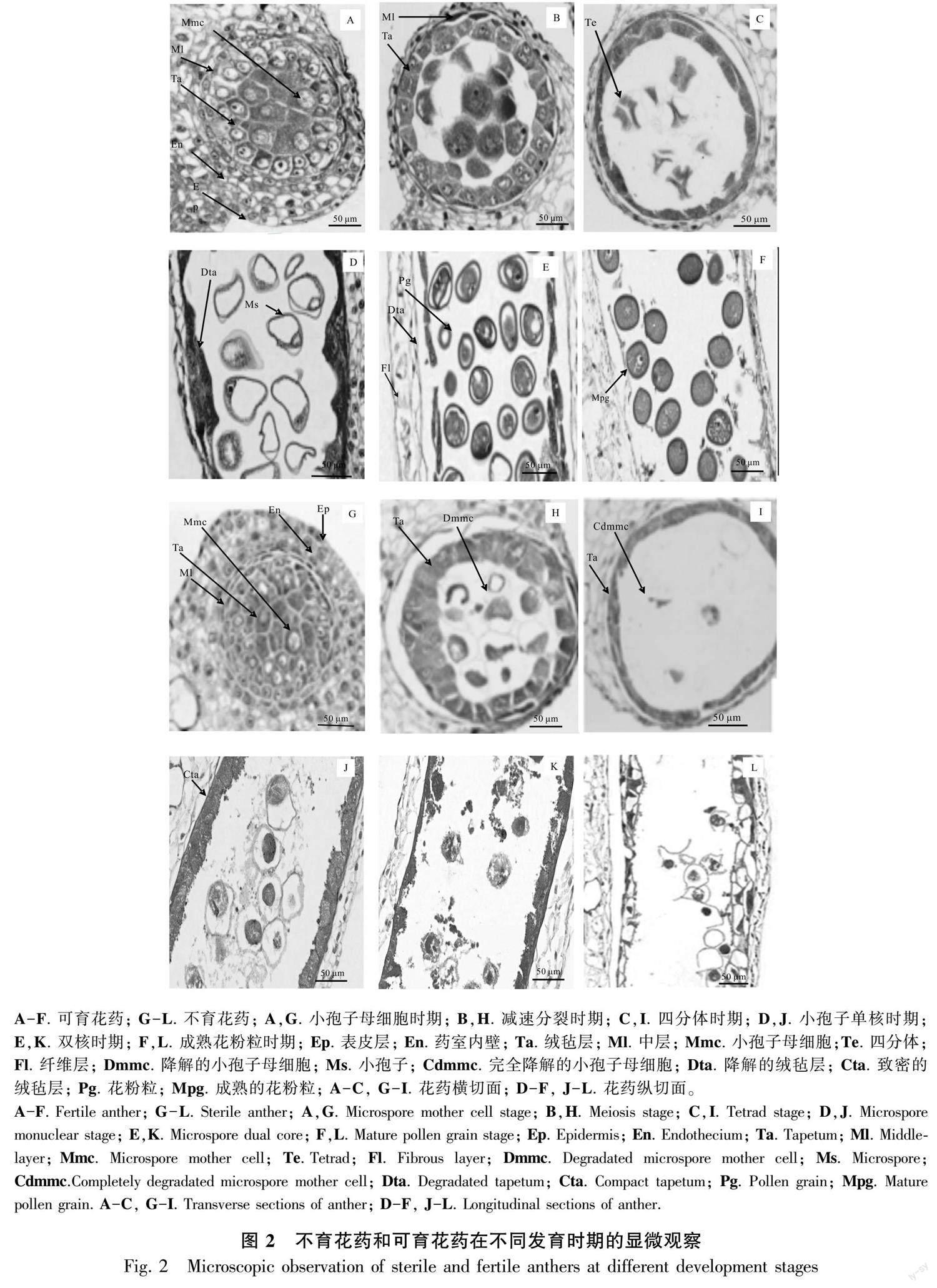
2.2 花药不同发育时期的显微结构
2.2.1 小孢子母细胞时期
可育花药从外到里依次为表皮1层、药室内壁2层、中层2层和绒毡层l~2层,绒毡层细胞核大、染色深,单核、双核或多核;小孢子母细胞呈多边形,排列紧密,胞质浓厚(图2:A)。不育花药与可育花药的形状差别不大,从外到里也由表皮1层、药室内壁2层、中层2层和绒毡层l~2层组成,但绒毡层细胞排列不整齐、体积较可育的绒毡层小、多为单核(图2:G)。
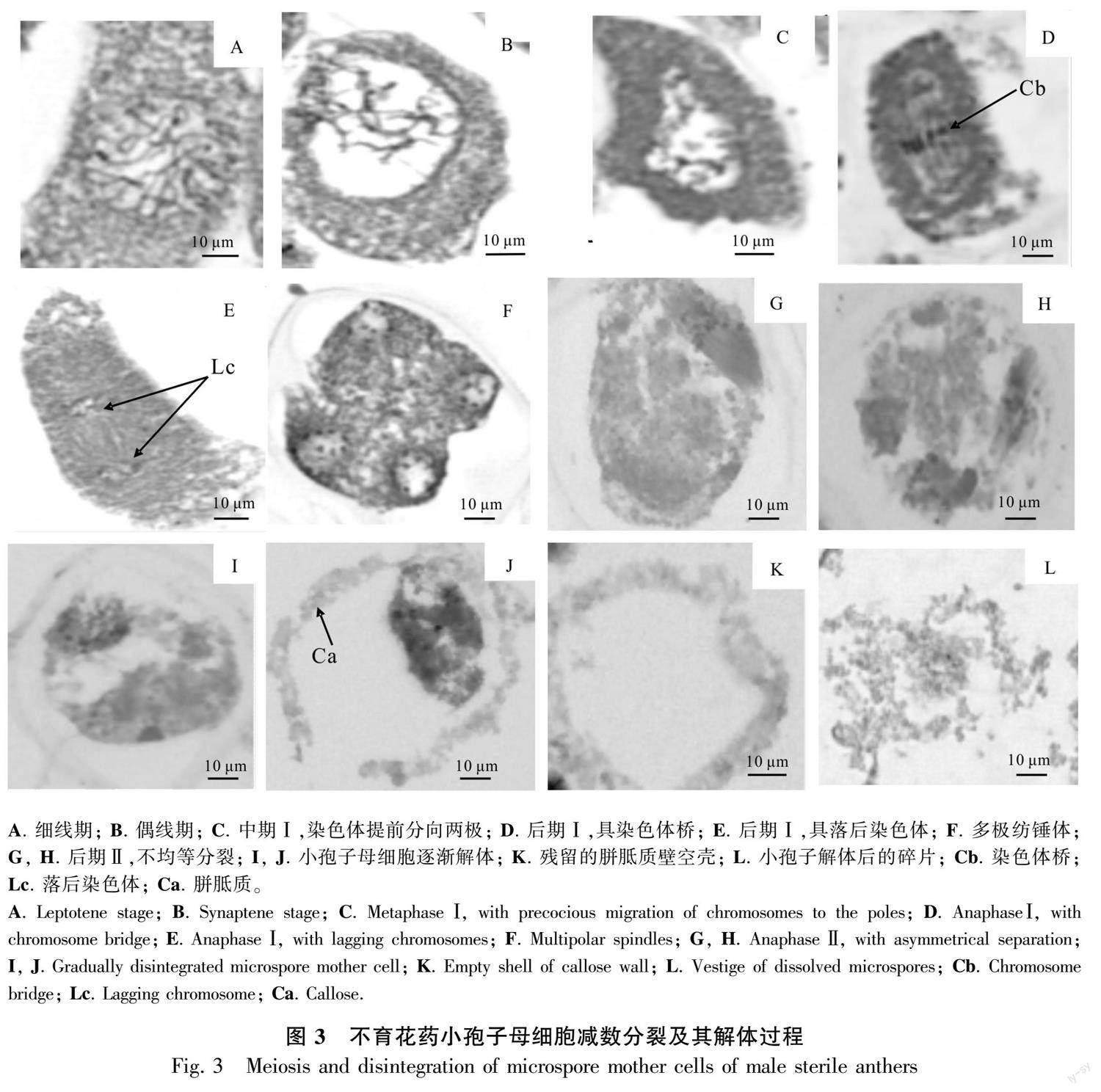
2.2.2 减数分裂期 可育花药减数分裂前期,中层细胞开始解体, 绒毡层细胞发达, 胞质浓厚, 排列整齐规则,紧贴中层细胞;小孢子母细胞细胞质浓缩,染色质开始凝聚,随后染色体变短变粗,开始向赤道板移动,细胞质发生缢裂,不伴随细胞板的形成(图2:B;图3:A,B),第2次减数分裂完成后形成4核,并被共同的胼胝质包围,减数分裂为修饰性同时型。不育花药的中层细胞此时已呈线性,绒毡层细胞膨大、排列不规整,与位于药隔部位的花药壁脱离,此时小孢子母细胞细胞质与细胞核发生收缩,无细胞形态,减数分裂异常(图2:H),细胞出现多极纺锤体(图3:F)、染色体桥(图3:D)、染色体落后(图3:E)、染色体提前分向两极(图3:C)、染色体不均等分裂(图3:G,H)等现象。
2.2.3 四分体时期 可育花药的小孢子从胼胝质壁中释放出来时,中层解体成线形,绒毡层开始退化,在四分体后期,整个绒毡层细胞染色较深,细胞形态消失,排列不规则,细胞核与细胞质界限不明显,最后与药室内壁脱离;四分体小孢子的排列方式多为四面体形(图2:C)。不育花药中层完全解体,绒毡层没有发育,还是整体在一起,并与药室内壁紧密粘在一起,小孢子继续收缩成“骨形”,开始解体,不能形成四分体(图2:I; 图3:J)。
2.2.4 小孢子单核时期 可育花药绒毡层开始解体,分泌胼胝质酶,分解围绕四分体周围的胼胝质壁,释放出单核小孢子,常呈球状或椭圆形,细胞质较浓,细胞核位于中央。随后细胞质逐渐变淡,液泡化现象逐渐明显,小液泡汇集成一个大液泡,核及细胞质被挤到细胞的边缘,成为单核靠边期(图2:D)。不育花药绒毡层细胞致密,染色深,退化异常,小孢子母细胞开始解体(图2:J; 图3:I,J)。
2.2.5 双核及花粉粒成熟时期 双核花粉粒形成时,绒毡层细胞质已基本耗尽,仅留有细胞壁结构,药室内壁细胞内向壁出现纤维状加厚(图2:E),成熟的花粉粒表面有刺突,绒毡层完全降解(图2:F) 。不育花药绒氈层薄壁细胞溶解,填充花粉囊,小孢子母细胞继续解体,逐渐消失(图2:K),致使整个药室内无花粉粒的产生,形成空壳(图2:L; 图3:K,L)。
2.3 生理生化指标测定结果
2.3.1 花药不同发育期营养物质含量 不育雄蕊和可育雄蕊花药发育过程中可溶性蛋白含量的变化如图4:A所示。可溶性蛋白含量在不育雄蕊中呈下降趋势,在可育雄蕊中呈先升后降趋势。在小孢子母细胞时期,不育雄蕊略低于可育雄蕊,差异不显著;在减数分裂期、单核时期和花粉成熟期,不育雄蕊显著低于同时期可育雄蕊。随着花药的发育,不育雄蕊和可育雄蕊的可溶性糖含量呈递增趋势,且在花药发育各时期,不育雄蕊的可溶性糖含量都低于可育雄蕊(图4:B)。在小孢子母细胞时期,不育雄蕊和可育雄蕊的可溶性糖含量差异不显著;在减数分裂期、单核期、花粉成熟期差异显著。不育雄蕊和可育雄蕊中的游离脯氨酸含量随花药的发育先增加后减少 (图4:C)。在小孢子母细胞时期,不育雄蕊的游离脯氨酸含量显著高于可育雄蕊,是可育雄蕊的1.2倍;但在减数分裂期、单核花粉期和花粉成熟期,不育雄蕊显著低于可育雄蕊。
2.3.2 花药不同发育期POD和CAT的活性 随着花药的发育,不育雄蕊中的POD活性总体呈递增趋势,而可育雄蕊的POD活性总体呈递减趋势(图5:A)。在减数分裂时期、单核期、花粉成熟期,不育雄蕊的POD活性都显著高于可育花药, 分别是可育花药的1.23倍、1.93倍和2.28倍。花药发育后2个时期不育雄蕊和可育雄蕊的POD活性差距非常大。
不育雄蕊和可育雄蕊的CAT活性均随花药发育呈先升后降趋势(图5:B)。在小孢子母细胞时期,两者差距不显著;在减数分裂时期、单核期、花粉成熟期,不育雄蕊的CAT活性显著低于可育雄蕊;不育雄蕊CAT活性在减数分裂期升高, 在单核花粉期开始下降。可育雄蕊CAT活性在减数分裂期显著升高, 在单核花粉期和花粉成熟期逐渐下降。
3 讨论与结论
3.1 峨眉拟单性木兰两性花中雄性败育的时期及原因
一般认为双子叶植物花粉败育高峰多发生在造孢细胞至四分体时期,单子叶植物则多发生在花粉发育的单核期至二核期(朱英国,2000)。在已报道的木兰科濒危植物小孢子发育研究中,其花粉败育时期表现多样化,可发生在次生造孢细胞、花粉母细胞、减速分裂、四分体、单核等多个时期(谭金桂,2007;王亚玲和张寿洲,2008;赵兴峰等,2008;张凤娟等,2008;潘丽琴等,2021)。本研究发现,峨眉拟单性木兰雄性败育发生在小孢子母细胞减数分裂时期,即花粉母细胞到四分体这个阶段,这与濒危植物西畴含笑(Michelia coriacea)和天女木兰(Magnolia sieboldii)小孢子败育的时间一致(赵兴峰等,2008;张凤娟等,2008 )。不同的雄性不育类型具有不同的败育表现形式,由于败育发生的早迟,因此把雄性不育性分为5种表现型,即雄蕊退化或变形、花药异常、孢子囊退化、小孢子退化和花粉功能缺陷(Preuss et al.,1993)。结合峨眉拟单性木兰两种雄蕊的形态结构和花药发育过程的比较,可以得出其雄性不育类型应为孢子囊退化型,即小孢子母细胞不能进行正常的减数分裂,无法形成四分体,致使花药内没有花粉。
多数学者认为,绒毡层的异常发育与雄性不育有关,绒毡层作为花粉囊壁的最内层,包围着花粉母细胞或小孢子,对花粉的发育和形成起着重要作用(范彦君等,2016;雷刚等,2022)。绒毡层的提前或延迟解体均会影响小孢子的发育,郭瑛琪等(2021)发现大白菜不育花药绒毡层细胞异常膨大,严重空泡化,提前降解,小孢子因变形干瘪而死亡,花药不育与绒毡层提前发生细胞程序性死亡有关,从而影响小孢子进一步发育的营养供应。在峨眉拟单性木兰不育花药的小孢子母细胞时期,绒毡层细胞排列不规整,多为单核,在随后的发育过程中,绒毡层细胞膨大、排列紧密,与位于药隔部位的花药壁脱离,没有进一步发育,不能为小孢子母细胞提供所需要的营养,致使小孢子母细胞减速分裂异常。这说明峨眉拟单性木兰两性花雄性不育可能是由绒毡层的异常发育引起的,而绒毡层发育异常的原因还需要进一步研究。
小孢子母细胞减数分裂是维持小孢子正常发育的重要过程。前人对杉木(Cunninghamia lanceolata)(李亚鹏等,2023)、厚轴茶(Camellia crassicolumna)(蒋会兵等,2020)、白杨(许重阳,2011)等不育系材料的研究结果表明,花粉母细胞减数分裂过程出现问题会导致花粉败育。本研究观察到雄性不育的小孢子母细胞减数分裂过程中存在滞后染色体、染色体桥、不均等分离等较多异常现象,说明峨眉拟单性木兰小孢子母细胞减数分裂过程中染色体异常可能是导致小孢子败育的原因之一。
3.2 雄性不育与物质代谢、抗氧化酶活性的关系
小孢子在发育过程中需要积累大量的蛋白质、氨基酸、淀粉和糖类物质等营养物质, 这些物质的亏损可能对雄性不育的发生起到诱导作用。大量研究发现雄性不育系与其可育系的含糖量及蛋白质含量存在显著差异, 多数可育系的营养物质含量高于不育株(陈伟等, 2017;王莹等,2018;周涛等,2022)。本研究发现,随着峨眉拟单性木兰花药的发育,可溶性糖、可溶性蛋白质、脯氨酸的含量在不育花药中都低于可育花药,特别是在单核期、花粉成熟期的含量两者差距更大,这些生理代谢上的异常与小孢子母细胞败育关系密切。
植物抗氧化酶的活性与植物雄性不育密切相关。厚轴茶雄性不育株花蕾发育过程中POD活性升高,各发育时期都显著高于可育株;而不育株SOD和CAT的活性呈降低趋势(蒋会兵等,2020)。西瓜和玉米的雄性不育株在花蕾发育过程中POD活性显著升高,CAT活性明显降低(王永琦等 2016;周国昌等2018)。不育系的POD活性显著上升会引起吲哚乙酸类物质分解,造成IAA亏损,引起不育系内源激素含量的变化或使激素平衡体系受到破坏,从而使调节功能紊乱,物质合成或调运的不足使雄蕊活性偏低,最终导致雄性器官不育(冯小磊等,2012;刘子涵等,2017;杨龙树等,2017)。本研究发现,峨眉拟单性木兰不育花药的POD 活性在各发育时期都高于可育花药,整体呈上升趋势;而CAT活性整体呈递减趋势,显著低于可育花药,这可能会造成活性氧的积累,因对小孢子母细胞的发育产生毒害而造成败育,这与以上报道的结果基本一致。
3.3 两性花中雄性不育的生殖策略
拟单性木兰属的花一直被认为是雄花两性花异株(胡先骕和郑万钧,1951;刘玉壶等,1995),本研究在细胞结构和生理生化基础上进一步证实了峨眉拟单性木兰实为隐形雌雄异株,这是比木兰科中木莲属、含笑属两性花植物较为进化的特征。一些濒危植物通过选择性败育来提高后代的适合度,可能是生长在资源贫乏的环境下,在长期进化过程中形成的一种生殖保障(徐涛等,2012)。
新疆阿魏(Ferula sinkiangensis)雄性不育植株通过功能性雌花的花药败育,减少了对雄蕊的资源投入,而将植株能量用于形成雌蕊、产生更多的雌花,以生产更多的异交后代(何爽和谭敦炎,2022)。从我们的野外调查来看,峨眉拟单性木兰野外种群分布区域狭窄,生长在悬崖峭壁上,环境资源非常有限。峨眉拟单性木兰两性花中的雄性选择败育,为雌蕊和胚珠的正常发育提供了充足营养,有利于生殖取得成功。雌株需从雄株上获取正常花粉来完成授粉且结实,这种专性异交的繁育系统促进了居群的杂种优势作用,可以提高后代对恶劣环境的抵抗力。雄性不育的两性花植株与雄全异株个体共存的性系统体现了峨眉拟单性木兰特有的资源配置模式。然而,这种雄性不育是由环境因素引起还是由基因决定,这个问题还有待进一步深入研究。
综上所述,通过对峨眉拟单性木兰两种雄蕊的细胞发育结构、部分生理生化特性的比较研究,发现小孢子母细胞减数分裂的异常是导致两性花中雄性不育的主要原因。不育雄蕊在不同发育时期的可溶性蛋白、可溶性糖和游离脯氨酸含量偏低,POD活性升高,CAT活性降低,与可育雄蕊之间存在显著性差异,说明它们的异常可能与两性花中的雄性不育存在相关性。今后还有待于从激素、分子等方面对峨眉拟单性木兰雄性不育机理开展进一步研究。
参考文献:
CH EN Y, MA MD, 2008. Axillary bud and callus induction of stem segement endangered plant of Parakmeria omeiensis [J]. For Sci Technol, 33(1): 10-12. [陳英, 马明东, 2008. 濒危植物峨眉拟单性木兰茎段腋芽及愈伤组织诱导 [J]. 林业科技, 33(1): 10-12.]
CHEN W, FU W, WU JH, et al., 2017. Cytology, physiological and biochemical characterization in microspore abortion of male sterile plant in Festuca arundinacea [J]. Plant Physiol J, 53(9): 1761-1771. [陈伟, 付薇, 吴佳海, 等, 2017. 高羊茅雄性不育小孢子败育的细胞学及生理生化特性 [J]. 植物生理学报, 53 (9): 1761-1771.]
CHEN Y, SONG C, CHEN D, et al., 2017. Morphological structure of microspore in cytoplasmic male sterile line of onion [J]. Jiangsu Agric Sci, 45(7): 107-110. [程雨, 宋策, 陈典, 等, 2017. 洋葱细胞质雄性不育株小孢子败育的细胞形态学结构 [J]. 江苏农业科学, 45(7): 107-110.]
FAN YJ, WANG Y, LIU QY, et al., 2016. Advances in cytoplasmic male sterility in plant [J]. Chin Agric Sci Bull, 32(18): 70-75. [范彦君, 王瑜, 刘齐元, 等, 2016, 植物细胞质雄性不育研究进展 [J]. 中国农学通报, 32(18): 70-75.]
Announcement of the Ministry of Agriculture and Rural Affaris, the National Forestry and Grassland Administration, No. 15 of 2021, List of Wild Plants Under National Key Protection [EB/OL]. http://www.forestry.gov.cn/c/www/lczc/10746.jhtml. [国家林业和草原局 农业农村部公告(2021年第15号)(国家重点保护野生植物名录) [EB/OL]. http://www.forestry.gov.cn/c/www/lczc/10746.jhtml.]
GUO QY, LI X, CUI HF, et al., 2021. Tapetum abnormal PCD lead to microspore abortion in anther of GMS line Chinese cabbage [J]. J Yunnan Agric Univ(Nat Sci Ed), 36(3): 402-408. [郭瑛琪, 李祥, 崔海芳, 等, 2021. 大白菜核不育花药绒毡层的异常细胞程序性死亡(PCD)导致小孢子败育研究 [J]. 云南大学学报(自然科学), 36(3): 402-408.]
HE S, TAN DY, 2022. Morphological and cytological studies on male sterile in Ferula sinkiangensis [J]. Guihaia, 42(10):1652-1660. [何爽, 谭敦炎, 2022. 新疆阿魏雄性不育的细胞形态学研究 [J]. 广西植物, 42(10): 1652-1660.]
HU XS, ZHENG WJ, 1951. A new genus — Parakmeria Hu et Cheng of Magnoliaceae in the Southwest of China [J]. Acta Phytotaxon Sin,1(1):1-3. [胡先骕, 郑万均, 1951. 拟克抹丽木, 中国西南部木兰科一新属 [J]. 植物分类学报, 1(1): 1-3.]
IUCN(International Union for Conservation of Nature), 2022. The IUCN Red List of Threatened Species [EB/OL]. (2022-07-18)[2023-03-04].https://www. iucnredlist.org.
JIANG HB, YANG SM, LIU YF,et al., 2020. Biological characteristics and cytological studies on anther abortion of male sterile Camellia crassocolumna [J]. Acta Agron Sin, 46(7): 1076-1086. [蔣会兵, 杨盛美, 刘玉飞, 等, 2020. 厚轴茶雄性不育株花药败育的生物学特性和细胞学研究 [J]. 作物学报, 46(7): 1076-1086.]
JIANG HB, SUN YN, XU Y, et al., 2020. Physiological and biochemical changes during bud development in male sterile plant of Camellia crassicolum [J]. J Plant Physiol, 56(9): 1807-1817. [蒋会兵, 孙云南, 许燕, 等, 2020. 厚轴茶雄性不育株花蕾发育过程中的生理生化变化 [J]. 植物生理学报,
56(9): 1807-1817.]
LEI G, ZHOU KH, CHEN XJ, et al., 2022. Cytological morphology identification of microspore abortion in cytoplasmic male sterile line of pepper [J]. J Jiangxi Agric, 34(4): 28-32. [雷刚, 周坤华, 陈学军, 等, 2022. 辣椒细胞质雄性不育系小孢子败育的细胞学形态鉴定 [J]. 江西农业学报, 34(4): 28-32.]
LI YP, SUN YH, LIN HZ, et al., 2023 Correlations between microsporogenesis and male cone development of Cunninghamia lanceolata [J]. J Beijing For Univ, 45(1): 51-58. [李亚鹏, 孙宇涵, 林华忠, 等, 2023. 杉木小孢子发生与雄球花发育相关性研究 [J]. 北京林业大学学报, 45(1): 51-58.]
LI YQ, WANG QL, WEI CY, et al., 2020. Morphological observation and physiological and biochemical characteristics of cotton cytoplasmic male sterile cells [J]. SW Chin J Agric Sci, 33(1): 58-63. [李玉青, 王清连, 韦春艳, 等, 2020. 棉花胞质雄性不育细胞形态学观察及生理生化特性的研究 [J]. 西南农业学报, 33(1): 58-63.]
LIU WS, HAN LZ, ZHU W, et al., 2019. Cytological observation on pollen development of the male sterile poplar variety [J]. J Nanjing For Univ (Nat Sci Ed), 43(1): 198-203. [刘望舒, 韩林芝, 朱嵊, 等, 2019. 杨树雄性不育品种花粉发育过程的细胞学观察 [J]. 南京林业大学学报(自然科学版), 43(1): 198-203.]
LIU YH, XIA NH, YANG HQ, 1995. The origin, evolution and phytogeography of Magnoliaceae [J]. J Trop & Subtrop Bot, 3(4): 1-12. [刘玉壶, 夏念和, 杨惠秋, 1995. 木兰科的起源、进化和地理分布 [J]. 热带亚热带植物学报, 3(4): 1-12.]
LIU ZH, SHI XY, YAN PJ, et al., 2017. Tapetum programmed cell death and active oxygen metab olism in D-2 type cytoplasmic male sterile line of wheat [J]. Sci Agric Sin, (21): 23-38. [刘子涵, 石晓艺, 闫鹏娇, 等, 2017. D-2型细胞质雄性不育小麦绒毡层细胞程序化死亡与活性氧代谢 [J]. 中国农业科学, (21): 23-38.]
L XH, FANG XP, CAI WG, et al., 2015. Comparative analysis of cytology and proteomics in anthers between cytoplasmic male sterile line and its maintainer line of peppers [J]. J Zhejiang Univ (Agric & Life Sci), 41(1): 44-55. [吕晓菡, 方献平, 柴伟国, 等, 2015. 辣椒胞质不育系与保持系花药的细胞学和蛋白质组学差异分析 [J]. 浙江大学学报(农业与生命科学版), 41(1): 44-55.]
PAN LQ, HAO J, XU JM, et al., 2021. Anther structure and pollen development characteristic of Manglietia conifera [J]. For Res, 34(6): 107-113. [潘丽琴, 郝建, 徐建民, 等, 2021. 灰木蓮花药结构和花粉发育特征[J]. 林业科学研究, 34(6): 107-113.]
SHEN YQ, JIANG WX, XIANG YY, et al., 2022. Cytological analysis and gene gapping of male sterile mutant dtp1 in Rice [J]. J Nucl Agric Sci, 36(4): 689-697. [沈亚琦, 蒋文翔, 项圆圆, 等, 2022.水稻雄性不育突变体dtp1的细胞学分析与基因定位 [J]. 核农学报, 36(4): 689-697.]
SHENG YY, CHANG W, JIAO SQ, et al., 2016. Stamen structure development and physiological and biochemical characteristics in male sterile melon [J]. Plant Physiol J, 52(7): 1028-1034. [盛云燕, 常薇, 矫士琦, 等, 2016. 甜瓜雄性不育植株雄蕊发育结构及生理生化特征 [J]. 植物生理学报, 52 (7): 1028-1034.]
TAN JG, WU H, LI Y, et al., 2009. Microsporogenesis and male gametophyte formation of Woonyoungia septentrionalis(Dandy)Law [J]. Acta Bot Boreal-Occident Sin, 29 (5) : 867-873. [谭金桂, 吴鸿, 李勇, 等, 2009. 焕镛木小孢子发生及雄配子体发育研究[J]. 西北植物学报, 29(5): 867-873.]
TANG X, LI YY, LU JX, et al., 2021. Morphological characteristics and cytological study of anther abortion of temperature-sensitive nuclear male sterile line 160S in Brassica napus [J]. Acta Agron Sin, 47(5): 983-990. [唐鑫, 李圓圆, 陆俊杏, 等, 2021. 甘蓝型油菜温敏细胞核雄性不育株160S花药败育的形态学特征和细胞学研究 [J]. 作物学报, 47(5): 983-990.]
WANG SG, 2017. Plant physiology experiment course [M]. Beijing: Science Press: 188-206. [王三根, 2017. 植物生理学实验教程 [M]. 北京: 科学出版社: 188-206.]
WANG Y, WANG YZ, XU AK, et al., 2018. A comparative analysis of physiological and biochemical characteristics between alfalfa cytoplasmic male sterile line and maintainer line [J]. Chin J Grassland, 40(1): 24-28. [王莹, 王英哲, 徐安凯, 等, 2018. 紫花苜蓿细胞质雄性不育系及其保持系花蕾的生理生化特性 [J]. 中国草地学报, 40(1): 24-28.]
WANG YL, ZHANG SZ, 2008. Studies on the microsporogenesis and Development of the male gametophyte of Magnolia championii Benth [J]. J Plant Sci, 26(6): 547-553. [王亚玲, 张寿洲, 2008. 香港木兰小孢子发生及雄配子体发育的研究 [J]. 植物科学学报, 26(6): 547-553.]
WANG YQ, YANG XZ, MO YL, et al., 2016. Analysis of the changes in antioxidant enzymes activities and endogenous hormones contents in watermelon male sterile line Se18 during bud development [J]. Acta Hortic Sin, 43(11): 2161-2172. [王永琦, 杨小振, 莫言玲, 等, 2016. 西瓜核雄性不育株‘Se18抗氧化酶活性和内源激素含量变化分析 [J]. 园艺学报, 43(11): 2161-2172.]
XU CY, WANG J, YE L, et al., 2011. Meiosis of microsporocyte and variation of pollen in an allotriploid white poplar [J]. Acta Agron Sin, 31(12): 2454-2458. [许重阳, 王君, 叶粟, 等, 2011. 白杨杂种三倍体小孢子母细胞减数分裂及花粉形态观察 [J]. 西北植物学报, 31(12): 2454-2458.]
XU FX, 2002. Study on pollen morphology of Parakmeria lotungensis [J]. Guihaia, 22(2): 157-159 [徐凤霞, 2002. 乐东拟单性木兰花粉形态观察 [J]. 广西植物, 22(2): 157-159.]
XU FX, 1998. Study on pollen morphology of Kemeria [J]. Guihaia, 18(1): 29-31. [徐凤霞, 1998. 单性木兰属花粉形态观察 [J]. 广西植物, 18(1): 29-31.]
XU T, CHU YX, QIAN LC, et al., 2012. Study on pollen abortion and seed setting ratio in Manglietia hebecarpa C.Y.Wu et Law, a critically endangered plant in Yunnan Province [J]. J Yunnan Univ (Nat Sci Ed), 34(5): 586-589. [徐涛, 楚永兴, 钱良超, 等, 2012. 极危植物毛果木莲花粉败育及其结籽率研究 [J]. 云南大学学报 (自然科学版), 34(5): 586-589.]
YANG LS, LI JJ, HE TT, et al., 2017. Comparative analysis of physiological and biochemical characteristics between cytoplasmic-nuclear male sterile line and its maintainer in soybean [Glycine max (L.) Merr.] [J]. Soybean Sci, 36(3): 391-398 [杨龙树, 李佳佳, 贺亭亭, 等, 2017. 大豆质核互作雄性不育系NJCMS1A与其保持系NJCMS1B的生理生化特性比较分析[J]. 大豆科学, 36 (3): 391-398.]
YU DP, LI CH, 2017. Resuming Parakmeria omeiensis, a critically endangered species endemic to Sichuan, China [J]. Green Tianfu, (9): 26-27. [余道平, 李策宏, 2017. 极度濒危植物峨眉拟单性木兰的拯救保护 [J]. 绿色天府, (9): 26-27.]
YU DP, LI CH, 2022. Endangered flower revitalized the conservation of Parakmeria cmeriensis [J]. Earch, (4): 21-24. [余道平, 李策宏, 2022. 濒危花朵 重焕生机—峨眉拟单性木兰的保护 [J]. 地球, (4): 21-24.]
YU DP, LI CH, DING J, et al., 2011. Preliminary report on character of seed and seed culture in virto of Parakmeria omeiensis [J]. Resour Dev Market, 27(3): 197-198. [余道平, 李策宏, 丁健, 等, 2011. 峨眉拟单性木兰种子特性及离体培养初报 [J]. 资源开发与市场, 27(3): 197-198.]
YU DP, LI CH, WEN XY, et al., 2019. Flowering biological characteristics and breeding system of Parakmeria omeiensis [J]. Guihaia, 39(5): 600-607. [余道平, 李策宏, 文香英, 等, 2019. 峨眉拟单性木兰的开花生物学特性与繁育系统 [J]. 广西植物, 39(5): 600-607.]
YU DP,WEN XY, LI CH, et al., 2020. Integrated conservation of Parakmeria omeiensis: a critically endangered plant species endemic to Southwest China [J]. Oryx, 54(4): 460-465.
ZHANG FJ, XU XY, CHEN FM, et al., 2008. microsporogenesis and development of male gametophytes of Magnolia sieboldii [J]. Nonwood For Res, 26(4): 71-75. [张凤娟, 徐兴友, 陈凤敏, 等, 2008. 天女木兰小孢子发生及雄配子体发育的观察 [J]. 经济林研究, 26(4): 71-75.]
ZHANG B, LI LP, MAO WB, et al., 2015.Development of male and female gametophytes between fertile line and male sterile lines flowers of Catalpa bungei C. A. Meyer [J]. Bull Bot Res, 35(6): 812-818. [张博, 李利平, 毛伟兵, 等, 2015. 雄性不育与可育楸树花发育的细胞学比较研究 [J]. 植物研究, 35(6): 812-818.]
ZHAO XF, SUN WB, YANG HB, et al., 2008. Mega-and microsporogenesis and development of female and male gametophytes of Michelia coriacea (Magnoliaceae), a globally critical endangered plant in Southeast Yunnan of China [J]. Acta Bot Yunnan, 30(5): 549-556. [赵兴峰, 孙卫邦, 杨华斌, 等, 2008. 极度濒危植物西畴含笑的大小孢子发生及雌雄配子体发育 [J]. 云南植物研究, 30(5): 549-556.]
ZHOU GC, SHI HC, YU XJ, et al., 2018. Comparison of physiological-biochemical characteristic between sterile and fertile plants of male sterile K932MS in maize [J]. J Maize Sci, 26(3): 6-11. [周国昌, 石海春, 余学杰, 等, 2018. 玉米雄性不育K932MS不育株和可育株生理生化特性的比较研究 [J]. 玉米科学, 26(3): 6-11.]
ZHOU T, WANG BK, WANG J, et al., 2022. Research progress in male sterility of tomato [J]. N Hortic, (1): 122-128. [周涛, 王柏柯, 王娟, 等, 2022. 番茄雄性不育研究进展 [J]. 北方园艺, (1): 122-128.]
ZHOU Y, YANG ZQ, HUANG YL, Dynamic changes of microstrobilus morphology and cell development in male sterile and fertile lines of Pinus elliottii [J]. Guihaia, 40(4): 482-491. [周洋, 杨章旗, 黄永利, 2020. 湿地松雄性不育和可育系小孢子叶球形态和细胞发育动态变化 [J]. 广西植物, 40(4): 482-491.]
ZHU YG, 2000. Biology of male sterility in rice [M]. Wuhan: Wuhan University Press. [朱英国, 2000. 水稻雄性不育生物学 [M]. 武汉: 武汉大学出版社.]
ZHUANG P, LIU RY, LIANG KH, 1993. A preliminary study on phytocoenological characters of Parakmeria omeiensis community [J]. Guihaia, 13(1): 61-69. [莊平, 刘仁英, 梁开和, 1993. 峨眉拟单性木兰群落特征的初步研究 [J]. 广西植物, 13(1): 61-69.]
( 责任编辑 蒋巧媛 )
基金项目: 四川省重点研发项目(2023YFS0378); 2022年中央级公益性科研院所基本科研业务费项目; 国际植物园保护联盟项目(BGCI30414)。
第一作者: 余道平(1978-),硕士,副研究员,主要从事珍稀濒危植物的保育研究,(E-mail)550265856@qq.com.

