肉制品中马源性成分重组酶介导链置换等温扩增实时检测方法的建立及应用
范 维,孔维恒,高晓月,董雨馨,李贺楠,郭文萍,*
(1.中国肉类食品综合研究中心,北京食品科学研究院,北京 100068;2.中国海关科学技术研究中心,北京 100000)
随着全球经济的发展,肉及肉制品逐渐成为人们餐桌上的主角,而其掺假问题也成为国内外重点关注的食品安全问题之一[1-2]。目前,肉及肉制品掺假的主要形式之一是使用廉价肉代替或部分掺入到高价肉中进行销售[3],这种不法行为不仅给消费者带来经济损失、干扰肉类行业有序发展,更有甚者可引起宗教信仰、食品安全等问题[4-5]。马肉作为一种食用范围不广泛的低价肉,其在色泽、肉质等方面与价格相对较高的驴肉、牛肉较为相近,尤其是当经过深加工制成肉制品后,消费者很难通过肉眼进行区分,这就导致一些用马肉进行蓄意掺假行为的发生。从欧洲的“马肉风波”[6]到英国的“挂牛头卖马肉”[7],再到中国的“马肉变驴肉”[8]等层出不穷的肉类掺假事件,揭示了马肉掺假现象的广泛存在。近些年,我国深化改革,大力加强肉及肉制品质量安全监管和掺假鉴别检测技术支撑能力建设,并于2021年发布了《关于开展肉制品质量安全提升行动的指导意见》,突出强调了要持续性地对肉及肉制品进行源性成分掺假鉴别风险监测,并要求通过发展新技术进一步提升基层肉种快速鉴别检测能力,充分发挥食品安全快速检测初级“过滤网”作用。因此,开发出快速、准确、可在基层推广使用的动物源性成分掺假鉴别技术将成为检测行业未来的发展方向。
目前,国内外主要采用核酸分子生物学检测手段对动物源性成分进行鉴别,包括聚合酶链式反应(polymerase chain reaction,PCR)及衍生技术和等温扩增技术[9]。其中PCR及衍生技术灵敏度高、准确性强,已经成为源性成分鉴定较为常用的方法之一[10],但其实验过程需依靠精准且昂贵的控温设备,有时后期还要结合电泳跑胶和条带测序,使其成本较高、实验周期长、操作繁琐,适合在大型专业性实验室使用[11]。与PCR及衍生技术不同,等温扩增技术是在恒温条件下对目标核酸序列进行特异性扩增,不需要昂贵的温度循环控制设备,且可以与其他微设备(恒温荧光检测仪、横向流试纸条、微流体芯片等)进行偶联,在低资源配置条件下实现快速检测[12-13]。常见的等温扩增技术包括环介导等温扩增(loop-mediated isothermal amplification,LAMP)、滚环等温扩增(rolling circle amplification,RCA)、重组酶介导链置换等温扩增(recombinase aided chain displacement isothermal amplification,RAA)等[14-15]。其中,LAMP技术较为常用,但4 条引物设计难度较大,引物间易发生交互作用,影响结果的准确性;RCA技术具有特异性强、高通量等特点,但其要求模板为环状DNA,若扩增线性DNA,需要锁式探针和连接酶,步骤繁琐,成本较高;相较之下,RAA技术仅需要2 条引物,一般在37 ℃至42 ℃等温条件下反应5~20 min即可完成特异性扩增,具有反应迅速、引物设计简单、特异性强和操作简便等优势[16],可作为一种有效的肉种快速鉴别方法在监管部门、中小企业及一般检测实验室得到推广使用。
RAA技术的扩增原理是利用重组酶与引物结合形成聚合体Rec/ssDNA,在辅助蛋白和单链结合蛋白的帮助下,侵入双链DNA模板形成D-loop区域,并对DNA双链进行扫描,当找到与引物互补的目标区域后,聚合体Rec/ssDNA解体,同时聚合酶结合到引物的3’末端开始链的延伸,完成扩增过程[17]。目前,RAA技术主要应用在病毒和致病菌检测领域[18-19],如Mu Dan等[20]建立了脱脂乳、生菜和湖水中大肠埃希氏菌O157:H7的RAA快速检测方法;在动物源性成分掺假鉴别方面,尤其是针对马源性成分鉴别的应用研究较少,如Zhou Chi等[21]建立了一种快速检测动物源性食品中鸭源性成分的RAA方法。因此,本研究旨在建立一种快速、准确、便捷的马源性成分RAA实时检测方法,并对该方法在不同加工工艺(生、煮、烤、风干、油炸、高温高压灭菌)肉制品中的适用性进行评估,使其可以真正应用于市售深加工肉制品的真伪性鉴别检测中,为监管部门开展肉制品掺假鉴别风险监测提供强有力的技术支撑。
1 材料与方法
1.1 材料与试剂
用于对照或模拟样品制备的26 种动物肉分别购自屠宰厂或由北京市食品质量监督检验三站提供,均为整块纯肉,包括:马肉(蒙古马、伊犁马、哈萨克马)、驴肉(德州驴、关中驴、新疆驴、云南驴)、猪肉、鸭肉、鸡肉、山羊肉、绵羊肉、黄牛肉、水牛肉、牦牛肉、狗肉、猫肉、兔子肉、火鸡肉、鹅肉、狍子肉、骆驼肉、鼠肉、狐狸肉、鹿肉、鸽子肉。用于市售样品检测的肉及肉制品,分别购自农贸市场、超市、生产企业及餐馆,包括:驴肉及其制品(生驴肉、驴肉馅、驴肉火烧、酱驴肉、驴肉火腿等)、牛肉及其制品(生牛肉、牛肉片、酱牛肉、牛肉串等)、羊肉及其制品(生羊肉、羊肉片、羊肉串、焖羊肉等)。
动物基因组DNA提取试剂盒 广州迪澳生物科技有限公司;RAA核酸扩增试剂盒(荧光法)安普未来生物科技有限公司;2×PCR Premix ExTaqTM大连宝生物科技有限公司;引物、探针合成 北京华大基因科技有限公司。
1.2 仪器与设备
FTC-3000P型实时荧光PCR仪 加拿大Funglyn公司;微量核酸蛋白测定仪 美国BioTek公司;3-30K台式高速冷冻离心机 德国Sigma公司;DK-80恒温金属浴 上海一恒仪器有限公司;ZK系列小型高速万能粉碎机 上海达平仪器有限公司。
1.3 方法
1.3.1 样品前处理
生肉需用清水进行简单冲洗,清洗掉样品表面可能沾染的其他源性组织或细胞;肉制品用清水多次浸泡清洗,尽量去除盐、糖、色素及油脂等干扰成分。选取样品瘦肉部分,用清洗干净的剪刀、高速粉碎机等将其研磨成肉糜状。不同源性的样品使用不同的器具,防止交叉污染。
1.3.2 DNA提取及浓度测定
按照动物基因组试剂盒说明书对0.5 g研磨好的肉糜样品进行DNA提取并测定其纯度。DNA的OD260nm/OD280nm在1.8~2.0之间,可用于RAA扩增。将提取出的样品和对照DNA均稀释成5 ng/μL,作为扩增模板,置于-20 ℃冰箱备用。
按以下计算公式进行质量浓度和拷贝数之间的换算[22-23]:
式中:ρ代表马基因组质量浓度/(ng/μL);DNA length代表马基因组长度(2.5×109bp)。
1.3.3 引物、Exo探针设计与筛选
1.3.3.1 引物与探针设计
参考近年文献发表的相关序列,选择ATpase 6基因为靶基因,从NCBI上查找并下载马(GenBank:KX377931.1)、驴(GenBank:KT829558.1)、牛(GenBank:DQ347618.1)、羊(GenBank:KY453456.1)的ATpase 6基因序列,使用SnapGene软件进行序列比对,筛选出种内保守、种间差异性区域片段,按Twist Dx公司给出的引物探针设计指南[24],使用Primer Express和Primer Premier 5.0软件设计2 对RAA引物和1 条Exo探针。用于RAA扩增的引物长度一般在30~35 bp,GC相对含量在30%~70%之间,扩增片段避免形成二级结构,目标序列长度建议在150~300 bp;探针序列不与特异性引物识别位点重叠,长度为46~52 bp,避免回文序列、内部二级结构和连续的重复碱基。探针共有4 个修饰位点:1)距离5’端30~35 bp中部位置标记一个dSpacer(四氢呋喃(tetrahydrofuran,THF));2)THF位点的上游标记一个荧光基团(如荧光染料(fluorescein amidite,FAM));3)THF位点的下游标记一个淬灭基团(如BHQ1(black hole quencher 1));4)3’末端标记一个修饰基团,例如胺基、磷酸基团或C3-spacer。具体序列见表1。之后将设计好的引物探针通过SnapGene软件检测其可行性和特异性。
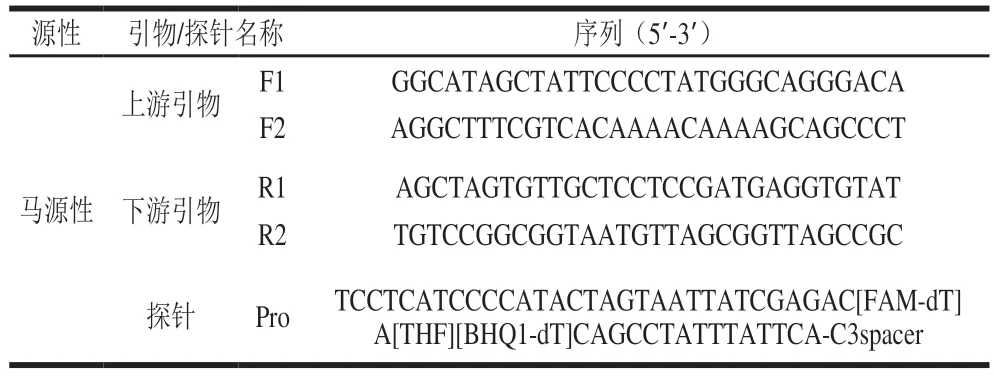
表1 实验所用引物及Exo探针序列Table 1 Primers and Exo probes used in this study
1.3.3.2 引物的筛选策略
将设计出的2 对RAA引物和1 条Exo探针分别进行组合,形成4 组引物探针组合(F1/R1/Pro、F1/R2/Pro、F2/R1/Pro、F2/R2/Pro),分别用4 组引物探针进行马源性RAA扩增,根据荧光信号强度和扩增开始时间(Ct值)筛选出最优引物探针组合。
1.3.4 RAA反应体系及扩增条件的优化
1.3.4.1 Mg2+添加量的优化
RAA反应体系为50 μL:向预混有重组酶及聚合酶干粉的反应管中加入29.4 μL反应缓冲液、上下游引物(10 μmol/L)各2 μL、探针(10 μmol/L)0.6 μL以及2 μL模板DNA,用相应ddH2O补至总体积分别为49.5、48.5、47.5、46.5、45.5 μL。充分混匀后,对应的分别将0.5、1.5、2.5、3.5、4.5 μL MgAc2溶液(280 mmol/L)加到反应管盖内,上下颠倒8~10 次进行混匀。瞬时离心后,按39 ℃,1 min;39 ℃,30 s,30 个循环(荧光PCR仪)或39 ℃,1 min;39 ℃,15 min(恒温荧光检测仪)的反应条件进行RAA扩增,根据荧光信号强度、扩增开始时间(Ct值)以及方法特异性确定最佳反应体系。
1.3.4.2 反应温度的优化
用优化出的最佳反应体系分别于30、35、37、39、42 ℃条件下进行马源性RAA扩增,根据荧光信号强度、扩增开始时间(Ct值)确定最佳反应温度。
1.3.5 RAA方法特异性及包容性实验
提取3 种目标源性和23 种非目标源性的DNA,并以此为模板,进行马源性RAA扩增,验证本方法的特异性及包容性。同时以双蒸水作为空白对照。
1.3.6 RAA方法灵敏度实验
将1.8×104copies/μL的马源性DNA溶液进行10 倍梯度稀释,从各梯度的DNA稀释液中分别取2 μL作为模板加入到反应体系中,进行RAA扩增,各浓度设置5 个重复。按Ivanov等[16]的方法,以DNA拷贝数的对数为横坐标,Ct值为纵坐标,绘制目标DNA检测灵敏度Box-plot图,并进行Logistic函数曲线拟合,以此考察该方法的DNA灵敏度。
1.3.7 RAA方法在不同加工工艺中的适用性及检出限实验
1.3.7.1 不同掺入比例混合样品制备
分别以驴肉、牛肉和羊肉为本源,向其中掺入马肉,参照Chen Xiaoyu等[25]的方法制备5 个不同的质量比例梯度(0.01%、0.1%、1%、10%、100%)的二元混合样品(马/驴、马/牛、马/羊)。以马/驴二元混合样品制备为例:使用高速破碎机将预先研磨好的1 g马肉糜与9 g驴肉糜间歇性混合6 min,得到马肉质量分数为10%的混合样品(编码为A1);取1 g A1样品与9 g驴肉糜间歇性混合6 min,得到马肉质量分数为1%的样品(编码为A2);取1 g A2样品与9 g驴肉糜间歇性混合6 min,得到质量分数为0.1%的样品(编码为A3),同样方法依次制备0.01%混合样品以及其他源性二元混合样品。每个样品中的两种肉糜总质量为10 g,混合过程中加入无毒蓝色染料,混合至颜色均匀(6 min)。各比例混合样品设10 个重复。
1.3.7.2 不同加工工艺及条件
为了评估不同加工工艺对所建立方法适用性的影响,参照Kim等[26]的研究,将1.3.7.1节制备的不同比例混合样品进行以下5 种处理:1)100 ℃沸水浴中煮15 min;2)180 ℃烤箱中烤10 min;3)65 ℃烘箱中干燥12 h;4)180 ℃食用油中炸10 min;5)121 ℃、103.4 kPa条件下灭菌15 min。各加工工艺样品设10 个重复。
1.3.7.3 适用性及检出限测定
取经不同加工工艺处理后的不同掺入比例的混合样品各0.5 g,进行DNA提取,用于马源性成分的RAA检测方法的建立。根据≥95%置信水平法则[25],评估所建立的RAA方法在不同加工工艺肉制品中的适用性及检出限,即在10 次平行实验中,10 次结果均为检出的最低目标源性掺入量即为该加工工艺条件下目标源性的检出限。
1.3.8 市售样品检测
从不同渠道购买肉及肉制品共计90 份,包括驴肉及其制品30 份(编号1~30)、牛肉及其制品30 份(编号31~60)、羊肉及其制品30 份(编号61~90)。将样品粉碎研磨至肉糜状,取0.5 g进行DNA提取,之后采用建立的RAA方法对样品进行马源性成分检测,同时采用标准方法SN/T 3730.5—2013《食品及饲料中常见畜类品种的鉴定方法 第5部分:马成分检测 实时荧光PCR法》[27]进行验证,对比两种方法的检测结果。
1.3.9 结果判定标准
阳性对照:有荧光信号检出,且出现典型的扩增曲线,Ct值≤30.0;空白对照、阴性对照:无荧光信号检出,相应Ct值>30;样品判定:荧光通道有荧光信号检出,相应Ct值≤30.0,判定为阳性;荧光通道无荧光信号检出,相应Ct值>30.0,判定为阴性。
1.4 数据统计与分析
2 结果与分析
2.1 引物、Exo探针设计及筛选结果
使用Snap Gene 软件对马(Gen Bank :KX377931.1)、驴(GenBank:KT829558.1)、牛(GenBank:DQ347618.1)、羊(GenBank:KY453456.1)的ATpase 6基因序列进行比对,并将设计的引物、探针导入软件中,对其可行性进行分析,结果见图1。从马源性ATpase 6靶基因谱图(图1A、B)和不同物种ATpase 6基因序列比对图(图1C)可知,所设计的2 对引物和1 条探针均可以在马源性的ATpase 6靶基因序列中搜索到,且在引物界定的靶标序列区域内,马源性与其他物种的差异性碱基数均超过150 个(相似度仅为43.1%),属于位于种间序列差异性区域内[28]。因此,本研究设计的引物、探针均可以用于马源性的特异性扩增。进一步对适用于RAA方法的最佳引物、探针组合进行筛选,采用4 组引物探针(F1/R1/Pro、F1/R2/Pro、F2/R1/Pro、F2/R2/Pro),分别进行马源性RAA扩增,结果见图2。从图2可知,不同的引物、探针组合均能产生扩增曲线,其中F2/R1/Pro组合特异性扩增开始时间最早(Ct值为2.86),且荧光信号最强。综上,选择F2、R1、Pro作为马源性RAA扩增的上、下游引物和探针。
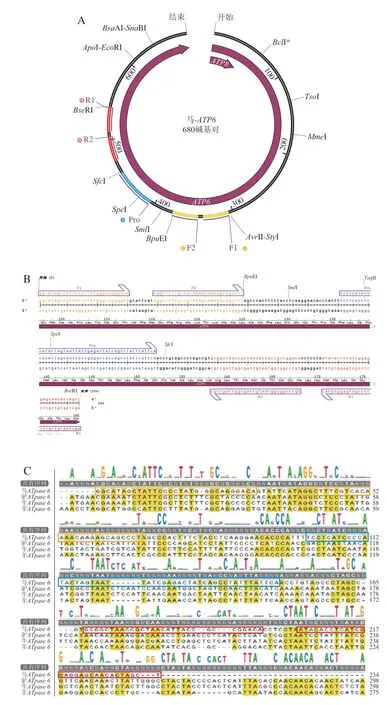
图1 引物、Exo探针可行性分析Fig.1 Feasibility analysis of primers and Exo probes
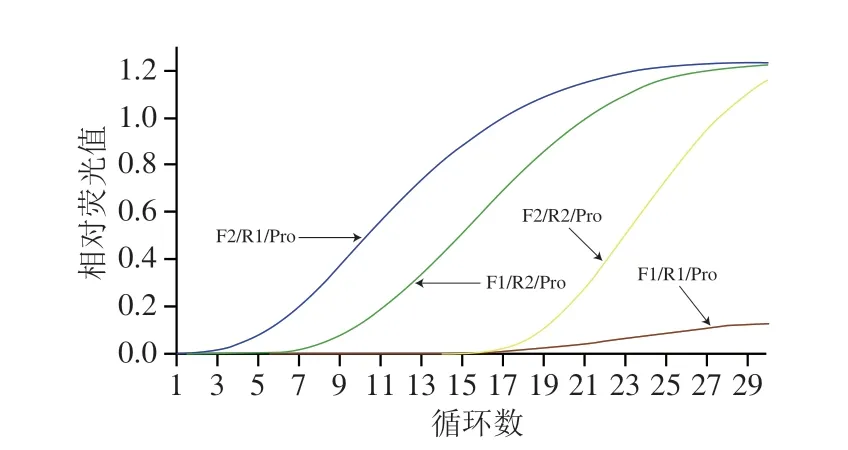
图2 引物、Exo探针的筛选Fig.2 Screening of primers and Exo probes
2.2 RAA反应条件优化结果
为了确定最佳的RAA扩增反应参数,本研究对Mg2+添加量和反应温度进行了优化。根据Mg2+添加量优化结果(图3A)可知,随着反应体系中Mg2+添加量的增加(0.5、1.5、2.5、3.5、4.5 μL),RAA扩增开始时间逐渐提前且荧光信号显示出增强的趋势,这与吴昊等[29]的研究相似。这主要是由于Mg2+作为聚合酶的辅助因子在整个RAA扩增中起到启动反应的作用,并且对反应的扩增效率也有至关重要的影响[22,29]。但随着进一步特异性验证实验发现,当Mg2+添加量较高时(3.5、4.5 μL),反应的特异性会降低,会出现非特异性扩增条带,这与Lin Liyun等[22]的研究结果一致。综上,本实验选择2.5 μL作为Mg2+最佳添加量。从反应温度优化结果(图3B)可知,在30~42 ℃扩增温度范围内均可以扩增出马源性特异性目标条带。但当扩增温度较低时(30、35 ℃),不利于酶活性维持,使得扩增开始时间较晚;而当扩增温度为37、39、42 ℃时,特异性扩增开始时间和荧光信号强度均无明显差异,这与Lin Liyun[22]、郭燕华[30]等的研究结果相近。综上,选择39 ℃作为马源性RAA扩增反应的最佳反应温度。

图3 RAA反应条件优化结果Fig.3 Optimization of RAA reaction conditions
2.3 RAA方法特异性及包容性实验结果
以3 种马源性和23 种非目标源性DNA为模板,进行马源性RAA扩增,结果见表2和图4。本实验开发的方法对常见的马品种均可以检出,且当添加的DNA模板初始质量浓度为5 ng/μL时,非目标源性(阴性对照)及空白对照均未检测到荧光信号。由此可知,建立的RAA方法对于马源性具有较好包容性,且对非目标源性无交叉反应。
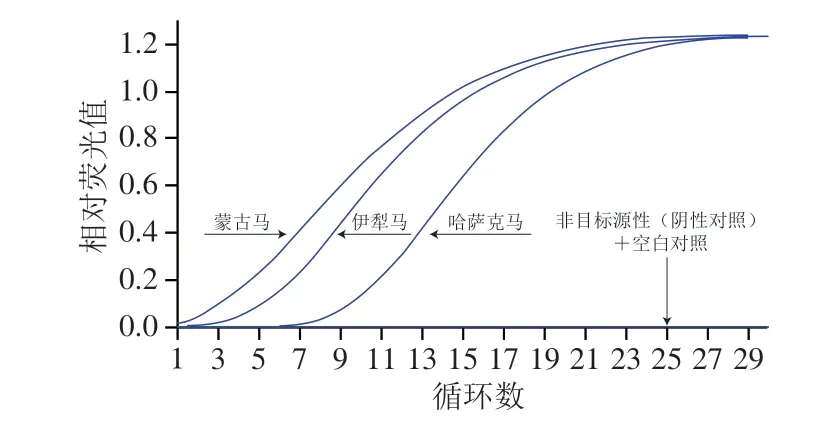
图4 引物、Exo探针特异性分析Fig.4 Specificity analysis of primers and Exo probes

表2 方法特异性及包容性实验结果Table 2 Results of specificity and inclusiveness experiments
2.4 RAA方法灵敏度实验结果
以Ct值为纵坐标(Y),DNA拷贝数的对数值为横坐标(X)绘制目标DNA检测灵敏度Box-plot图,并进行Logistic函数曲线拟合,结果如图5所示。随着目标DNA拷贝数的增加,RAA扩增反应Ct值随之减小,但DNA拷贝数的对数值与Ct值并非呈严格的线性关系,这与Ivanov[16]、张雅薇[31]等的研究结果相似。本实验开发的RAA方法可准确检测到拷贝数为1.8 copies/μL的马源性DNA,而当模板DNA拷贝数低于该值时,仍有扩增,但重复性和准确性差。

图5 目标源性扩增曲线及灵敏度Box-plot图Fig.5 Amplification curves and sensitivity Box-plot for target animal origin
2.5 不同加工工艺条件下RAA方法适用性及检出限结果
通过对5 种加工条件(煮、烤、炸、干制、高温高压灭菌)下处理的不同比例混合肉样品进行检测,确定该方法在深加工熟肉制品和生肉中的适用性及方法的检出限。如表3所示,同等掺入比例条件下,经过加工处理的样品目标源性检测Ct值相对高于生肉的Ct值,说明深加工工艺会对目标源性的RAA检测造成影响,可能是由于高温和高压条件使得DNA发生降解[26]。此外,通过不同掺入比例样品的测定结果发现,当掺入量为0.01%时,生肉样品10 次平行实验目标源性的检出次数可以达到10 次,满足不小于95%置信区间的测试要求,表明该掺入量可以检出且重复性较好;而煮肉、烤肉、干制肉、油炸肉、高温高压灭菌肉样品的检出次数均有小于10 次的情况,说明该掺入量存在无法检出的可能性,若以0.01%掺入量作为熟肉制品的检出限,会造成假阴性结果的产生。综上,为了确保使用本方法进行肉及肉制品检测时的准确性,现规定本方法对于生肉的检出限为0.01%,对于熟肉制品的检出限为0.1%。该检出限与Jonas[28]、苗丽[32]等的研究结果一致,但低于Kumar[24]、吴昊[29]等研究的1%和0.2%。
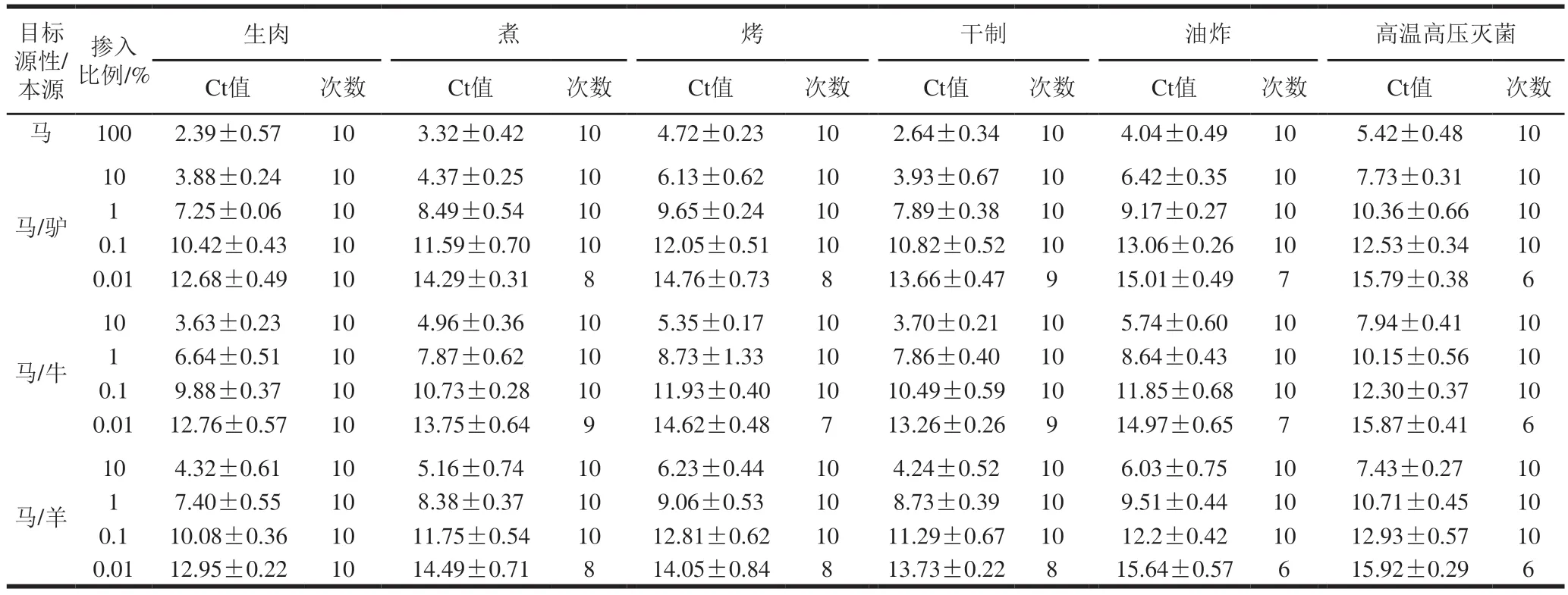
表3 不同加工工艺下RAA方法适用性及样品检出限结果Table 3 Applicability of RAA and detection limits for samples under different processing techniques
2.6 市售样品检测结果
采用本实验建立的RAA方法与标准方法同时对90 份市售样品进行马源性成分检测,结果见表4。本方法与标准方法结果一致,均有8 个样品检出含有马源性成分,不合格率为8.9%(8/90)。8 个不合格样品中包括6 个驴肉及其制品和2 个牛肉制品。其中6 个不合格驴肉及其制品中有2 个生驴肉(1 个生鲜驴肉、1 个驴肉馅)和4 个熟肉制品(3 个驴肉火烧、1 个酱驴肉);2 个不合格牛肉制品均为熟肉制品(酱牛肉)。此外,用所建的RAA方法仅需16 min即可完成对目标DNA的检测,而标准方法则需要大约1 h(94 ℃预变性1 min;94 ℃变性34 s,60 ℃退火45 s,40 个循环)。综上可知,两种方法的检测结果一致,且所建方法的检测时间仅为标准方法的1/4,说明该方法快速、准确,可作为一种有效技术手段用于市售肉及肉制品中马源性成分的掺假鉴别检测。
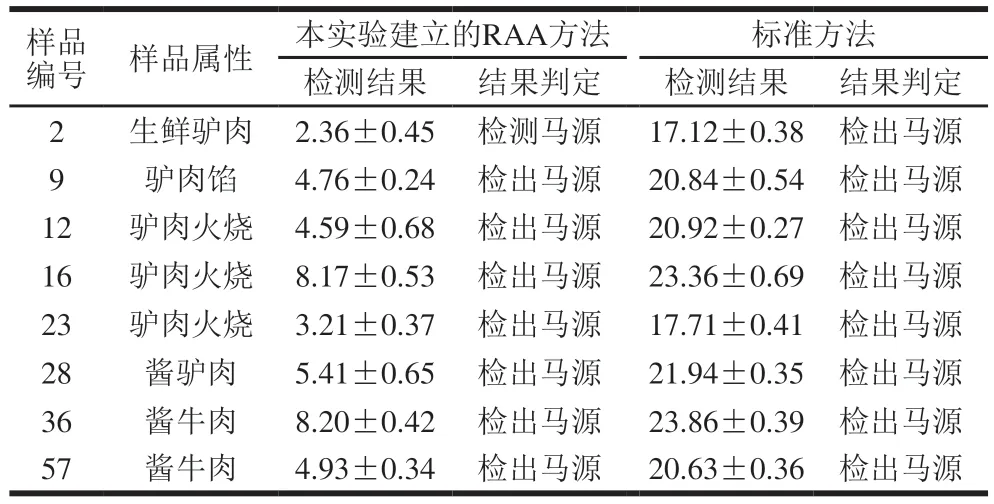
表4 市售样品中不合格样品的检测结果Table 4 Results of detection of problem commercial samples
3 结论
本研究通过靶基因筛选、目标区域片段比对、特异性引物探针设计以及反应参数优化,开发出一种可快速鉴定肉及肉制品中马源性成分的RAA实时检测方法。研究采用多拷贝线粒体基因为靶基因,克服了单拷贝基因在样品热处理温度越高、掺假比例越低时,其检测结果偏差越大的问题[33-34],并充分考虑了不同加工工艺(煮、烤、炸、干制、高温高压灭菌)对方法适用性的影响,使得该方法的应用范围从生鲜肉进一步扩展到了深加工熟肉制品。本方法操作简便、反应迅速,可在39 ℃恒温条件下16 min内完成对马源性成分的特异性检测,且对检测仪器要求低,适用于荧光PCR仪或成本更低的便携式恒温荧光检测仪,具有较强的基层推广性和现场检测实用性。此外,该方法的灵敏度、特异性和检出限均可以与现有的PCR方法相媲美,其目标DNA的检测灵敏度可以达到1.8 copies/μL水平;与常见的23 种畜禽均无交叉反应;对生肉的检出限为0.01%,对熟肉制品的检出限为0.1%,满足目前各标准中对马源性检出限的要求。用该方法对90 份市售样品进行马源性成分检测,结果与标准方法一致,而用时仅为标准方法的1/4。综上,本研究建立的重组酶介导等温扩增实时检测方法可以作为一种有效的检测手段,应用在生肉及深加工熟肉制品中马源性成分的真伪性鉴别风险监测中,为提升基层现场检测能力、打击非法掺假欺诈、规范市场秩序和保障人民食品安全提供技术支持。

