红三七炮制工艺优化及其补血活性研究
段嫏环,李起慧,吕 冬,汪 勇,崔秀明,2,*
(1.昆明理工大学生命科学与技术学院,云南 昆明 650500; 2.云南省三七资源可持续利用重点实验室,云南 昆明 650500; 3.云南省三七研究院,云南 昆明 650500)
三七为五加科人参属植物三七Panax notoginseng(Burk.) F.H.Chen 的干燥根及根茎[1],作为“生熟异用” 类中药的典型代表具有“生打熟补” 之说[2],即生三七能止血活血、消肿定痛,而熟三七具有补血理血、强身健体之功[3],临床主要用于治疗贫血、失血虚弱、月经不调、产后恶血不尽等疾病[4]。熟三七炮制工艺有焙、炒、蒸、油炸、砂烫、发酵、微波等[5-6],目前通行方法为蒸制[7],而以鲜品切片,蒸制后再进行干燥的红三七加工方法具有加工时间短、节约能源、适宜于产地趁鲜加工等优点,对提升该药材产地加工水平、增加产区地方经济效益具有重要意义,但鲜有关于其加工工艺、药理活性的报道。因此,本实验优化红三七炮制工艺,并评价其补血活性,以期为该药材产地趁鲜加工、饮片开发提供依据。
1 材料
1.1 试剂与药物 三七皂苷 R1( 批号YZ0220222,纯度≥98%),人参皂苷Rg1(批号YZ112620,纯度≥98%)、Rb1(批号YZ081920,纯度≥98%)、Rk3(批号 YZ071623,纯度≥98%)、Rh4( 批号 YZ070721,纯度≥98%),20 (R)-人参皂苷Rg3(批号YZ041522,纯度≥98%) 对照品均购自南京源植生物科技有限公司;乙酰苯肼、环磷酰胺均购自阿拉丁试剂(上海)有限公司。复方阿胶浆购自东阿阿胶股份有限公司; 鲜三七(批号20211001) 采挖于云南丘北县,经昆明理工大学崔秀明研究员鉴定为五加科人参属植物三七Panaxnotoginseng(Burk.) F.H.Chen 的根及根茎。甲醇、乙腈为色谱纯,购自美国Sigma公司; 水为纯净水。
1.2 动物 SPF 级雄性KM 小鼠,体质量(20±2) g,6~7 周龄,购自斯贝福(北京) 生物技术有限公司,实验动物生产许可证号SCXK (京)2019-0010。动物实验经昆明理工大学实验动物管理伦理委员会批准[使用许可证号SYXK (滇)K2021-0003]。
1.3 仪器 LC2030 plus 高效液相色谱仪(日本岛津公司); 101-113 电热鼓风干燥箱(天津市宏诺仪器有限公司); YXQ-LS-100SII-01-00 压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂); DFY-500 摇摆式高速中药粉碎机(温岭市工大机械有限公司); HF3800 血常规分析仪(山东海力孚企业管理有限公司); BL10-250A 超声波清洗机(上海比朗仪器制造有限公司); AL-104 型电子天平(瑞士梅特勒-托利多公司)。
2 方法与结果
2.1 饮片制备 取10 kg 鲜三七主根,经捡选、清洗、切片后均匀分成2 份,一份置于高压灭菌锅中蒸制4 h 后干燥,制得红三七饮片; 另一份干燥,常压蒸制3 h 后再干燥,制得熟三七饮片。
2.2 评价指标测定 根据课题组前期研究[8-9],选择生三七中主要皂苷成分(三七皂苷R1及人参皂苷Rg1、Rb1) 和熟三七中补血相关皂苷成分[10][人参皂苷Rk3、Rh4及20 (R) -人参皂苷Rg3]总含量(Y) 作为评价指标,采用HPLC 法测定。分析采用Pntulips RSZG-C18Plus 色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈(A) -水(B),梯度洗脱(0 ~25 min,20% B; 25 ~30 min,20% ~25%B; 30 ~41 min,25% ~41% B; 41 ~55 min,41% ~55% B; 55 ~80 min,55% ~74% B; 80~82 min,74% ~100% B); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长203 nm; 进样量10 μL。将“2.1” 项下2 种饮片打粉,按文献[11] 报道测定单体总皂苷含量。
2.3 单因素试验 选择蒸制温度[12]、蒸制时间[13]、烘干时间[14]、烘干温度[15]作为影响因素,单体总皂苷含量(Y) 作为评价指标。
2.3.1 蒸制温度 取鲜三七切片适量,置于高压灭菌锅中,固定蒸制时间4 h,烘干温度50 ℃,烘干时间48 h,测定蒸制温度90、100、110、120、130 ℃时总皂苷含量,结果见图1A。由此可知,总皂苷含量随着蒸制温度增加而升高,在130 ℃时达到最大值,考虑到生产条件限制,最终选择130 ℃作为蒸制温度考察范围。
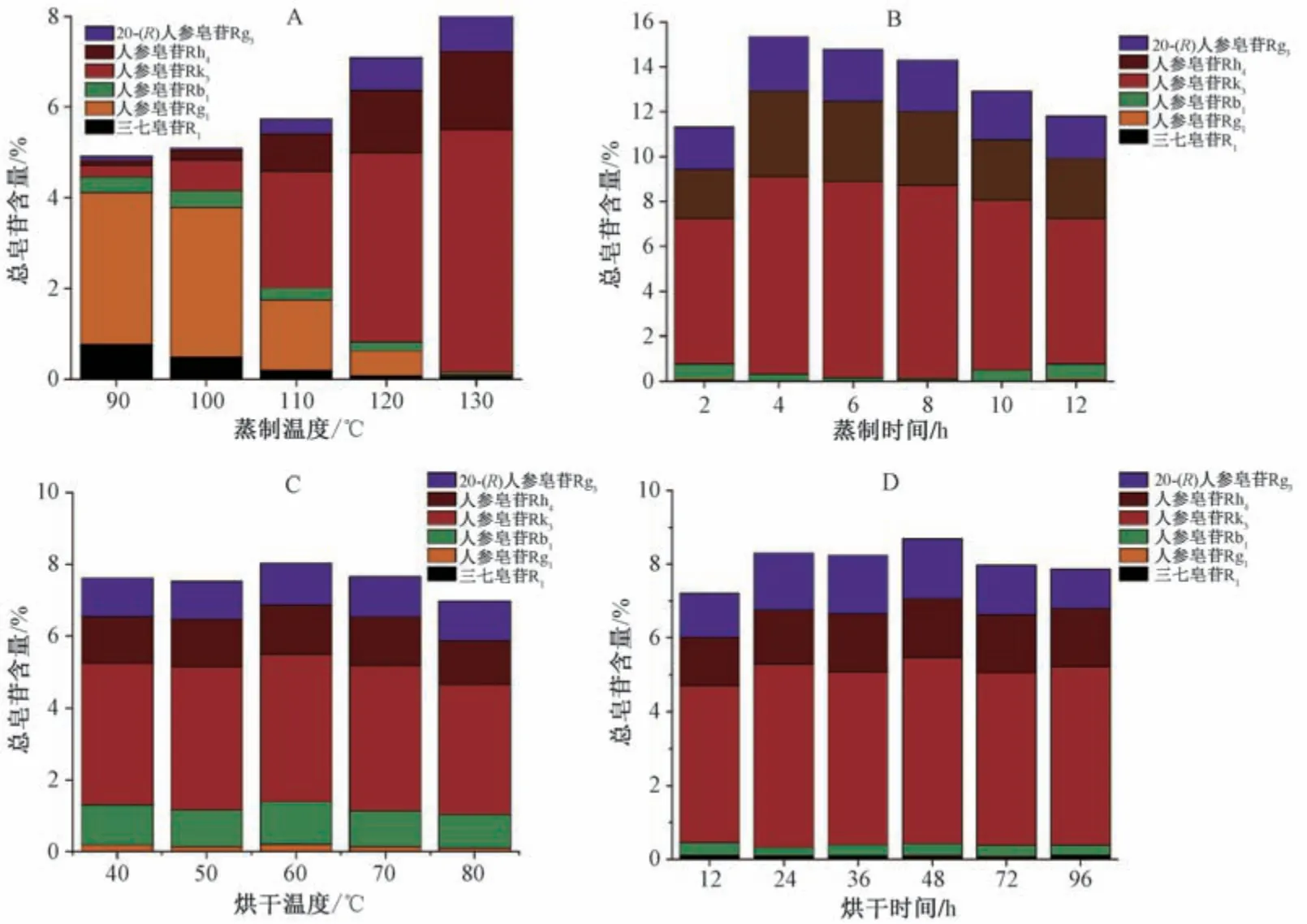
图1 各因素对总皂苷含量的影响Fig.1 Effects of various factors on total saponin content
2.3.2 蒸制时间 取鲜三七切片适量,置于高压灭菌锅中,固定蒸制温度130 ℃,烘干温度50 ℃,烘干时间48 h,测定蒸制时间0.5、1、2、4、6、8 h 时总皂苷含量,结果见图1B。由此可知,总皂苷含量随着蒸制时间延长先升后降,在4 h 时达到最大值,最终选择2~6 h 作为蒸制时间考察范围。
2.3.3 烘干温度 取鲜三七切片适量,置于高压灭菌锅中,固定蒸制温度130 ℃,蒸制时间4 h,烘干时间48 h,测定烘干温度40、50、60、70、80 ℃时总皂苷含量,结果见图1C。由此可知,总皂苷含量随着烘干温度增加先升后降,在60 ℃时达到最大值,最终选择50 ~70 ℃作为烘干温度考察范围。
2.3.4 烘干时间 取鲜三七切片适量,置于高压灭菌锅中,固定蒸制温度130 ℃,蒸制时间4 h,烘干温度50 ℃,测定烘干时间12、24、36、48、60、72 h 时总皂苷含量,结果见图1D。由此可知,总皂苷含量随着烘干时间延长先升后降,在48 h时达到最大值,最终选择24~60 h 作为烘干时间考察范围。
2.4 Box-Behnken 响应面法 参考文献[16] 报道,在单因素试验基础上,以蒸制时间(A)、烘干温度(B)、烘干时间(C) 为影响因素,总皂苷含量(Y) 为评价指标,设计三因素三水平共17组试验,因素水平见表1,结果见表2。
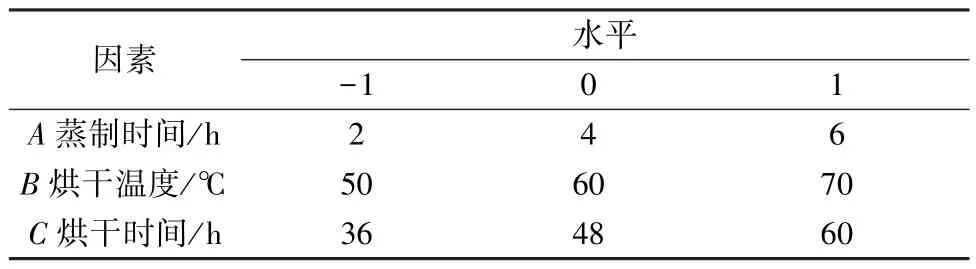
表1 Box-Behnken 响应面法因素水平Tab.1 Factors and levels for Box-Behnken response surface method
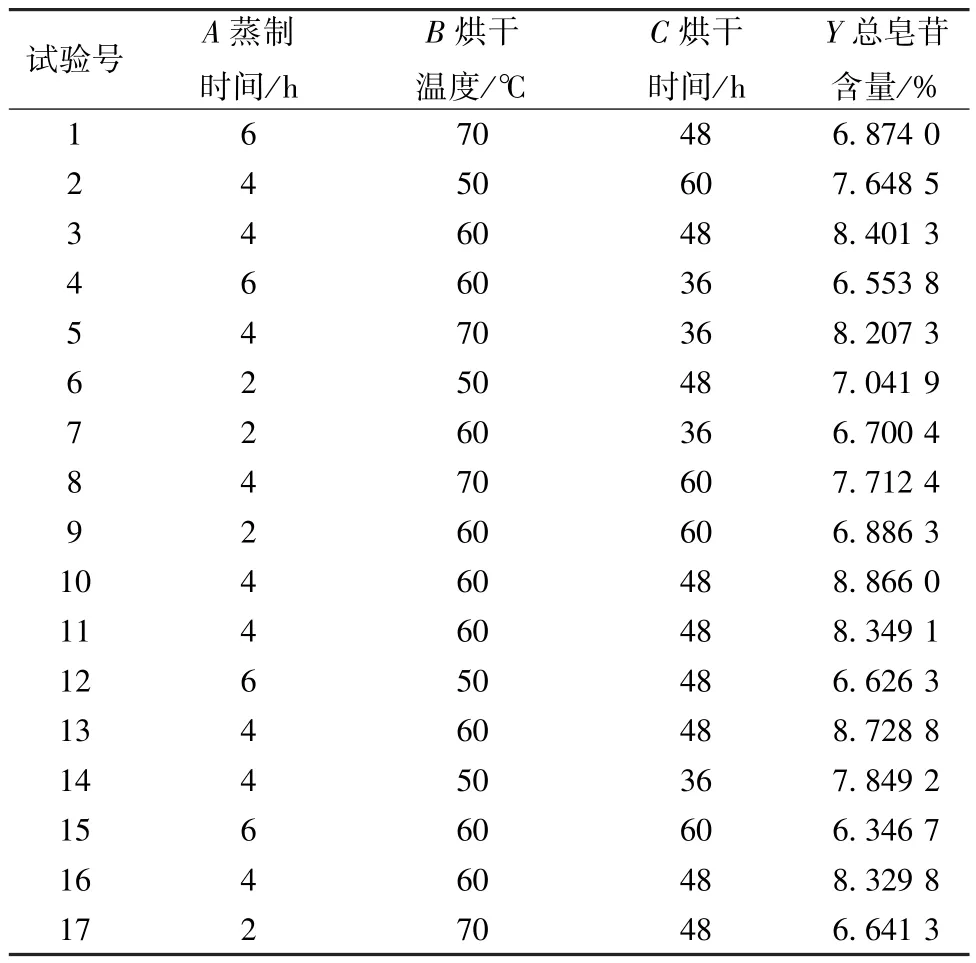
表2 Box-Behnken 响应面法设计与结果Tab.2 Design and results for Box-Behnken response surface method
采用Design-Expert 8.0.6 软件对表2 数据进行多元回归拟合,得方程为Y=8.54-0.11A+0.034B-0.09C+0.16AB- 0.098AC- 0.074BC- 1.49A2-0.25B2-0.43C2,方差分析见表3。由此可知,模型F=23.56,P=0.000 2,具有高度显著性; 失拟项F=0.72,P=0.591 8,决定系数R2=0.968 0,校正决定系数,表明拟合程度良好,相对误差小,可用于预测分析; 各因素影响程度依次为蒸制时间(A) >烘干时间(C) >烘干温度(B)。
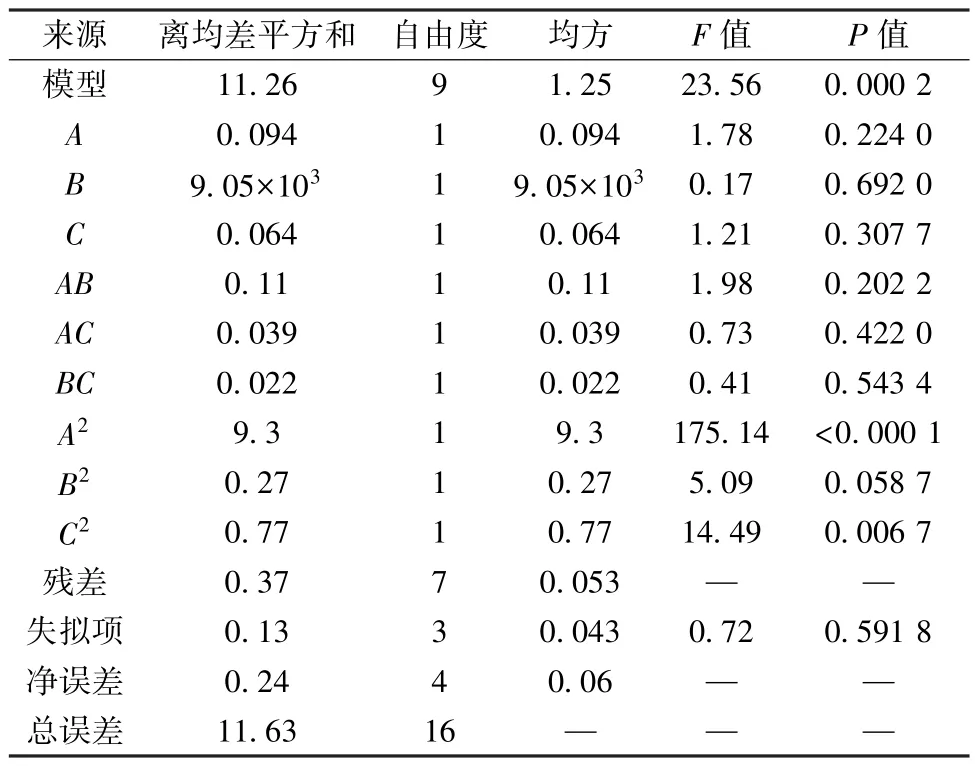
表3 方差分析结果Tab.3 Results for analysis of variance
响应面分析见图2。由此可知,随着蒸制时间延长、烘干温度增加,总皂苷含量先升后降,蒸制时间变化曲面比烘干温度陡峭,等高线沿前者方向的变化相对密集,对响应值峰值的影响更大; 蒸制时间变化曲面比烘干时间陡峭,表明前者对响应值峰值的影响大于后者; 烘干温度、烘干时间变化曲面坡度相差不大,两者交互作用不明显。
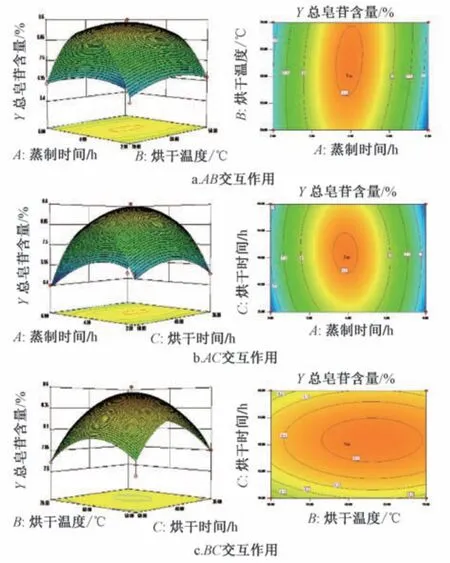
图2 各因素响应面图Fig.2 Response surface plots for various factors
最终确定,最优工艺为蒸制时间4.86 h,烘干温度62.27 ℃,烘干时间45.92 h,总皂苷含量为8.24%,为了便于后续操作,将其修正为蒸制时间4 h,烘干温度60 ℃,烘干时间48 h。取同一批鲜三七切片,按上述优化工艺进行3 批验证试验,测得总皂苷平均含量为8.326%,RSD 为0.087%,与预测值8.24%接近(相对偏差4.3%),表明该工艺稳定,重复性好,可操作性强。
2.5 红三七、熟三七总皂苷含量及其活性比较
2.5.1 总皂苷含量比较 HPLC 对照图谱见图3,含量测定结果见图4。由此可知,与熟三七比较,红三七能提高单体总皂苷含量; 红三七中三七皂苷R1,人参皂苷Rg1、Rb1、Rk3、Rh4,20 (R) -人参皂苷Rg3皂苷总含量为8.33%,较熟三七(7.40%) 提高了约12.5%,其中人参皂苷Rk3、20 (R) -人参皂苷Rg3作为补血活性的指标成分,在红三七中的含量明显升高,达7.42%,表明红三七加工工艺比熟三七加工工艺更具有合理性。

图3 熟三七与红三七HPLC 对照图谱Fig.3 HPLC reference chromatograms of steamed Notoginseng Radix et Rhizoma and red Notoginseng Radix et Rhizoma

图4 红三七、熟三七总皂苷含量比较Fig.4 Comparison of total saponin contents between red Notoginseng Radix et Rhizoma process and steamed Notoginseng Radix et Rhizoma
2.5.2 补血活性比较 参考文献[17] 报道,将90 只小鼠随机分为空白组,模型组,红三七高、中、低剂量组(1.2、0.6、0.3 g/kg),熟三七高、中、低剂量组 (1.2、0.6、0.3 g/kg),阳性组(30 mg/kg 复方阿胶浆),每组10 只,适应性饲养7 d 后,除空白组外其余各组小鼠腹腔注射环磷酰胺生理盐水0.1 mL/10 g (剂量0.08 g/kg),每天1 次,连续3 d。建模成功后,给药组小鼠分别灌胃给予相应药物,空白组、模型组小鼠灌胃给予生理盐水(0.2 mL/20 g),连续14 d。
末次给药24 h 后,采用摘眼球取血法将小鼠血液收集到无菌、含EDTA 的离心管中,检测血液白细胞 (WBC)、红细胞 (RBC)、血红蛋白(Hb)、血小板(PLT) 水平[18],结果见图5。由此可知,与空白组比较,模型组小鼠血液WBC、RBC、Hb、PLT 水平降低 (P<0.05,P<0.01),表明模型建立成功; 与模型组比较,红三七、熟三七各剂量组小鼠血液WBC、RBC、Hb、PLT 水平升高(P<0.05,P<0.01),表明两者具有补血活性,其中红三七高剂量组贫血关键性指标RBC、Hb 水平最高,与阳性组接近。
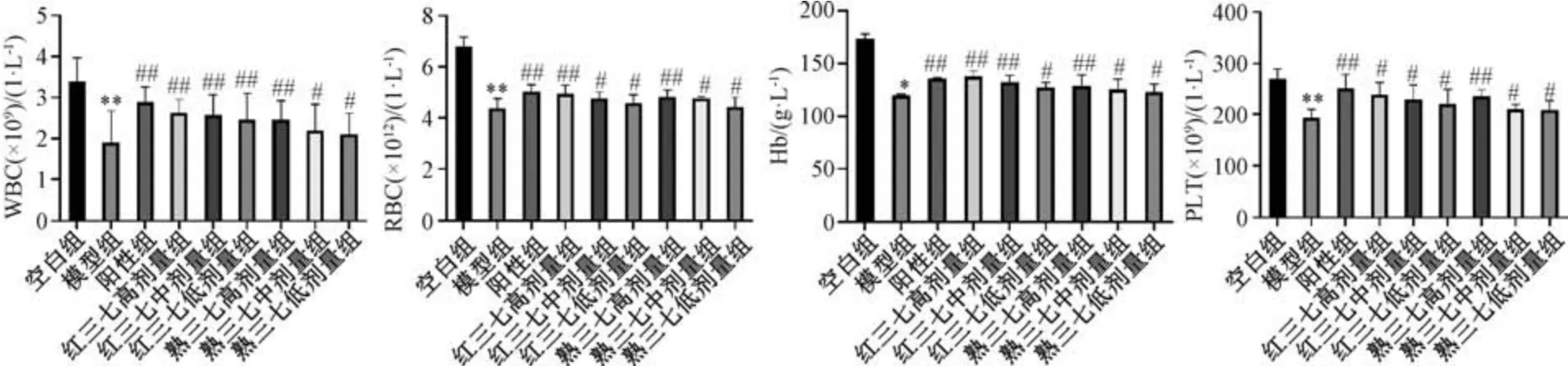
图5 红三七、熟三七对小鼠血常规的影响Fig.5 Effects of red Notoginseng Radix et Rhizoma and steamed Notoginseng Radix et Rhizoma on mouse blood routines
将小鼠颈椎脱臼处死,分离脾脏、胸腺,置于干净滤纸上,称定质量,计算脏器指数[19],结果见图6。由此可知,与模型组比较,红三七、熟三七各剂量组小鼠脾脏指数降低(P<0.05),胸腺指数升高(P<0.05),并且呈剂量依赖性; 在相同剂量下,红三七组对胸腺、脾脏指数的改善效果优于熟三七组,表明前者对小鼠免疫器官具有保护作用。
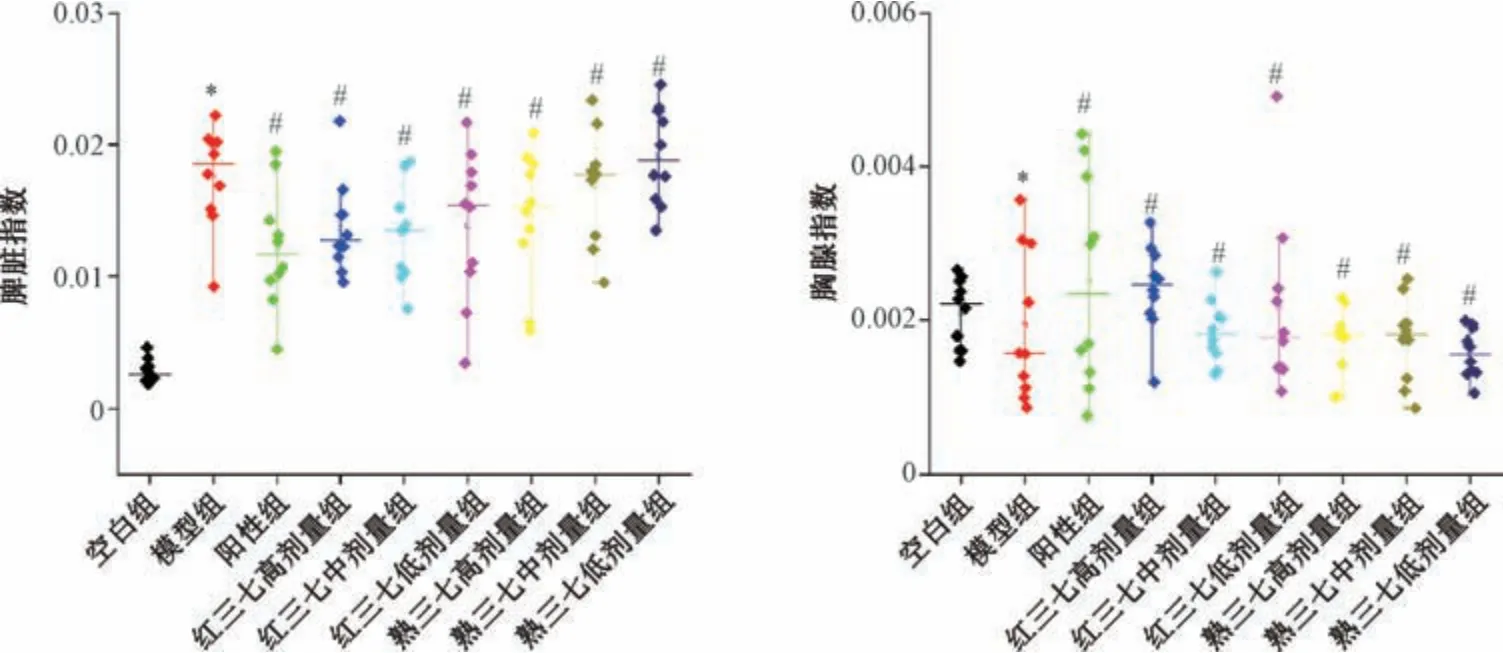
图6 红三七、熟三七对小鼠脏器指数的影响Fig.6 Effects of red Notoginseng Radix et Rhizoma and processing Notoginseng Radix et Rhizoma on mouse organ indices
3 讨论
红参是中药市场销售的主要人参炮制品,其大补元气的功效与炮制工艺密切相关,同时西洋参也开发出了相关产品[20]。三七作为我国传统名贵中药材,具有“生打熟补” 之说,生三七粉及其提取物中的三七总皂苷在预防和治疗心脑血管系统疾病方面得到了广泛应用[21-23],但熟三七补血作用很少得到开发,目前仅有粉剂 (包括药品和饮片)、丸剂等少数产品,炮制工艺为采用干三七打粉后蒸制,可能会因操作不当而影响疗效,导致其应用受限。本实验发现,通过类似于红参的炮制工艺对鲜三七进行加工炮制来开发出红三七饮片时,可提高人参皂苷Rk3、20 (R) -人参皂苷Rg3含量,提高其补血活性。
红三七加工工艺以鲜三七为原料进行高压蒸制,在产地直接进行处理,能减少传统加工炮制过程中新鲜药材的干燥环节,以及干燥后经水浸润再切片的浸泡环节,降低加工成本及药材耗损,是实现产地饮片加工一体化的有效途径。同时,趁鲜加工也可提高三七产地加工的工业化水平,是增加药材产区地方财政收入的有效途径和发展方向。

