补阳还五汤对脑缺血再灌注大鼠线粒体氧化损伤和PKCε-Nampt 通路的影响
尹美娟,刘真一,靳晓飞,周晓红,高 钰,赵月眸,高维娟
(河北中医学院,河北省心脑血管病中医药防治研究重点实验室,河北 石家庄 050091)
缺血性脑卒中的病理过程常发生脑缺血再灌注(ischemia reperfusion,IR) 损伤[1],其机制复杂,氧自由基的过度产生所引发的连锁反应是病情发生发展的核心环节[2]。线粒体是细胞的产能中心,I/R 产生的大量活性氧可使线粒体功能失调,导致细胞代谢障碍,甚至死亡[3-4]。
蛋白激酶Cε(protein kinase C epsilon,PKCε)是PKC 家族的丝氨酸/苏氨酸激酶的同种型,是维持线粒体功能和神经保护的重要信号通路[5]。烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,Nampt) 是PKCε 重要下游靶点,通过促进辅酶Ⅰ (nicotinamide adenine dinucleotide,NAD) 的合成、提高辅酶Ⅰ氧化型NAD+和还原型NADH 比值能保持线粒体的稳态,增强缺血性损伤后的神经元活力。当脑I/R 时,可激活ε减轻线粒体功能损伤[6]。此外,上调Nampt 表达可提高NAD+/NADH 的比值,减轻线粒体损伤,同时产生抗氧化应激作用[7]。由此可知,PKCε-Nampt 是减轻脑缺血再灌注线粒体损伤的重要通路。
补阳还五汤是治疗气虚血瘀型脑卒中的名方,具有补气活血通络之效[8]。本研究建立SD 大鼠大脑中动脉梗塞 (middle cerebral artery occlusion,MCAO) 模型,探索补阳还五汤减轻线粒体氧化损伤的作用和对PKCε-Nampt 通路的影响。
1 材料
1.1 动物 健康雄性SD 大鼠,体质量230~250 g,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号SCXK (京) 2021-0011,实验动物使用许可证号SYXK (冀) 2017-005],饲养温度、湿度适宜,适应性饲养7 d,自由摄食、饮水。所有实验过程都严格按照NIH 《实验动物的护理和使用指南》 进行,遵守实验动物护理原则,并经动物伦理委员会批准(伦理号DWLL2019025)。
1.2 试剂与药物 补阳还五汤(黄芪120 g,赤芍5 g,当归6 g,红花、桃仁、川芎、地龙各3 g,水煎剂浓缩至100 mL,质量浓度1.43 mg/L) 所用药材均购自北京同仁堂健康药业股份有限公司,其提取制备工艺、质量标准及使用剂量参照前期实验结果[9]。依达拉奉(货号P816062,上海麦克林生化科技股份有限公司)。PKCε抗体(货号sc-1681,美国 Santa Cruz 公司); p-PKCε 抗体 (货号GTX52352,美国GeneTex 公司); Nampt 抗体(货号EPR21980,英国Abcam 公司); MAP-2、βactin 抗体、二抗 (货号GB11128-2、GB15001、GB23301,武汉赛维尔生物科技有限公司);NAD+/NADH 检测试剂盒、线粒体膜电位(JC-1)试剂盒(货号S0175、C2003S,上海碧云天生物技术有限公司); 0.45 μm 聚偏二氟乙烯( polyvinylidene fluoride,PVDF ) 膜 ( 货 号IPVH00010,美国 Millipore 公司); 活性氧( reactive oxygen species,ROS )、丙 二 醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD) 试剂盒(货号E004-1-1、A003-1-2、A001-3-2,南京建成生物工程研究所有限公司)。
1.3 仪器 Fusion FX5 Spectra 多功能成像系统(法国Vilber 公司); 显微镜拍照系统、DM5000B正置荧光显微镜(德国Leica 公司)。
2 方法
2.1 大鼠局灶性脑I/R 损伤模型制备 采用栓线法,大鼠腹腔注射1%戊巴比妥钠(50 mg/kg) 进行麻醉,仰卧位固定于手术操作台上,消毒,备皮,在颈部正中开口,分离右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA) 及颈外动脉(external carotid artery,ECA),结扎ECA,用动脉夹夹闭CCA 与ICA,迅速于ECA 与ICA 分叉处作一切口,插入线栓沿颈内动脉到达大脑前动脉起始端,入栓深度20 mm 左右遇阻力停止,2 h 后轻轻拔出线栓,缝合伤口。
2.2 分组及给药 将大鼠随机分为假手术组、模型组、补阳还五汤组和依达拉奉组,假手术组仅分离血管,不插线栓,其余各组按“2.1” 项下方法进行造模。术后24 h,补阳还五汤组灌胃补阳还五汤14.3 g/kg[10-11],依达拉奉组腹腔注射依达拉奉3 mg/kg,假手术组和模型组灌胃等体积蒸馏水,每隔24 h 给药1 次,连续7 d,进行神经功能评分后处死取材。
2.3 Zea-longa 评分评价神经功能缺陷 按照随机双盲法原则,参照Zea-longa 评分标准进行评价[12-13],0 分,无神经损伤症状; 1 分,悬尾实验不能完全伸展对侧前爪; 2 分,向对侧转圈; 3 分,向对侧倾倒; 4 分,无自主活动或陷入深度昏迷中,1~3 分为造模成功。除假手术组外,其余各组0、4 分大鼠予以剔除,在后续实验中补充造模成功者以保证每组数量一致。
2.4 TTC 染色检测脑梗死体积百分比 大鼠麻醉后快速取出完整脑组织,冰冻20 min 后切成2 mm冠状切片,浸泡在TTC 染液中,放置在37 ℃恒温箱中避光孵育20 min,每10 min 翻动1 次。完成染色后,4%多聚甲醛固定过夜后拍照。采用Image J 图像分析软件计算大鼠脑梗死体积占总体积的百分比。
2.5 免疫荧光检测神经元标志物微管相关蛋白2(MAP-2) 表达 大鼠麻醉灌流后取出完整脑组织,经固定、石蜡包埋后切片,二甲苯脱蜡,梯度乙醇脱水,蒸馏水冲洗,封闭液室温封闭1 h,滴加一抗MAP-2 (1 ∶200) 4 ℃孵育过夜,洗涤后用Cy3 标记的山羊抗兔IgG 荧光抗体(1 ∶500) 室温孵育1 h,洗涤后用含DAPI 的抗荧光淬灭剂封片。通过荧光显微镜分别采集大鼠脑组织皮质缺血半暗带区域DAPI、MAP-2 图像,将2 种荧光图像融合,分析MAP-2 荧光强度,采用Image J 软件分析并计算平均光密度以评价神经元损伤情况。
2.6 脑组织氧化应激水平检测 大鼠麻醉后快速剥离出大脑皮层组织,置于PBS 缓冲液中匀浆,12 000×g离心20 min,按照各试剂盒说明书检测组织上清液中ROS、MDA 水平和SOD 活性。
2.7 脑组织线粒体膜电位检测 大鼠麻醉后快速剥离大脑皮层组织,采用线粒体分离试剂分离线粒体,加入JC-1 染色液进行染色,在激发波长490 nm、发射波长530 nm 下检测JC-1 单体,在激发波长525 nm、发射波长590 nm 下检测JC-1 聚集体,通过JC-1 聚集体与单体的相对比值表示线粒体膜电位。
2.8 修饰酶循环法检测脑组织NAD+/NADH比值 大鼠麻醉后快速剥离出大脑皮层半暗带组织,根据试剂盒说明书分别提取NAD+和NADH,采用荧光酶标仪测定其吸光度,计算两者比值。
2.9 Western blot 检测PKCε-Nampt 信号通路蛋白表达 大鼠麻醉后快速剥离出大脑皮层半暗带组织,加入裂解液研磨破碎,沉降、振荡、离心后采用BCA 法测定蛋白含量。蛋白经99 ℃加热变性后进行聚丙烯酰胺凝胶电泳,半干转法转移到PVDF膜上,5%脱脂奶粉溶液室温封闭2 h,一抗PKCε(1 ∶500)、p-PKCε(1 ∶1 000) 和Nampt (1 ∶1 000) 4 ℃孵育过夜,洗膜后加二抗室温孵育1 h,显影,成像,以β-actin 为内参,采用Image J 软件进行分析。
2.10 免疫组化检测p-PKCε和Nampt 蛋白表达大鼠麻醉灌流后取出完整脑组织,经固定、包埋后切片,浸泡在柠檬酸抗原修复缓冲液中,微波炉加热20 min 进行抗原修复,室温冷却后用PBS 洗涤,加双氧水消除内源性过氧化物酶,3% BSA 室温封闭1 h,一抗p-PKCε(1 ∶200) 和Nampt (1 ∶200) 4 ℃孵育过夜,PBS 洗涤后用辣根过氧化物酶(HRP) 标记的山羊抗兔IgG (1 ∶500) 室温孵育1 h,PBS 洗涤后滴加DAB 显色液,于显微镜下观察到棕黄色阳性表达时ddH2O 洗涤,苏木素复染细胞核,脱水,透明,中性树胶封片,在显微镜下观察大鼠脑组织皮质缺血半暗带区域并采集图片,采用Image J 软件分析并计算平均光密度以评价蛋白表达。
2.11 统计学分析 通过SPSS 20.0、GraphPad Prism 5.01 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,多重两两比较采用LSD-t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 补阳还五汤对MCAO 大鼠神经功能评分的影响 如图1 所示,假手术组无神经功能损伤,评分为0; 与假手术组比较,模型组Zea-longa 评分升高(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组Zea-longa 评分降低(P<0.05),并且前者低于后者(P<0.05)。
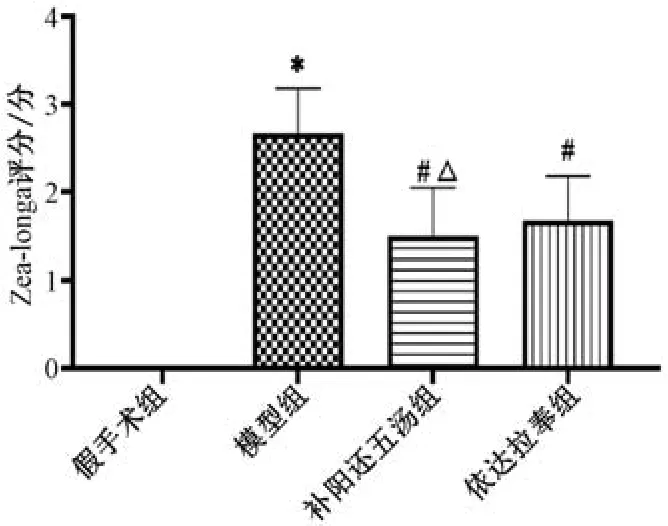
图1 补阳还五汤对MCAO 大鼠神经功能评分的影响(±s,n=6)Fig.1 Effects of Buyang Huanwu Decoction on neurological function score of MCAO rat models (±s,n=6)
3.2 补阳还五汤对MCAO 大鼠脑梗死体积的影响 如图2 所示,红色为无损伤脑组织,白色为脑梗死组织; 假手术组未见白色梗死区; 与假手术组比较,模型组脑组织可见明显白色梗死区,脑梗死体积百分比升高(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组脑组织梗死体积百分比降低(P<0.05),并且前者低于后者(P<0.05)。
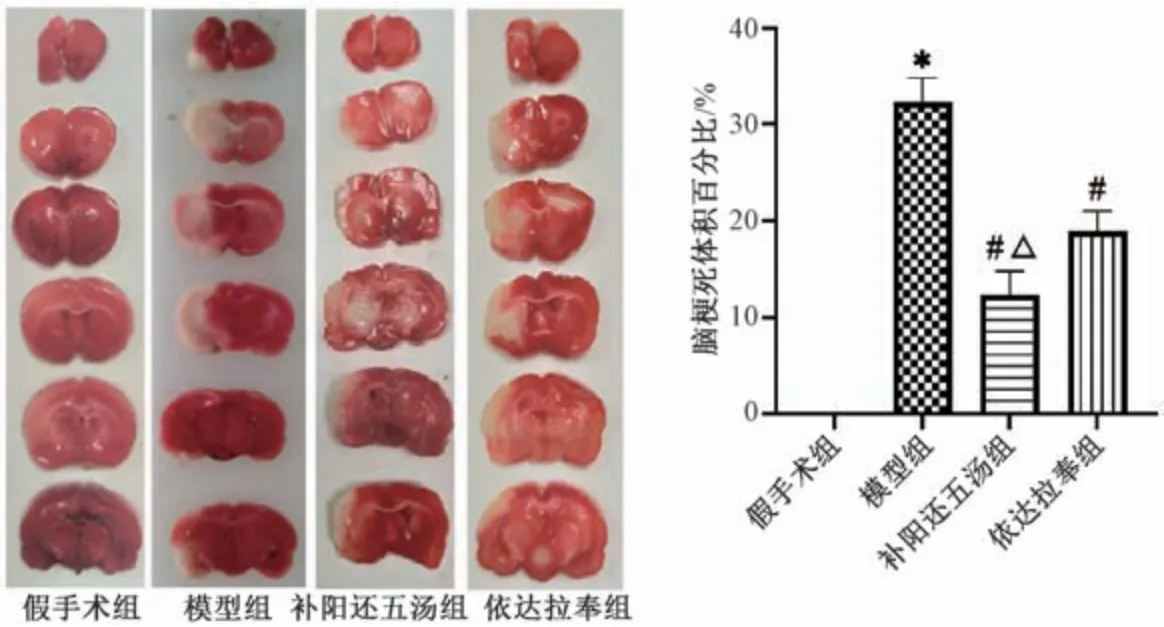
图2 补阳还五汤对MCAO 大鼠脑梗死体积的影响(±s,n=3)Fig.2 Effects of Buyang Huanwu Decoction on cerebral infarction volume in MCAO rat models (±s,n=3)
3.3 补阳还五汤对MCAO 大鼠脑组织MAP-2 表达的影响 MAP-2 是组成神经元细胞骨架的重要组成成分,存在于神经元的胞体、树突中,可作为神经元的标志物[14],通过免疫荧光观察MAP-2 在I/R 前后的表达变化情况,以此判定神经细胞的损伤程度。如图3 所示,与假手术组比较,模型组MAP-2 荧光强度减弱(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组MAP-2 荧光强度增强(P<0.05),并且前者高于后者(P<0.05)。

图3 补阳还五汤对MCAO 大鼠脑组织MAP-2 表达的影响(×400,±s,n=3)Fig.3 Effects of Buyang Huanwu Decoction on cerebral MAP-2 expression of MCAO rat models (×400,±s,n=3)
3.4 补阳还五汤对MCAO 大鼠脑组织线粒体膜电位的影响 如图4 所示,与假手术组比较,模型组大鼠缺血侧大脑皮质线粒体膜电位降低(P<0.05),提示线粒体去极化; 与模型组比较,补阳还五汤组和依达拉奉组可逆转该现象,其线粒体膜电位升高(P<0.05),2 组比较无明显差异(P>0.05)。
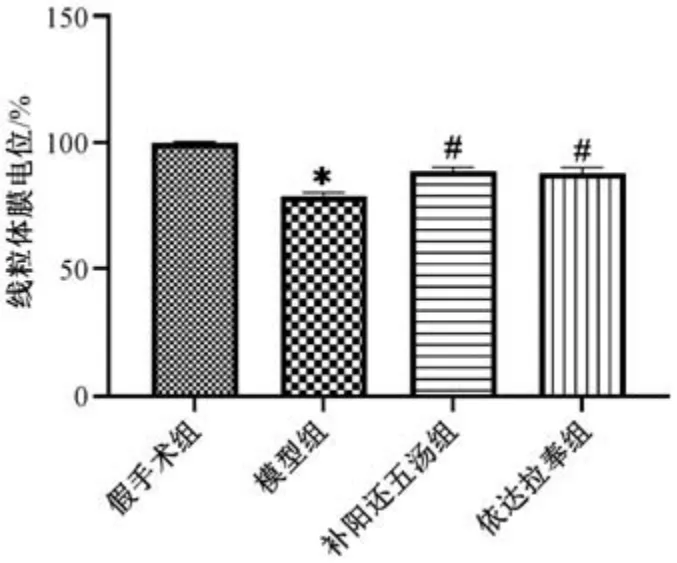
图4 补阳还五汤对MCAO 大鼠脑组织线粒体膜电位的影响(±s,n=3)Fig.4 Effects of Buyang Huanwu Decoction on cerebral mitochondrial membrane potential of MCAO rat models (±s,n=3)
3.5 补阳还五汤对MCAO 大鼠脑组织氧化应激水平的影响 如图5 所示,与假手术组比较,模型组ROS、MDA 水平升高(P<0.05),SOD 活性降低(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组ROS、MDA 水平降低(P<0.05),SOD 活性升高(P<0.05),2 组氧化应激水平比较无明显差异(P>0.05)。
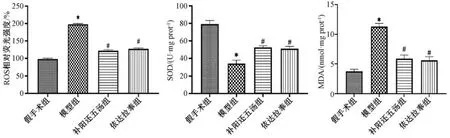
图5 补阳还五汤对MCAO 大鼠脑组织氧化应激水平的影响(±s,n=3)Fig.5 Effects of Buyang Huanwu Decoction on cerebral oxidative stress of MCAO rat models (±s,n=3)
3.6 补阳还五汤对MCAO 大鼠PKCε、p-PKCε、Nampt 蛋白表达的影响 如图6 所示,与假手术组比较,模型组PKCε、Nampt 蛋白表达降低(P<0.05),p-PKCε蛋白表达升高(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组PKCε、p-PKCε、Nampt 蛋白表达升高(P<0.05),并且前者p-PKCε、Nampt 蛋白表达高于后者(P<0.05),2 组PKCε蛋白表达比较无明显差异(P>0.05)。
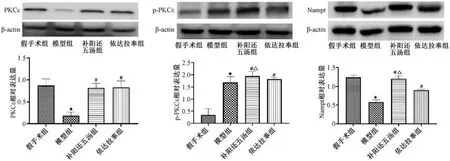
图6 补阳还五汤对MCAO 大鼠PKC ε、p-PKC ε和Nampt 蛋白表达的影响(±s,n=3)Fig.6 Effects of Buyang Huanwu Decoction on protein expressions of PKCε,p-PKCεand Nampt in MCAO rat models (±s,n=3)
3.7 补阳还五汤对MCAO 大鼠p-PKCε、Nampt 蛋白阳性表达的影响 如图7 ~8 所示,与假手术组比较,模型组p-PKCε 阳性表达升高(P<0.05),Nampt 阳性表达降低(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组p-PKCε、Nampt 阳性表达升高 (P<0.05),补阳还五汤组p-PKCε、Nampt 蛋白阳性表达高于依达拉奉组(P<0.05)。
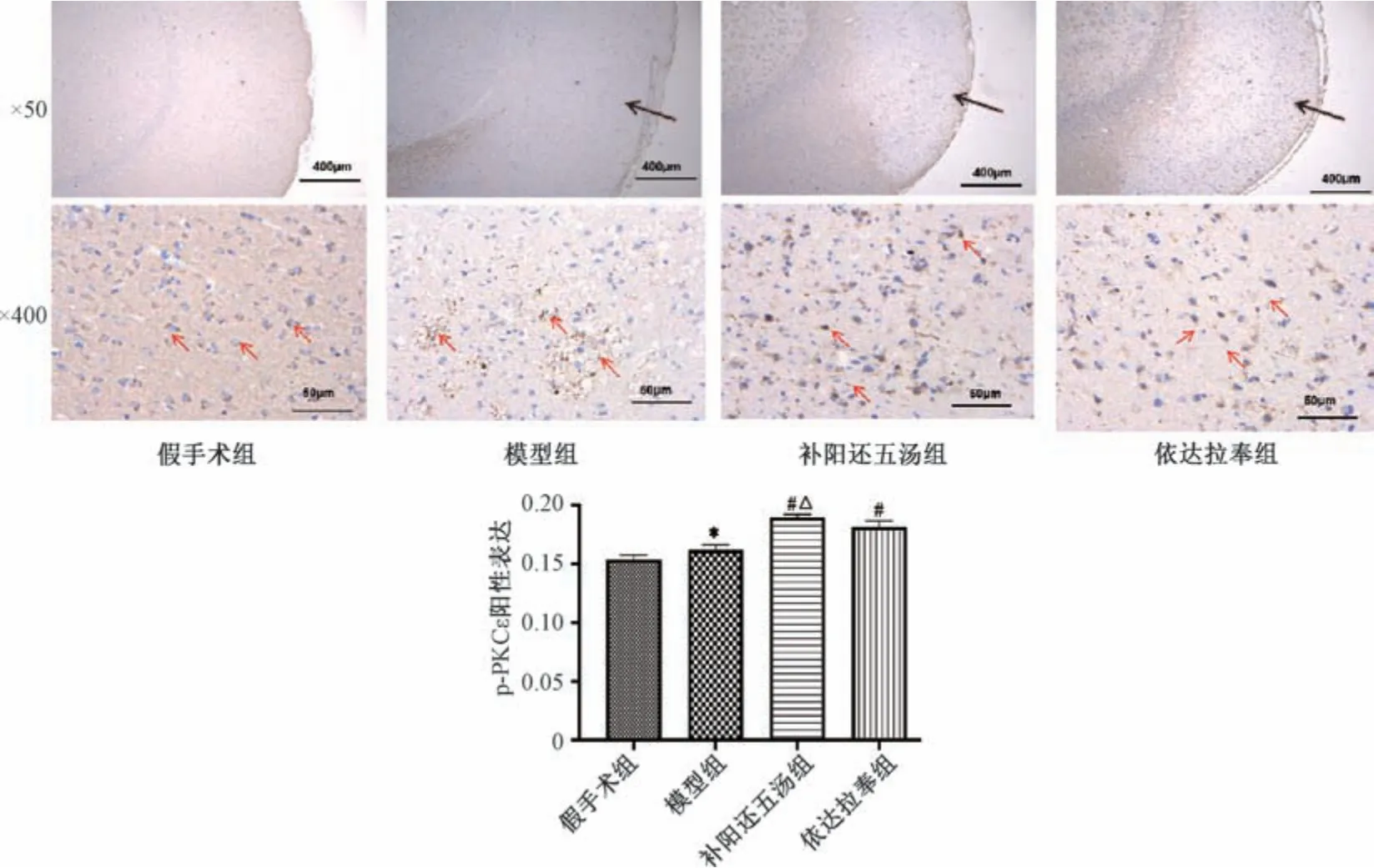
图7 补阳还五汤对MCAO 大鼠p-PKC ε表达的影响(±s,n=3)Fig.7 Effects of Buyang Huanwu Decoction on expression of p-PKC εin MCAO rat models (±s,n=3)

图8 补阳还五汤对MCAO 大鼠Nampt 表达的影响(±s,n=3)Fig.8 Effects of Buyang Huanwu Decoction on expression of Nampt in MCAO rat models (±s,n=3)
3.8 补阳还五汤对MCAO 大鼠脑组织NAD+/NADH 比值的影响 如图9 所示,与假手术组比较,模型组NAD+/NADH 比值降低(P<0.05); 与模型组比较,补阳还五汤组和依达拉奉组NAD+/NADH 比值升高(P<0.05),2 组比较无明显差异(P>0.05)。

图9 补阳还五汤对MCAO 大鼠脑组织NAD+/NADH 比值的影响(±s,n=3)Fig.9 Effects of Buyang Huanwu Decoction on cerebral NAD+/NADH ratio of MCAO rat models (±s,n=3)
4 讨论
脑I/R 损伤是急性缺血性脑卒中血流再通后发生的继发性损伤,再引发多种级联反应,而ROS大量产生是其主要病理环节。线粒体是ROS 主要产生场所,ROS 的大量生成可损伤线粒体,导致线粒体功能异常,而线粒体功能异常又会进一步促进ROS 生成,加重氧化应激,可见氧化应激损伤是导致I/R 后线粒体损伤的关键[15]。另外,ROS能破坏线粒体膜结构,造成线粒体损伤,最终导致细胞死亡。脂质是生物膜的重要组成[16],脂质损伤生成的MDA 可以在一定程度上体现ROS 对线粒体膜损伤的程度。SOD 是体内重要的抗氧化酶,线粒体所产生的ROS 主要由位于线粒体内的Mn-SOD 清除,SOD 活性可以体现线粒体的抗氧化能力。过度氧化应激损伤线粒体功能,导致线粒体膜电位下降,造成脑I/R 损伤。
PKCε是影响神经细胞生存和功能恢复,调节线粒体功能的重要靶点。当细胞能量充足时,PKCε处于失活状态,当脑I/R 损伤时,PKCε从胞浆向质膜移位,激活了PKCε的Ser-729 磷酸化位点,从而细胞中p-PKCε 增多[17]。NAD 是细胞内重要的调节因子,主要有2 种形式,即NAD+和NADH。在氧化还原反应中NAD+/NADH 比例的相对稳定可维持线粒体功能。Nampt 是生产NAD 的酶,对线粒体和神经功能起保护作用[18]。Nampt表达的增加会提高NAD+水平和NAD+/NADH 比例[19]。PKCε是Nampt 上游的重要蛋白,缺血时NAD+消耗过多,PKCε 可介导线粒体NAD+生成,维持线粒体DNA 完整性,减轻缺血性损伤[20]。由此可知,PKCε-Nampt 可通过提高线粒体NAD+/NADH 比例来保护神经功能。
中医学认为,缺血性脑卒中基本病机是气虚血瘀、脑脉阻滞[21]。益气活血能改善气血运行,使上达脑窍气血充足,从而发挥脑保护作用[22]。补阳还五汤能益气活血,是治疗气虚血瘀型脑卒中的经典方剂,全方重用黄芪补气,配伍活血化瘀药,共奏补气活血通络之效[23]。线粒体是细胞进行氧化反应和为细胞提供能量的主要场所,而中医中“元气” 具有调控全身气血的功能,两者均具有推动、激发生理活动的功能,恢复线粒体功能正体现补阳还五汤的补气活血功效。依达拉奉是一种自由基清除剂,是临床上治疗缺血性脑卒中的常用药,而氧自由基与线粒体损伤息息相关,故选择依达拉奉为阳性对照药[24]。本研究通过建立大鼠MCAO模型,以脑缺血2 h 再灌注7 d 模拟缺血性脑卒中损伤[25],给予补阳还五汤干预,发现该方可改善神经功能缺陷,减少脑梗死体积,提高MAP-2 表达,降低ROS 及MDA 水平,提高SOD 活性,减轻氧化应激损伤,恢复线粒体膜电位。进一步研究发现,补阳还五汤可提高PKCε、p-PKCε和Nampt蛋白表达,提高脑组织NAD+/NADH 比值。以上结果表明,补阳还五汤可以恢复线粒体功能降低氧化应激,减轻脑缺血再灌注损伤,其作用可能与激活PKCε-Nampt 通路有关。

