二氢杨梅素抑制黄嘌呤氧化酶生物活性综合评价与作用机制研究
姚元勇,张 萌,陈仕学
(铜仁学院材料与化学工程学院,铜仁市中药民族药现代化研究与开发利用重点实验室,贵州 铜仁 554300)
高尿酸血症作为常见的代谢性疾病之一,是引发多种潜在疾病的重要因素,如痛风、高血压、慢性肾病等[1-3]。目前,高尿酸血症的发生机制已相对明确,主要归因于人体内的黄嘌呤氧化酶(xanthine oxidase,XOD) 的生物催化作用。XOD 是一种专一性不高的黄素蛋白酶,广泛存在于生物体内,可有效催化黄嘌呤 (Xan) 或次黄嘌呤(Hxan),生成尿酸,且伴随着超氧阴离子(O2.-) 的生成[4]。因此,在针对治疗高尿酸血症医药研发方面,抑制XOD 生物活性与O2.-的清除成为研究者们的关注焦点之一[5-7]。
二氢杨梅素是一种双手性、富电子体系的多酚类化合物,主要存在于显齿蛇葡萄科藤本植物叶中,含量高达25%以上[8]。近年来,有关天然黄酮类化合物抑制XOD 生物活性的研究报道屡见不鲜,如2011 年,陈君课题组[9]报道了金银花中的黄酮类成分槲皮素和木犀草素对体外XOD具有较强的抑制作用。随后,张晶等[10]报道了多种黄酮类化合物单体,在体外XOD 生物活性抑制评价过程中,发现木犀草素、槲皮素、芹菜素和山柰酚均对XOD 具有较强的抑制作用,其中木犀草素IC50值为42.02 μmol/L,远小于别嘌呤醇(126.57 μmol/L)。
然而,有关天然手性小分子黄酮醇类化合物抑制XOD的研究工作报道相对较少,且作用机制尚不明确。因此,本实验以天然手性小分子黄酮醇类化合物--二氢杨梅素为研究对象,通过XOD 体外模型构建评价二氢杨梅素的抑制作用,再结合课题组前期有关二氢杨梅素的基础研究[11-14],分析二氢杨梅素抑制XOD 生物活性的作用机制。
1 材料
1.1 仪器 UV-759S 型紫外可见分光光度计(上海棱光技术仪器有限公司); YQ-020A 型超声清洗仪(上海易净超声波仪器有限公司); FA124 型电子天平(上海舜宇恒平科学仪器有限公司)。
1.2 试剂 黄嘌呤氧化酶(9.6 U/mg)、尿酸、黄嘌呤(分析纯,上海源叶生物科技有限公司); EDTA、磷酸、别嘌呤醇(分析纯,上海阿拉丁生化科技股份有限公司)。焦磷酸钠缓冲溶液 (0.1 mol/L) 为自制。水为二次蒸馏水。
2 方法
2.1 溶液配制 0.1 mol/L 焦磷酸钠缓冲溶液: 准确称量焦磷酸钠5.318 g、EDTA 0.017 5 g,置于200 mL 量瓶中,超声溶解于纯净水,定容至刻度,磷酸调pH 至7.5 或8.5,现用现配。
0.125 mg/mL 尿酸母液: 精密称取0.002 5 g 固体尿酸标准品,溶于20 mL 二次蒸馏水中。
不同梯度浓度尿酸标准溶液: 分别量取尿酸母液溶液0.2、0.4、0.6、0.8、1.0 mL,加水稀释至10 mL,配制成质量浓度分别为2.5、5、7.5、10、12.5 μg/mL 的尿酸溶液。
2.2 尿酸工作曲线绘制 采用紫外-可见分光光度计对不同梯度浓度的尿酸标准溶液进行光谱扫描,在290 nm 波长处对其吸光度进行测定。
曲线工作方程:Y=0.049 7X+0.005 7,R2=0.999 3。
2.3 黄嘌呤氧化酶生物活性体外测试模型构建 参考谢涛、史坤等[15-16]报道,在0.1 mol/L 焦磷酸钠缓冲溶液(0.4 mL,pH 7.5 或8.5) 中加入1.0 mmol/L Xan 溶液(1.0 mL),同时加入0.01 mg/mL XOD 溶液(1.6 mL),混匀,分别将反应体系置于37 ℃的水浴中恒温15 min,利用紫外可见分光光度计对测试样品进行全波长扫描,记录290 nm 波长处吸光度,参比液为2 mL 缓冲液+1 mL 1.0 mmol/L Xan 溶液。
2.4 黄嘌呤氧化酶体外活性抑制测试 参照“2.3” 项下方法,将不同浓度的待测溶液(0.4 mL) 和1.0 mmol/L Xan 溶液(1.0 mL) 依次加入反应器皿中,再加入0.01 mg/mL XOD 溶液(1.6 mL),混匀,水浴恒温37 ℃,作用15 min,采用紫外可见分光光度计作全波长扫描,记录290 nm 波长处吸光度,计算抑制率,参比液为0.4 mL 各浓度待测液+1.6 mL 缓冲液+1 mL 1.0 mmol/L Xan 溶液。
ΔA0,290为未加入抑制剂,290 nm 波长处的吸光度;ΔA1,290为加入抑制剂,290 nm 波长处的吸光度。
2.5 二氢杨梅素自氧化速率测试 量取0.5 mL 0.2 mg/mL二氢杨梅素溶液,转移至弱碱性(pH 7.5) 缓冲液(1.5 mL) 中,混匀,室温反应不同时间。随后,采用紫外可见分光光度计进行扫描,记录不同时间点325 nm 波长处吸光度,计算反应速率v。
ΔA1,325为二氢杨梅素自氧化作用不同时间点在325 nm波长处吸光度,ΔA0,325为二氢杨梅素在325 nm 波长处吸光度,t为反应作用时间。
2.6 数据分析 采用OriginPro 8.5 软件对数据进行线性或非线性回归法拟合。
3 结果
3.1 二氢杨梅素体外抑制黄嘌呤氧化酶生物活性评价 课题组前期研究发现,二氢杨梅素在碱性溶液中处于不稳定状态,易发生自氧化作用,导致自身分子结构骨架被破坏,从而可能丧失原有结构的生物活性特征[12]。因此,本实验进一步考察了不同碱性环境的黄嘌呤氧化酶体外测试模型对天然手性小分子二氢杨梅素生物活性的影响,采用pH 7.5 或8.5 的碱性环境体外黄嘌呤氧化酶测试模型,分别对不同浓度的二氢杨梅素和对照药别嘌呤醇抑制黄嘌呤氧化酶生物活性进行评价,并加以对比分析。结果表明,不同浓度的二氢杨梅素和对照药剂别嘌呤醇在pH 7.5 或8.5的碱性环境体外酶测试模型中,均可明显地观察到二氢杨梅素和别嘌呤醇对黄嘌呤氧化酶生物活性具有一定的抑制作用,且与药剂浓度在一定的范围内成正比关系,见图1。值的注意的是,不同浓度的别嘌呤醇在pH 7.5 或8.5 的碱性环境体外酶测试模型中呈现相近的抑制作用,说明碱性环境因素对别嘌呤醇的生物活性影响较小,可以忽略不计。然而,二氢杨梅素结果呈现出较大的差异性,不同浓度的二氢杨梅素药剂在pH 7.5 的碱性环境体外酶测试模型中生物活性抑制率最高可达48.47%,而且均高于在pH 8.5 的碱性环境中的所对应浓度药剂的抑制率。由此可知,碱性因素对二氢杨梅素抑制黄嘌呤氧化酶生物活性的影响较大,可直接导致其抑制率降低。
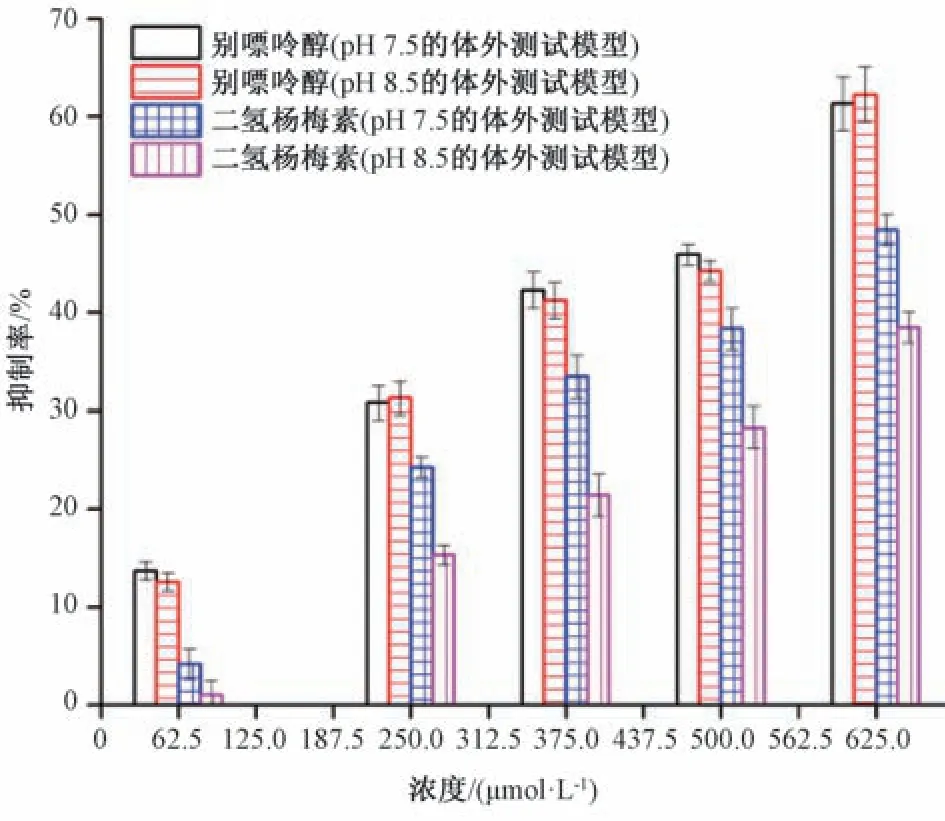
图1 碱性因素对二氢杨梅素的抑制作用的影响
3.2 二氢杨梅素碱性溶液中自氧化速率分析 结合课题组前期对二氢杨梅素在碱性溶液中自氧化作用机制研究发现,二氢杨梅素在不同碱性水溶液中的自氧化程度区别较大。因此,将0.5 mL 二氢杨梅素溶液(0.2 mg/mL) 分别转移至碱性(pH 7.5 或8.5) 缓冲液(1.5 mL) 中,室温作用0、0.5、1.0、1.5、2.0、3.0 min,并采用紫外光谱仪记录325 nm 波长处吸光度(二氢杨梅素自氧化特征峰,如图2a所示),从而考察其自氧化速率。结果表明,二氢杨梅素在pH 8.5 的碱性水溶液中各时间点自氧化速率总体上呈下降趋势,但均高于在pH 7.5 的碱性水溶液中,见图2b。由此说明,二氢杨梅素在pH 8.5 的碱性环境中自氧化程度较高,其分子结构变化速率相对较快,丧失自身原有分子结构的生物活性也相对较快,从而进一步佐证了相同浓度的二氢杨梅素药剂。另外,在pH 7.5 的碱性环境体外酶测试模型中作用相同时间时,表现出的生物活性抑制率较高。
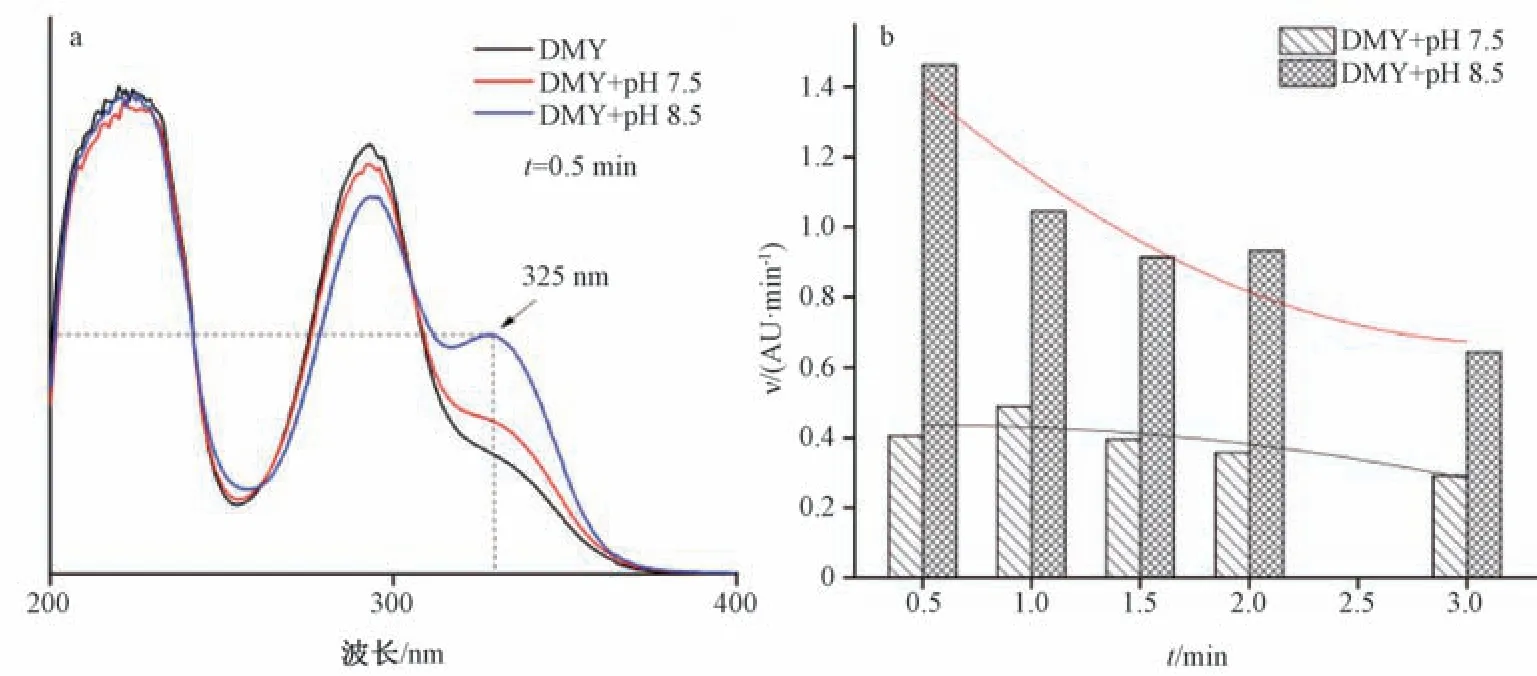
图2 二氢杨梅素在碱性环境中的自氧化速率
3.3 黄嘌呤氧化酶抑制作用机制分析 据报道,黄嘌呤氧化酶是由一个包含2 个铁硫中心的N 端结构域、一个黄素腺嘌呤二核苷酸辅基FAD 结构域和一个C 端的钼蝶呤蛋白结构域组成[17]。次黄嘌呤或黄嘌呤在C 端的钼蝶呤蛋白结构域中,发生氧化还原反应,生成相对应的黄嘌呤或尿酸,同时释放出自由电子(e-)。自由电子经N 端结构域中铁硫[2Fe-2S] 中心传递至FAD 结构域,此时,溶液中的游离氧分子(O2) 作为电子受体,在FAD 结构域中发生单电子还原反应,形成超氧阴离子自由基(O2.-) 或过氧化氢(H2O2),见图3。
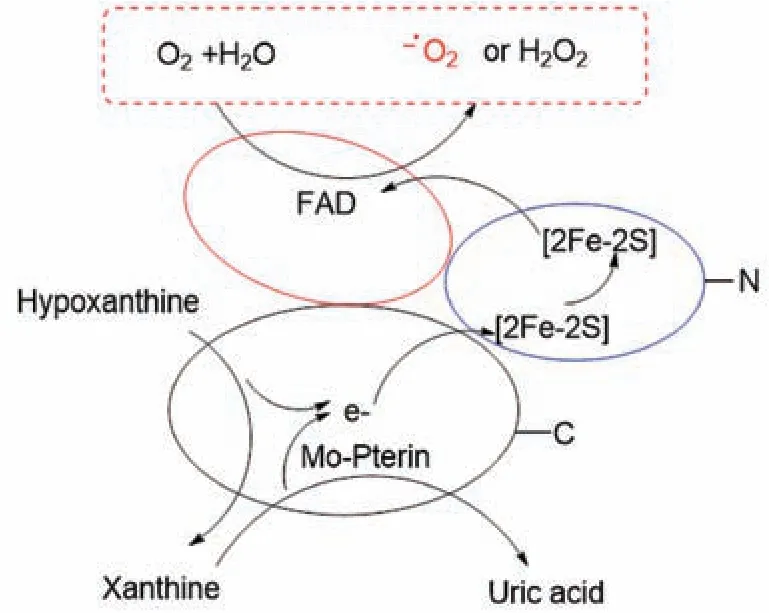
图3 黄嘌呤氧化酶生物催化次黄嘌呤或黄嘌呤过程
本实验进一步结合了课题组前期关于二氢杨梅素与超氧阴离子自由基的研究[14],证实了二氢杨梅素在清除超氧阴离子自由基能力方面表现良好,其原因在于其分子结构中C 环中手性C-H 的存在,对超氧阴离子自由基清除具有重大贡献。也就是说,二氢杨梅素与超氧阴离子自由基发生有效碰撞,C 环中手性3-C 上的氢原子与自由基发生串联式氧化还原反应,促进二氢杨梅素分子结构向杨梅素分子结构进行转化,该结论在课题组多项研究中被证实[11-12,14],见图4。
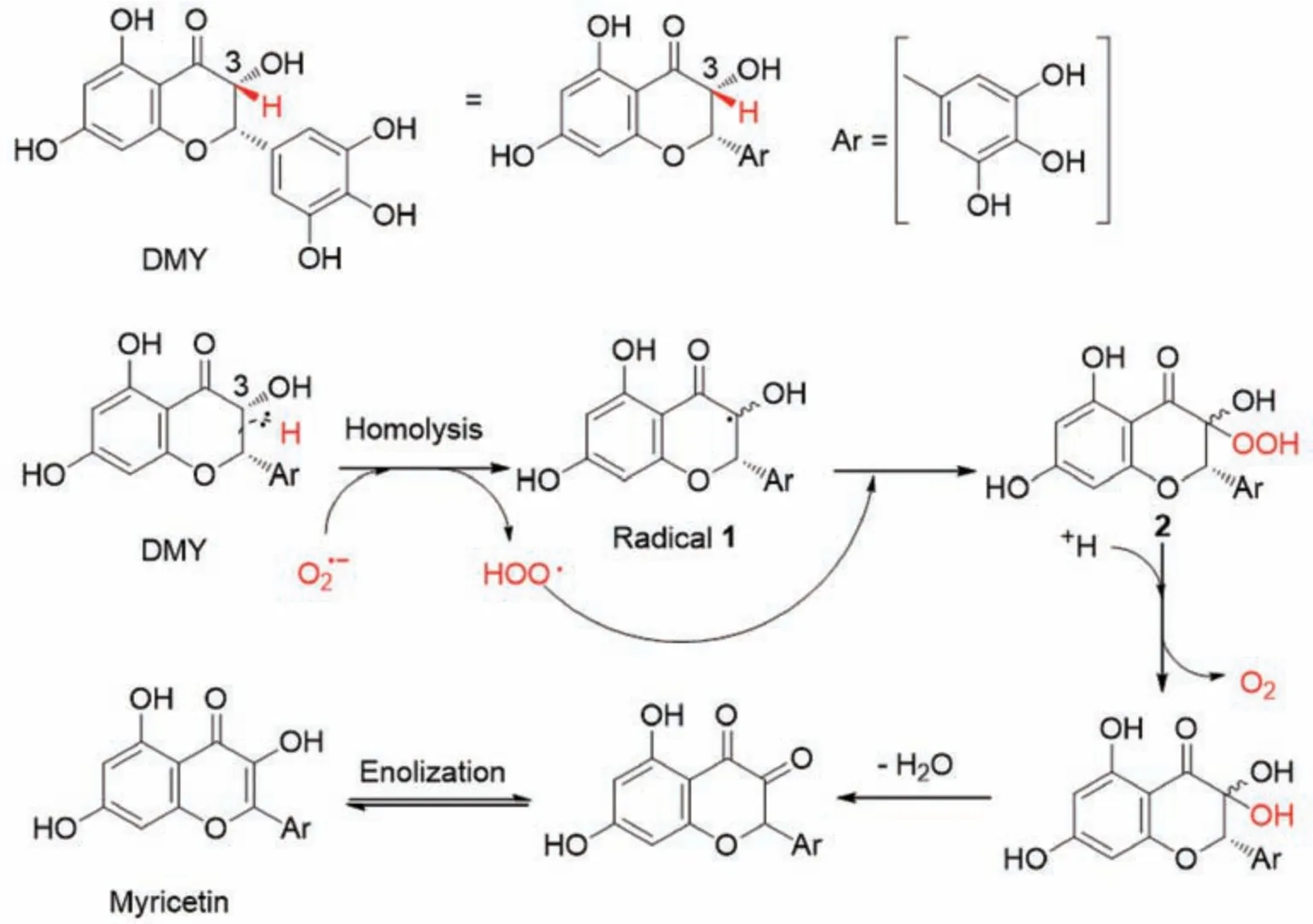
图4 二氢杨梅素在超氧阴离子自由基参与下转化为杨梅素过程
二氢杨梅素在黄嘌呤氧化酶体外测试模型中表现出的良好抑制活性,可能存在杨梅素分子结构的贡献。为了佐证杨梅素结构对黄嘌呤氧化酶生物活性抑制的贡献度,本实验采用二氢杨梅素、杨梅素及杨梅素与二氢杨梅素不同浓度配比混合物(nMY/nDMY),分别进行黄嘌呤氧化酶生物活性抑制体外测试。结果,在pH 7.5 碱性的黄嘌呤氧化酶体外测试模型中,单体二氢杨梅素或杨梅素在浓度为500 μmol/L 时,其抑制率分别为38.33%、89.89%,见图5。但当nMY/nDMY分别为5/495、10/490、15/485、20/480 和25/475 时,混合物浓度均为500 μmol/L,其对黄嘌呤氧化酶的生物活性抑制作用随着杨梅素含量的增加,呈递增趋势,其抑制率均高于相同浓度二氢杨梅素,低于相同浓度杨梅素。因此,杨梅素分子结构的存在对二氢杨梅素的抑制率提升具有一定的贡献度。
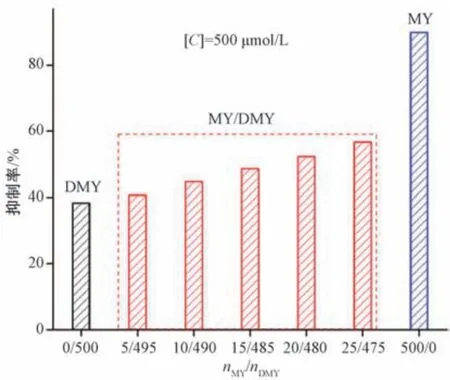
图5 二氢杨梅素与杨梅素混合药剂对黄嘌呤氧化酶的生物活性抑制作用
基于以上结果,本实验对二氢杨梅素在弱碱性环境中抑制黄嘌呤氧化酶生物活性的作用机制进行合理的分析,见图6。黄嘌呤氧化酶在生物催化次黄嘌呤或黄嘌呤过程中,生成尿酸并释放出超氧阴离子自由基(O2.-),二氢杨梅素在超氧阴离子自由基的作用下,可实现部分向杨梅素分子结构转化,形成二氢杨梅素和杨梅素的混合物。二氢杨梅素是非平面双手性分子结构,而杨梅素属于平面分子结构,因此该混合物在黄嘌呤氧化酶结合位点选择时,可能出现一定的差异性,形成协同作用,从而表现出高效的酶抑制作用,其抑制率高于相同浓度的单体二氢杨梅素。
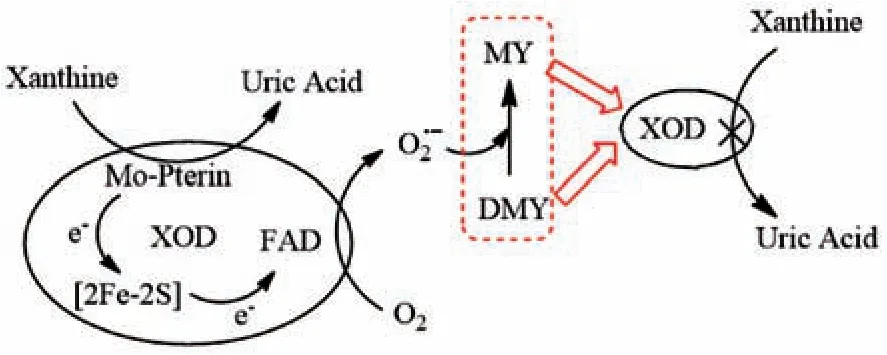
图6 二氢杨梅素抑制黄嘌呤氧化酶作用机制
3.4 构效关系分析 基于上述天然二氢杨梅素对XOD 活性抑制评价,本实验进一步探讨了以二氢杨梅素分子结构为基础的天然黄酮类化合物单体对XOD 活性抑制作用,并分析其构效关系。二氢杨梅素分子结构可分为3 个部分,A环上接入2 个酚羟基(分别位于5-和7-),并与C 环上的C=O 发生π-π 共轭作用。另外,C 环上羰基邻位碳属于手性碳原子,为R型,且连接1 个羟基,同时C 环上2-碳原子也属于R型手性碳原子,并与芳香B 环连接。在B 环上,3 个相邻的酚羟基分别位于3’-,4’-,5’-,并与苯环发生p-π 共轭作用。鉴于此结构特征,本实验选取了具有类似特征的黄酮类化合物单体杨梅素、槲皮素和山柰酚,探讨其与XOD 活性抑制构效关系。从分子结构上分析,相比二氢杨梅素分子结构而言,天然杨梅素分子结构近似于平面分子,其中,A、B、C 三环存在良好的π-π 共轭效应,且C 环上2,3-碳原子上氢原子因消除形成碳碳双键,见图7。槲皮素和山柰酚虽然也具有近似于平面的分子结构,但在其B 环上分布的官能团羟基数存在一定的差异性,它们分别为2 个羟基(3’-和3’-) 和1 个羟基(4’-)。在体外XOD 活性抑制评价方面,虽然杨梅素、槲皮素及山柰酚的XOD 活性抑制率在一定范围内存在浓度依赖性,但它们的IC50值存在显著差异性。杨梅素的IC50值为20.73 μmol/L,最大抑制率为91.33%; 槲皮素的IC50值为203.61 μmol/L,远高于杨梅素,说明B 环上3’-OH 对XOD 活性抑制具有显著贡献,见表1。另外,手性分子二氢杨梅素和平面分子山柰酚的最大抑制率分别为48.47%、12.76%,但未能计算出IC50值。由此可知,黄酮类分子结构趋近于平面状态有助于提高体外XOD 活性抑制作用,且其贡献度可能大于B环上羟基数的贡献度。

表1 黄酮类化合物XOD 活性抑制率及IC50
4 结论
二氢杨梅素作为天然手性黄酮醇类化合物,在分子结构上,具有独特的潜在生物活性特征。本实验以天然二氢杨梅素为研究对象,探究其在不同碱性环境中对黄嘌呤氧化酶的抑制作用,并进行科学的分析评价。另外,结合课题组前期关于二氢杨梅素与超氧阴离子自由基的研究成果,发现二氢杨梅素在超氧阴离子自由基的作用下可转化为杨梅素,进一步分析二氢杨梅素对黄嘌呤氧化酶生物活性抑制的作用机制,从而首次揭示了二氢杨梅素与杨梅素对黄嘌呤氧化酶生物活性抑制的具有协同增效作用。该研究可为研究天然手性小分子化合物抑制黄嘌呤氧化酶提供重要参考依据。

