浮小麦配方颗粒特征图谱及4种核苷类成分定量研究
王晓亚 杜微波 马智玲 张志强 沈建梅


摘 要: 為了实现浮小麦配方颗粒的质量控制和评价,采用高效液相色谱法,以Waters XSelect HSS T3(4.6 mm×250 mm,5 μm)为色谱柱,在甲醇-水为流动相、梯度洗脱、柱温为30 ℃、流速为1.0 mL/min、检测波长为260 nm的条件下,建立了浮小麦配方颗粒的特征图谱及4种核苷类成分的含量测定方法。共确定了13批浮小麦配方颗粒特征图谱中的8个共有峰,并全部获得指认,分别为尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、鸟苷、色氨酸、腺苷,各共有峰相对保留时间的RSD均小于2.0%。尿嘧啶、尿苷、鸟苷、腺苷分别在0.001 9~0.047 3 mg/mL、0.003 9~0.098 2 mg/mL、0.002 8~0.070 1 mg/mL、0.002 9~0.073 0 mg/mL范围内线性关系良好(r=1.000 0),平均加样回收率分别为99.0%、100.7%、101.2%、101.8%。所建立的核苷类成分含量测定方法准确、高效、重复性好,可用于浮小麦配方颗粒的质量控制。
关键词:
中药化学;浮小麦;配方颗粒;高效液相色谱法;特征图谱;核苷;含量测定
中图分类号:R284.1 文献标识码:A
DOI: 10.7535/hbgykj.2024yx01007
Characteristic chromatogram of Fructus Tritici Levis formula granules and quantitative study of four nucleosides
WANG Xiaoya1,2,3, DU Weibo1,2,3, MA Zhiling1,2,3,4, ZHANG Zhiqiang1,2,3, SHEN Jianmei1,2,3
(1Beijing Tcmages Pharmaceutical Company Limited, Beijing 101300,China; 2Traditional Chinese Medicine Formula Particles Key Technology National United Engineering Research Center, Beijing 101300,China; 3Beijing Chinese Medicine Formula Particles Engineering Technology Research Center, Beijing 101300,China; 4Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China)
Abstract:
In order to realize quality control and evaluation of Fructus Tritici Levis formula granules, a method of characteristic chromatogram of Fructus Tritici Levis formula granules and determination of four nucleosides was established by HPLC. The analysis was performed on Waters XSelect HSS T3 (4.6 mm×250 mm,5 μm) column with mobile phase consisted of methanol-water (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 30 ℃,and detection wavelength was set at 260 nm. The results show that there are 8 common peaks in 13 batches of Fructus Tritici Levis formula granules, and all of them were identified as uracil, cytidine, hypoxanthine, uridine, adenine, guanosine, tryptophan and adenosine. The RSD value of relative retention time of each common peak is less than 2.0%. Uracil, uridine, guanosine and adenosine show good linearity (r = 1.000 0) in the ranges of 0.001 9 ~ 0.047 3 mg/mL,0.003 9 ~ 0.098 2 mg/mL,0.002 8 ~ 0.070 1 mg/mL and 0.002 9 ~ 0.073 0 mg/mL respectively. The average recoveries were 99.0%, 100.7%, 101.2% and 101.8%. The established method for the determination of nucleoside components is accurate, efficient and reproducible. It can be used for the quality control of Fructus Tritici Levis formula granules.
Keywords:
chemistry of Chinese materia medica;Fructus Tritici Levis; formula granules; HPLC; characteristic chromatogram; nucleosides; determination
浮小麦为禾本科植物小麦Triticum aestivum L.的干燥轻浮瘪瘦果实,原植物在全国各地均作为农作物栽培,于夏季采收[1]。浮小麦味甘、性凉,具有止汗、退虚热的功效,用于阴虚发热、盗汗、自汗的治疗[2]。目前,关于浮小麦化学成分的研究较少,且主要集中在对其中的5-二十一烷基间苯二酚、亚油酸、棉籽糖、葡萄糖等成分的研究[1,3-5];此外,陈湘月等[6]从浮小麦中分离鉴定出鸟嘌呤核苷、腺嘌呤核苷、2′-脱氧腺嘌呤核苷等化合物。核苷是一类糖苷的总称,它的基本骨架由核糖或脱氧核糖与嘧啶碱或嘌呤碱缩合而成,天然来源的核苷根据碱基的不同,可分为嘧啶核苷、嘌呤核苷和其他核苷衍生物。核苷类是具有广泛生理活性的一类水溶性成分,是生物细胞维持生命活动的重要物质,参与DNA代谢过程,具有免疫调节、抗肿瘤、抗病毒、改善脑细胞代谢、镇静中枢神经等多种药理作用[6-10],其价值高、应用广泛,在药品、保健品和食品的开发中均发挥着显著作用[9-10]。植物来源核苷因其植物种类、产地等的不同,其组成及含量也存在显著差异。目前,已有较多文献报道了不同中药中核苷类成分的含量测定方法,但尚未见针对浮小麦中核苷类成分含量测定的研究报道。
特征图谱是一种多指标质量控制模式[11],能够较全面地反映中药化学成分信息,评价中药质量的均一性和稳定性[12-14]。浮小麦配方颗粒是用符合炮制规范的浮小麦饮片为原料,以水为溶媒经现代工艺加工制成,因此建立以水溶性成分为指标的质量控制体系更符合其水提取的特性[15-16]。目前,浮小麦配方颗粒尚无统一的质量标准。基于此,本研究采用高效液相色谱法(HPLC)测定浮小麦配方颗粒中尿嘧啶、尿苷、鸟苷和腺苷4种成分的含量,并同时建立特征图谱,为浮小麦配方颗粒的核苷类成分研究及整体质量控制提供技术支持。
1 仪器与试药
1.1 仪 器
Waters e2695高效液相色谱仪、2489 UV/Vis Detector检测器、Empower 色谱工作站,均由沃特世科技(上海)有限公司提供;ME104E电子天平、XP26电子天平,均由梅特勒-托利多科技(中国)有限公司提供;JY2002电子天平,由上海舜宇恒平科学仪器有限公司提供;BSA124S电子天平、BT25S电子天平,均由北京赛多利斯科技仪器有限公司提供;KQ-500DB超声波清洗器,由昆山市超声仪器有限公司提供。
1.2 试药及试剂
尿苷对照品(批号为110887-202104)、鸟苷对照品(批号为111977-201501)、腺苷对照品(批号为110879-201703)、色氨酸对照品(批号为140686-202205)、腺嘌呤对照品(批号为110886-201102)、次黄嘌呤对照品(批号为140661-202005),均由中国食品药品检定研究院提供;浮小麦对照药材(批号为DST201125-025),由德思特生物科技有限公司提供;胞嘧啶核苷(简称胞苷)对照品(批号为AF21041451),由成都埃法生物科技有限公司提供;浮小麦配方颗粒(批号为K386CP01、K386CP02、K386CP03、19033122、19033091、21027452、21029211、2007134、20042581、20016541、20039812、21029201、21011651,依次用S1—S13表示),由北京康仁堂药业有限公司提供。甲醇,色谱纯,由德国默克公司提供;蒸馏水,由广州屈臣氏食品饮料有限公司提供;甲醇,分析纯,由国药集团化学试剂有限公司提供。
2 特征图谱建立
2.1 色谱条件
色谱柱为Waters XSelect HSS T3(4.6 mm×250 mm,5 μm);以甲醇為流动相A,以水为流动相B,按表1中所示进行梯度洗脱,流动相比例按照体积分数计算;柱温为30 ℃;流速为1mL/min;进样量为5~10 μL。
利用二极管阵列检测器对供试品溶液进行3D全扫描,结果显示波长为260 nm左右时供试品的特征图谱信息较丰富,各色谱峰吸收较强,优于其他波长,故确定检测波长为260 nm,见图1。
2.2 对照药材及对照品溶液的制备
取浮小麦对照药材粉末约1.0 g,置于具塞锥形瓶中,精密加入10%(体积分数,下同)甲醇20 mL,密塞,超声处理(功率为250 W,频率为40 kHz)20 min,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
另取尿苷、鸟苷对照品适量,精密称定,加10%甲醇制成每1 mL含尿苷10 μg、鸟苷7 μg的混合溶液,作为对照品参照物溶液。
另取尿嘧啶、胞苷、次黄嘌呤、腺嘌呤、色氨酸、腺苷对照品适量,精密称定,分别加10%甲醇,制成每1 mL分别含尿嘧啶5 μg、胞苷55 μg、次黄嘌呤55 μg、腺嘌呤55 μg、色氨酸5 μg、腺苷7 μg的溶液,即得各自对照品溶液。
2.3 供试品溶液的制备
2.3.1 提取溶剂考察
取浮小麦配方颗粒(批号为K386CP02)适量,研细,取约1.0 g,精密称定,置于具塞锥形瓶中,分别精密加入10%、50%、70%、100%的甲醇和20 mL水,密塞,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,取出,放冷,再称定质量,用相应的溶剂补足减失的质量,摇匀,滤过,取续滤液,即得。按“2.1”项的色谱条件测定,结果表明,除甲醇外,其他提取溶剂的提取效率相差不大,结合含量测定结果,水、10%甲醇和50%甲醇的提取效果最好,但以水做溶剂,溶液稳定性较差,且对色谱柱损害较大,从低毒性方面考虑,故最终选择10%甲醇作为提取溶剂。结果详见表2和图2。
2.3.2 提取浓度考察
分别取浮小麦配方颗粒(批号为K386CP02)约1.0、0.5、1.0 g,精密称定,置于具塞锥形瓶中,分别精密加入10%甲醇20、20、15 mL,密塞,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,取出,放冷,再称定质量,分别用10%甲醇补足减失的质量,摇匀,滤过,即得。按“2.1”项的色谱条件进行检测,并测定各峰峰面积,考察不同浓度对特征图谱的影响。结果表明,不同提取浓度的提取效率差异不大。为保证溶液提取完全,峰面积大小适中,选择0.050 g/mL作为提取质量浓度。具体结果见表3、表4和图3。
2.3.3 提取时间考察
取浮小麦配方颗粒6份(批号为K386CP02),每份约1.0 g,分为3组,精密称定,置于具塞锥形瓶中,分别精密加入10%甲醇20 mL,密塞,称定质量,分别超声处理(功率为250 W,频率为40 kHz)20、30、40 min,取出,放冷,再称定质量,分别用10%甲醇补足减失的质量,摇匀,滤过,即得。按“2.1”项的色谱条件进行检测,并考察不同提取时间对于特征图谱的影响。结果表明,超声提取20 min即可提取完全,为节约能耗,选择超声20 min作为提取时间。具体结果见表5和图4。
综上,可确定供试品溶液的制备方法:取浮小麦配方颗粒适量,研细,取约1.0 g,精密称定,置于具塞锥形瓶中,精密加入10%甲醇20 mL,密塞,超声处理(功率为250 W,频率为40 kHz)20 min,取出,放冷,再称定质量,用10%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 精密度考察
取同一供试品溶液,连续6次进样测定,以峰4(尿苷)为S1峰,计算峰1、峰2、峰3与S1的相对保留时间及相对峰面积;以峰6(鸟苷)为S2峰,计算峰5、峰7、峰8与S2的相对保留时间及相对峰面积;并分别计算RSD。各特征峰的相对保留时间RSD为0.0%~0.1%、相对峰面积RSD为1.5%~3.8%时,表明该仪器精密度良好。
2.4.2 重复性试验
取浮小麦配方颗粒6份,按照“2.3”项方法制备供试品溶液并测定,获得特征图谱,以峰4(尿苷)为S1峰,计算峰1、峰2、峰3与S1的相对保留时间及相对峰面积;以峰6(鸟苷)为S2峰,计算峰5、峰7、峰8与S2的相对保留时间及相对峰面积;并分别计算RSD。结果显示,各特征峰的相对保留时间RSD为0.0%~0.4%,相对峰面积RSD为0.3%~5.4%,表明该方法重复性良好。
2.4.3 稳定性试验
取同一供试品溶液,分别于0、2、4、8、12、18、24 h进样测定,获得特征图谱,以峰4(尿苷)为S1峰,计算峰1、峰2、峰3与S1的相对保留时间及相对峰面积;以峰6(鸟苷)为S2峰,计算峰5、峰7、峰8与S2的相对保留时间及相对峰面积;并分别计算RSD。结果显示,各特征峰的相对保留时间RSD为0.0%~0.6%,相对峰面积RSD为4.1%~7.7%,说明供试品溶液在24 h内稳定性良好。
2.5 特征图谱的建立
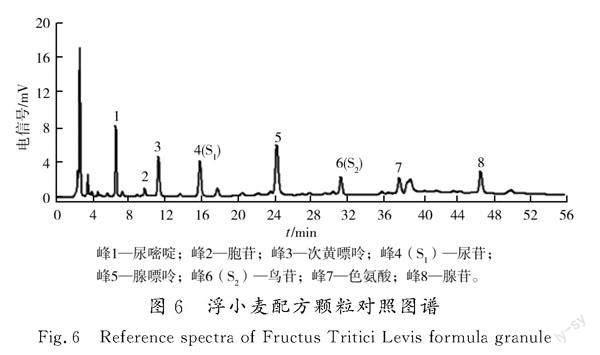
分别制备13批浮小麦配方颗粒的供试品溶液,将供试品溶液与依据“2.2”项制备的各对照品溶液按“2.1”项的色谱条件进行检测,并记录色谱图,将所得数据导入“中药色谱指纹图谱相似度评价系统(2012版)”软件,采用多点校正对色谱峰自动匹配,结果见图5。采用中位数法计算得出样品特征图谱的共有模式,共确定8个共有峰,详见图6。利用对照品确定峰1为尿嘧啶、峰2为胞苷、峰3为次黄嘌呤、峰4为尿苷、峰5为腺嘌呤、峰6为鸟苷、峰7为色氨酸、峰8为腺苷,见图7。与尿苷参照物峰相对应的峰为S1峰,计算峰1、峰2、峰3与S1的相对保留时间;与鸟苷参照物峰相对应的峰為S2峰,计算峰5、峰7、峰8与S2的相对保留时间。各共有峰的相对保留时间RSD为0.1%~0.6%,且波动较小(均在均值的-1.2% ~ 1.6%)。因此,可将各共有峰相对保留时间的均值作为浮小麦配方颗粒特征图谱的规定值,规定值为0.42(峰1)、0.63(峰2)、0.71(峰3)、0.78(峰5)、1.20(峰7)、1.49(峰8)。其相对保留时间应在规定值的±10%之内。
3 含量测定
3.1 对照品溶液的制备
取尿嘧啶、尿苷、鸟苷、腺苷对照品适量,精密称定,加10%甲醇制成每1 mL含尿嘧啶5 μg、尿苷10 μg、鸟苷7 μg、腺苷7 μg的混合溶液,即得。
3.2 色谱条件
同“2.1”项的色谱条件。
利用二极管阵列检测器对对照品溶液进行3D全扫描,结果如图8—图11所示。
图中显示尿嘧啶、尿苷、鸟苷、腺苷分别在258.0、262.0、253.0、260.0 nm左右有最大吸收,综合考虑选择260.0 nm作为检测波长。
3.3 供试品溶液的制备
3.3.1 提取溶剂考察
取浮小麦配方颗粒(批号为K386CP02)适量,研细,取约1.0 g,精密称定,置于具塞锥形瓶中,分别精密加入10%、50%、70%、100%的甲醇和20 mL水,密塞,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,取出,放冷,再称定质量,用相应的溶剂补足减失的质量,摇匀,滤过,取续滤液,即得。按“3.2”项的色谱条件进行检测。结果表明,除100%甲醇外,不同提取溶剂对4种成分的提取效果差异不大,水和10%甲醇的提取效果最好,但以水做溶剂进行考察时,发现溶液久置易产生沉淀,稳定性、重复性难以达到要求,且对色谱柱损害较大,故最终选择10%甲醇作为提取溶剂。具体结果见表6。
3.3.2 提取质量浓度考察
取浮小麦配方颗粒(批号为K386CP02)6份,分为3组,分别取約1.0、0.5、1.0 g,精密称定,置于具塞锥形瓶中,3组分别精密加入10%甲醇20、20、15 mL,密塞,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,取出,放冷,再称定质量,分别用10%甲醇补足减失的质量,摇匀,滤过,即得。按“3.2”项的色谱条件进行检测。结果表明,不同提取浓度下测得4种成分含量的结果差异不大。为保证溶液提取完全,峰面积大小适中,选择0.050 g/mL作为提取质量浓度。结果见表7。
3.3.3 提取时间考察
取浮小麦配方颗粒(批号为K386CP02)6份,每份约1.0 g,分为3组,精密称定,置于具塞锥形瓶中,分别精密加入10%甲醇20 mL,密塞,称定质量,分别超声处理(功率为250 W,频率为40 kHz)20、30、40 min,取出,放冷,再称定质量,分别用10%甲醇补足减失的质量,摇匀,滤过,即得。按“3.2”项的色谱条件进行检测。结果表明,不同提取时间的含量测定结果差异不大,故选择超声20 min作为提取时间。结果见表8。
综上,可确定供试品溶液的制备方法:取浮小麦配方颗粒适量,研细,取约1.0 g,精密称定,置于具塞锥形瓶中,精密加入10%甲醇20 mL,密塞,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,放冷,再称定质量,用10%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
3.4 方法学考察
3.4.1 线性关系考察
分别取尿嘧啶、尿苷、鸟苷、腺苷对照品适量,精密称定,加10%甲醇制成每1 mL含尿嘧啶5.13 μg、尿苷9.79 μg、鸟苷6.62 μg、腺苷7.03 μg的混合对照品母液,作为线性1;分别精密吸取母液1 mL,置于2、5、10、25 mL容量瓶中,加10%甲醇定容至刻度,摇匀,滤过,依次作为线性2—线性5的对照品溶液。精密吸取上述线性1—线性5的续滤液10 μL,注入高效液相色谱仪,按“3.2”项的色谱条件测定。以尿嘧啶色谱峰的峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,求得尿嘧啶的回归方程为y=42 211 713.873 3x+2 602.991 0,r=1.000 0,其线性范围为0.001 9~0.047 3 mg/mL;尿苷的回归方程为y= 22 752 686.126 6x-3 822.758 9,r=1.000 0,线性范围为0.003 9~0.098 2 mg/mL;鸟苷的回归方程为y=24 523 494.167 4x -4 176.090 7,r=1.000 0,线性范围为0.002 8~0.070 1 mg/mL;腺苷的回归方程为y=31 375 692.877 0x - 5 674.739 2,r=1.000 0,其线性范围为0.002 9~0.073 0 mg/mL。
3.4.2 重复性试验
取同一供试品(批号为K386CP02),按“3.3”项的方法平行制备6份供试品溶液,并按“3.2”项的色谱条件进样测定,计算得到尿嘧啶平均质量分数为0.089 mg/g,RSD为0.9%;尿苷平均质量分数为0.189 mg/g,RSD为0.7%;鸟苷平均质量分数为0.125 mg/g,RSD为1.3%;腺苷平均质量分数为0.146 mg/g,RSD为1.1%。表明该方法重复性良好。
3.4.3 稳定性试验
取同一供试品溶液,按“3.2”项的色谱条件,分别于0、2、4、8、12、18、24 h进样测定,并记录尿嘧啶、尿苷、鸟苷和腺苷峰面积的变化情况,24 h内尿嘧啶、尿苷、鸟苷和腺苷峰面积的RSD分别为1.3%、1.6%、1.9%和1.8%,表明供试品溶液在24 h内稳定性良好。
3.4.4 加样回收率试验
分别取尿嘧啶、尿苷、鸟苷、腺苷对照品适量,精密称定,加10%甲醇制成每1 mL含尿嘧啶5.13 μg、尿苷9.79 μg、鸟苷6.62 μg、腺苷7.03 μg的对照品混合溶液。取已知含量的供试品(批号为K386CP02)9份,每份约0.5 g,精密称定,分为3组,分别加入对照品溶液5、10、15 mL,用10%甲醇补足至20 mL,余下操作同“3.3”项的供试品溶液制备方法,并进样测定,计算得到尿嘧啶、尿苷、鸟苷和腺苷的平均回收率分别为99.0%、100.7%、101.2%、101.8%,RSD分别为2.8%、2.7%、2.9%、2.9%,表明方法的准确度良好。结果见表9。
3.5 检测限和定量限
基于响应值标准偏差和标准曲线斜率法,按照公式检测限LOD=3.3δ/S和定量限LOQ=10δ/S(式中:S为标准曲线的斜率;δ为标准曲线截距的标准偏差),计算得到尿嘧啶的检测限和定量限分别为199.6 ng/mL和604.9 ng/mL,尿苷的检测限和定量限分别为272.3 ng/mL和825.0 ng/mL,鸟苷的检测限和定量限分别为187.3 ng/mL和567.6 ng/mL,腺苷的检测限和定量限分别为215.0 ng/mL和651.6 ng/mL。
3.6 样品含量测定
取13批浮小麦配方颗粒,按“3.3”项的方法制备供试品溶液,并按“3.2”项的色谱条件进样测定。结果见表10。
4 结 语
鉴于中药成分复杂、作用靶点多样的特性,用单一有效成分的定性或定量方式来表征中药的质量信息存在较大的局限性,运用“整体观”思想创建适宜的中药体系评价方法尤为重要[17-18]。基于浮小麦配方颗粒水提的特性,本研究以其中水溶性成分的检出为目的,以多成分检出为导向,运用同一梯度洗脱程序,首次建立了对浮小麦配方颗粒中尿嘧啶、尿苷、鸟苷、腺苷4种成分同时定量的方法,同时建立了其特征图谱分析方法,指认了色氨酸及7个核苷类成分。该方法稳定高效、重复性良好,可为浮小麦配方颗粒多指标体系研究提供新的方法和依据,能够较全面地评价浮小麦配方颗粒的质量。
不同中药中核苷类成分稳定性差异较大,有些中药在水提取过程中核苷类成分稳定性较差,如钱正明等[19]发现冬虫夏草在室温水提取条件下存在腺苷酸向腺苷转化、腺苷向肌苷转化的情况,焦森等[20]发现石菖蒲在水提取过程中亦存在核苷类成分间的转化。浮小麦在制备过程中核苷类成分间是否存在相互转化及其转化途径,还需进一步实验研究。
核苷类成分价值广泛,主要应用于医药领域,如抗癌核苷类似物、核苷类抗病毒药等,其研究成果具有广阔的应用前景,研究者也可从中药中分离有效的核苷类成分作为先导化合物以研发更为有效的药物。
参考文献/References:
[1]
孟霜,李慧峰,闫艳,等.浮小麦药材质量控制研究[J].中国实验方剂学杂志,2012,18(24):124-127.
MENG Shuang,LI Huifeng,YAN Yan,et al.Criteria of quality control for Triticum aestivum[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(24):124-127.
[2] 林立军.天津市中药饮片炮制规范[M].2018年版.天津:天津市市场和质量监督管理委员会,2018:86.
[3] 高明菊,毕丹,孟霜,等.HPLC法同时测定浮小麦中5-二十一烷基间苯二酚和亚油酸的含量[J].中国药房,2013,24(3):244-246.
GAO Mingju,BI Dan,MENG Shuang,et al.Content determination of 5-heneicosylresorcinol and linoleic acid in Triticum aestivum by HPLC[J].China Pharmacy,2013,24(3):244-246.
[4] 陈小红.浮小麦质量控制探讨[J].中国药品标准,2014,15(1):30-34.
CHEN Xiaohong.Quality control discussion of Fructus Tritici Levis[J].Drug Standards of China,2014,15(1):30-34.
[5] 白吉庆,王鹏飞,张姣姣,等.小麦与浮小麦中葡萄糖和棉子糖提取与测定方法研究[J].中国野生植物资源,2020,39(9):6-10.
BAI Jiqing,WANG Pengfei,ZHANG Jiaojiao,et al.Study on the extraction and determination method of glucose and cottonseed sugar in wheat and floating wheat[J].Chinese Wild Plant Resources,2020,39(9):6-10.
[6] 陈湘月,殷世宁,马晓青,等.牡蛎散中含氮类化学成分研究[J].中国海洋药物,2020,39(6):59-66.
CHEN Xiangyue,YIN Shining,MA Xiaoqing,et al.Studies on nitrogenous compounds in Mulisan decoction[J].Chinese Journal of Marine Drugs,2020,39(6):59-66.
[7] 张盼,杨豪男,张宁,等.核苷及核苷酸类化合物的化学结构研究进展[J].广东化工,2020,47(11):95-96.
ZHANG Pan,YANG Haonan,ZHANG Ning,et al.Review on chemical structures of nucleoside and nucleotide compounds[J].Guangdong Chemical Industry,2020,47(11):95-96.
[8] XIANG Xiang,SHA Xiuxiu,SU Shulan,et al.Simultaneous determination of polysaccharides and 21 nucleosides and amino acids in different tissues of Salvia miltiorrhiza from different areas by UV-visible spectrophotometry and UHPLC with triple quadrupole MS/MS[J].Journal of Separation Science,2018,41(5):996-1008.
[9] 王锐.嘧啶核苷的研究进展[J].生物技术通讯,2007,18(3):539-542.
WANG Rui.Advances in pyrimidine[J].Letters in Biotechno-logy,2007,18(3):539-542.
[10]張元杰,钱正明,陈肖家,等.HPLC法同时测定补益中药中尿苷、腺嘌呤、鸟苷和腺苷的含量[J].药物分析杂志,2010,30(1):33-36.
ZHANG Yuanjie,QIAN Zhengming,CHEN Xiaojia,et al.Simultaneous HPLC determination of uridine,adenine,guanosine,and adenosine in six tonic traditional Chinese medicines[J].Chinese Journal of Pharmaceutical Analysis,2010,30(1):33-36.
[11]秦红霖,李永申.特征图谱技术在中药质量分析中的应用[J].中国实用医药,2014,9(7):253-255.
[12]姚令文,刘燕,郑笑为,等.指纹图谱、特征图谱技术在中药材和中成药中的应用[J].中国新药杂志,2018,27(8):934-939.
YAO Lingwen,LIU Yan,ZHENG Xiaowei,et al.Application of the fingerprint and characteristic fingerprint technology in traditional Chinese medicinal materials and Chinese patent medicine[J].Chinese Journal of New Drugs,2018,27(8):934-939.
[13]王海燕.中药特征图谱技术在中药材鉴定中的应用分析[J].光明中医,2020,35(5):795-796
[14]马永青,王璐,刘颖,等.基于全程质量控制理念的杜仲颗粒特征图谱研究[J].河北工业科技,2020,37(1):54-58.
MA Yongqing,WANG Lu,LIU Ying,et al.Characteristic chromatogram of Duzhong granules on whole process quality control concept[J].Hebei Journal of Industrial Science and Technology,2020,37(1):54-58.
[15]郝亚冬,马堃,温瑞卿,等.现行中药配方颗粒国家标准的探讨[J].中国实验方剂学杂志,2023,29(15):158-164.
HAO Yadong,MA Kun,WEN Ruiqing,et al.Discussion on current national standards for traditional Chinese medicine dispensing granules[J].Chinese Journal of Experimental Traditional Medical Formulae,2023,29(15):158-164.
[16]万莹莹,杜微波,陈敬然,等.金银花饮片—标准汤剂量质传递研究[J].河北工业科技,2022,39(2):129-134.
WAN Yingying,DU Weibo,CHEN Jingran,et al.Study on quantity-quality transfer from Lonicera japonica Flos to standard decoction[J].Hebei Journal of Industrial Science and Technology,2022,39(2):129-134.
[17]姜华,高原,杨景明,等.源于“整体观”思想的中药质量评价方法研究概述[J].中国中药杂志,2015,40(6):1027-1031.
JIANG Hua,GAO Yuan,YANG Jingming,et al.Overview of traditional Chinese medicine quality evaluation method based on overall research[J].China Journal of Chinese Materia Medica,2015,40(6):1027-1031.
[18]王雅琪,焦姣姣,伍振峰,等.基于“整体观”的中药制剂质量过程控制体系探讨[J].中国中药杂志,2018,43(1):197-203.
WANG Yaqi,JIAO Jiaojiao,WU Zhenfeng,et al.Quality process control system of Chinese medicine preparation based on"holistic view"[J].China Journal of Chinese Materia Medica,2018,43(1):197-203.
[19]钱正明,甄达明,李文庆,等.冬虫夏草水提取过程中腺苷转化途径研究[J].世界中医药,2016,11(5):758-762.
QIAN Zhengming,ZHEN Daming,LI Wenqing,et al.Adenosine transformation pathway during water extraction of Chinese Cordyceps[J].World Chinese Medicine,2016,11(5):758-762.
[20]焦森,毛淑杰,梁曜华,等.石菖蒲中核苷类成分的分离鉴定及转化途径分析[J].中国实验方剂学杂志,2020,26(12):145-153.
JIAO Sen,MAO Shujie,LIANG Yaohua,et al.Nucleosides from Acorus tatarinowii and their transformation pathway[J].Chinese Journal of Experimental Traditional Medical Formulae,2020,26(12):145-153.
收稿日期:2023-08-01;修回日期:2023-12-22;责任编辑:王海云
第一作者简介:
王晓亚(1992—),女,河北石家庄人,工程师,硕士,主要从事中药配方颗粒质量标准方面的研究。
通信作者:
沈建梅高級工程师。E-mail: shenjianmei@tcmages.com
王晓亚,杜微波,马智玲,等.
浮小麦配方颗粒特征图谱及4种核苷类成分定量研究
[J].河北工业科技,2024,41(1):53-62.
WANG Xiaoya,DU Weibo,MA Zhiling,et al.
Characteristic chromatogram of Fructus Tritici Levis formula granules and quantitative study of four nucleosides
[J]. Hebei Journal of Industrial Science and Technology,2024,41(1):53-62.

