血清RAGE、HMGB1水平与重症肺炎急性呼吸窘迫综合征发病及IFN⁃γ/IL⁃4变化的关系
王敬才 郭春艳 杨丽昕 敬小青
承德医学院附属医院小儿内科 (河北承德 067000)
重症肺炎(severe pneumonia,SP)具有起病较快、预后质量差等特点,其还包括普通肺炎的多种特征,该疾病会造成患者重要器官出现衰竭,甚至致人死亡[1]。SP是儿童死亡的主要原因之一,该疾病除对患儿造成直接影响外,还会引发多种并发症,如急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)等[2]。ARDS病理特征为毛细血管通透性增加,弥散性肺泡上皮细胞出现损伤,在SP患儿中发生率能达到50%以上,给患儿机体造成了严重的伤害[3]。因此对SP患儿是否会继发ARDS进行及时评估,并给予科学有效的干预措施,对减轻患儿症状和挽救患儿生命均有重要价值。过往临床上对于SP患儿的检测指标均存在一定的局限性,如评估效能较低、检查时间较长等,难以通过这些指标对治疗方案进行及时调整[4]。γ-干扰素(interferon-γ,IFN-γ)是一种典型的Th1型细胞因子,白细胞介素4(Interleukin-4,IL-4)是一种Th2细胞因子,两种因子均参与了SP和ARDS的发生发展[5]。晚期糖基化终产物受体(receptor of advanced glycosylation end-products,RAGE)被发现参与了多种感染性疾病的发生,其在SP患者血清中异常偏高[6]。高迁移率族蛋白 B1(high mobility group protein B1,HMGB1)是一种典型的炎性递质,已有研究[7]发现其与ARDS的进展之间有紧密相关性,但是目前临床上关于RAGE和HMGB1对SP患儿继发ARDS的研究不足。因此本研究以我院收治的SP患儿为研究对象,探究血清中RAGE和HMGB1表达水平与SP继发ARDS以及IFN-γ/IL-4变化的关系。报道如下。
1 资料与方法
1.1 一般资料前瞻性选取2020年3月至2022年2月我院收治的100例重症肺炎患儿为研究对象,根据患儿是否发生继发性ARDS将患儿分为ARDS组(n= 56)和对照组(n= 44),纳入标准:(1)符合SP诊断标准[8-9]:①患儿一般情况较差;②出现呼吸困难或有意识障碍;③发绀;④食欲较差;⑤存在胸腔积液或肺外病变;⑥存在一定程度的脱水或超高热;⑦肺部CT或胸片显示气胸、肺不张、肺浸润等。症状符合以上一条或多条即可确诊;(2)ARDS组患儿符合ARDS诊断标准[10]:氧合指数(PaO2/FiO2)≤ 300 mmHg且满足以下标准即可诊断:①急性起病;②氧合指数(PaO2/FiO2)≤ 200 mmHg;③胸片显示肺部存在斑片状阴影。(3)年龄在1个月~14岁 ;(4)入院时间>24 h;(5)患儿家属均知情且签署同意书。排除标准:(1)其他肺部疾病;(2)合并血液系统疾病;(3)合并肝肾功能障碍或自身免疫病。本研究经医院医学伦理委员会批准(编号:CYFYLL2022499)。
1.2 方法
1.2.1 临床资料收集于患儿入院后对其进行一般资料收集,包括性别、年龄、体温、发病季节、致病菌种类、PaO2/FiO2、机械通气氧合指数(oxy⁃genation index,OI)等,同时采用急性生理学评分(acute physiological score,APS)[11]对其状况进行评分。OI = FiO2× 100 × MAP(cmH20)/PaO2(mmHg),APS总分为反向格拉斯哥昏迷评分法(glasgow coma scale,GCS)[12]与各生理学指标评分之和。GCS评分包括睁眼、语言和运动评分,总分分别为4分、5分和6分。反向GCS评分=15-实际得分。生理学指标评分共11项,包括心率、呼吸、体温、血压、动脉氧分压、血清钾、钠、血清 pH 值、血细胞比容、血肌酐、红细胞计数,每项指标均为0~4分,若存在急性肾衰竭则血肌酐计分翻倍,即0~8分。APS满分为60分,分数越高则健康情况越差。
1.2.2 生物化学指标检测入院当天或次日清晨采集患儿空腹外周静脉血5 mL。采用3 000 r/min的速度离心15 min,取上清液于-70 ℃环境下保存。采用酶联免疫吸附法进行血清IFN-γ、IL-4、RAGE和HMGB1表达检测,并计算IFN-γ和IL-4的比值。以上所有试剂盒均购于Andy Gene生物公司,其操作步骤严格按照试剂盒说明进行。
1.3 统计学方法用SPSS20.0进行统计分析。计数资料以例(%)表示,采用χ2检验;计量资料以()的形式表示,采用两独立样本t检验;采用多因素logistic回归分析SP患儿发生ARDS的影响因素;采用Pearson相关性分析血清RAGE、HMGB1表达与、IFN-γ、IL-4和IFN-γ/IL-4水平的关系;并采用受试者工作曲线(ROC)分析RAGE和HMGB1表达对SP患儿发生ARDS的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿一般资料两组SP患儿性别、年龄、体温以及发病季节之间差异无统计学意义,ARDS组致病菌种类多于对照组,PaO2/FiO2高低于对照组,APS评分高于对照组(P<0.05)。见表1。
表1 两组患儿一般资料比较Tab.1 Comparison of general information between two groups of children ±s

表1 两组患儿一般资料比较Tab.1 Comparison of general information between two groups of children ±s
指标性别[例(%)]男女年龄(岁)体温(℃)发病季节[例(%)]春夏秋冬致病菌种类[例(%)]<2种≥ 2种PaO2 /FiO2 APS(分)机械通气OI ARDS组(n = 56)对照组(n = 44)t/χ2值0.154 6 P值0.694 2 34(60.71)22(39.29)4.12±1.03 37.87±0.83 25(56.82)19(43.18)4.26±1.11 38.05±0.97 0.652 0 0.999 3 0.154 6 0.515 9 0.320 1 0.484 9 44(78.57)12(21.43)37(84.09)7(15.91)8.300 1 0.004 0 17(30.36)39(69.64)175.68±19.48 28.89±3.56 28.12±3.26 26(59.09)18(40.91)279.25±26.28 19.36±4.12-22.632 3 12.397 2-0.000 0 0.000 0-
2.2 两组患儿血清RAGE和HMGB1表达水平比较对比两组患儿血清水平发现,ARDS组RAGE和HMGB1表达水平均高于对照组(P<0.05)。见表2。
表2 两组患儿血清RAGE和HMGB1表达水平比较Tab.2 Comparison of serum levels of RAGE and HMGB1 expression between two groups of pediatric patients ±s,μg/L
组别ARDS组(n = 56)对照组(n = 44)t值P值RAGE 176.18±16.23 135.20±15.46 12.796 3 0.000 0 HMGB1 156.10±26.70 121.56±21.26 7.008 8 0.000 0
2.3 两组患儿血清IFN⁃γ和IL⁃4表达水平比较对比两组患儿血清水平发现,ARDS组IFN-γ和IL-4表达水平以及IFN-γ/IL-4比值均高于对照组(P<0.05)。见表3。
表3 两组患儿血清IFN-γ和IL-4表达水平比较Tab.3 Serum IFN of two groups of pediatric patients-γ comparison with IL-4 expression levels ±s

表3 两组患儿血清IFN-γ和IL-4表达水平比较Tab.3 Serum IFN of two groups of pediatric patients-γ comparison with IL-4 expression levels ±s
组别ARDS组(n = 56)对照组(n = 44)t值P值IFN-γ(μg/L)64.76±8.69 53.20±7.31 7.072 5 0.000 0 IL-4(ng/L)99.96±13.15 87.28±12.87 4.831 3 0.000 0 IFN-γ/IL-4 0.65±0.09 0.61±0.07 2.426 5 0.017 1
2.4 多因素logistic回归分析经多因素logistic回归分析可知,致病菌种类、PaO2/FiO2、RAGE、HMGB1表达、IFN-γ、IL-4和IFN-γ/IL-4均为SP患儿继发ARDS的影响因素。见表4。
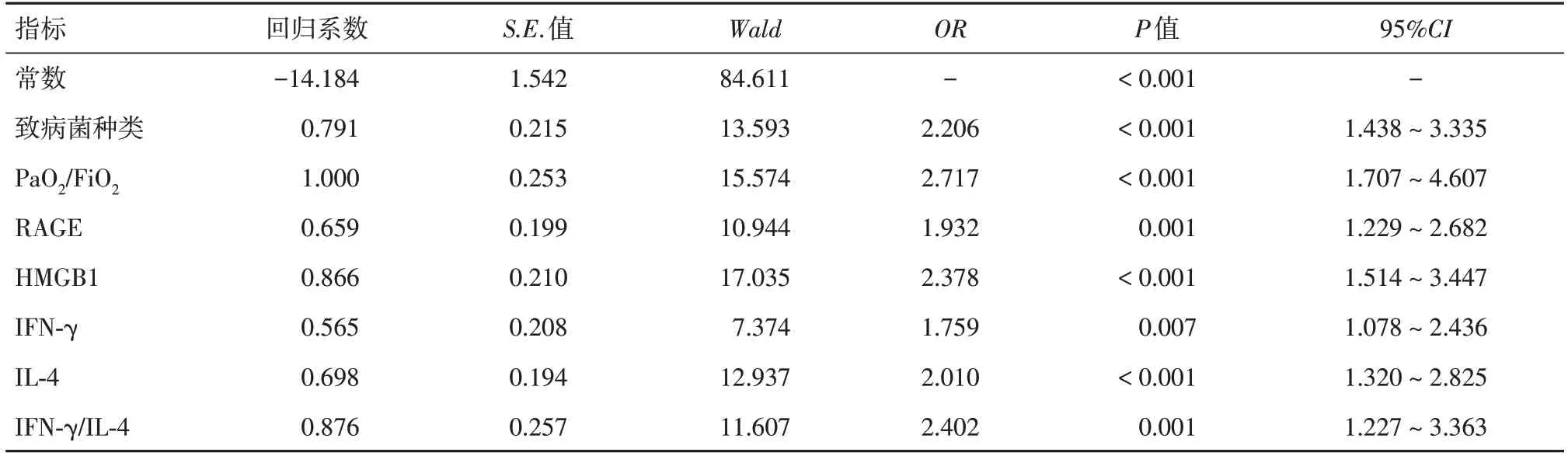
表4 SP患儿继发ARDS的多因素logistic回归分析Tab.4 Multivariate logistic regression analysis of secondary ARDS in children with SP
2.5 Pearson相关性分析经Pearson相关检验,SP患儿血清RAGE、HMGB1表达水平与IFN-γ、IL-4和IFN-γ/IL-4均呈正相关(P<0.05)。见表5。

表5 SP患儿血清RAGE、HMGB1表达水平与IFN-γ、IL-4和IFN-γ/IL-4相关性Tab.5 Expression levels of serum RAGE,HMGB1 and IFN in children with SP- γ、IL-4 and IFN- γ/ IL-4 correlation
2.6 ROC曲线分析经ROC曲线分析可得,血清RAGE、HMGB1水平预测SP患儿发生ARDS的AUC分别为0.707和0.750,灵敏度分别为73.2%、64.3%,特异度分别为68.2%、77.3%,两者联合预测的AUC为0.848,灵敏度和特异度分别为80.4%和81.8%。见表6和图1。
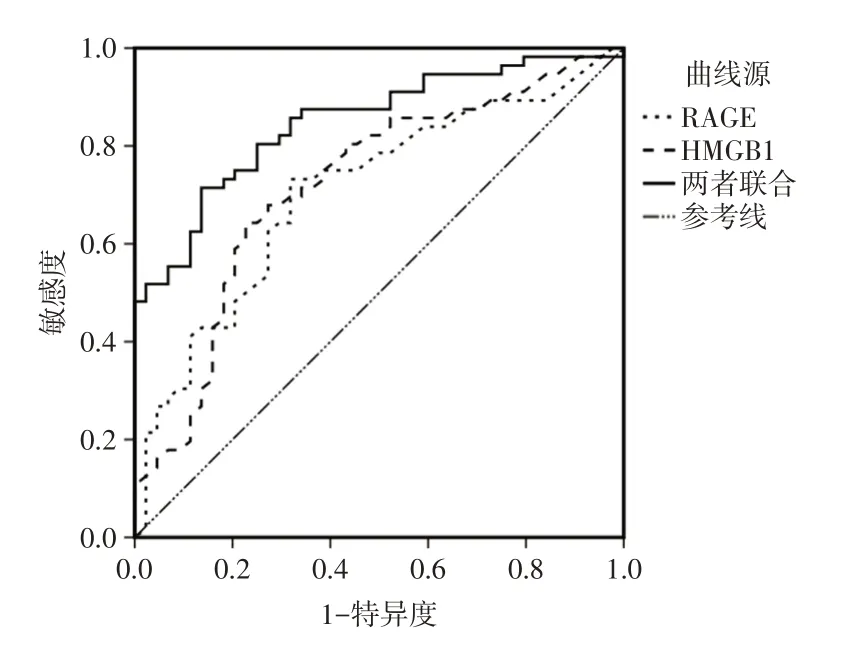
图1 血清RAGE、HMGB1预测SP患儿发生ARDS的ROC曲线图Fig.1 ROC curve of serum RAGE and HMGB1 predicting the occurrence of ARDS in children with SP

表6 血清RAGE、HMGB1预测SP患儿发生ARDS的ROC分析Tab.6 ROC analysis of serum RAGE and HMGB1 predicting the occurrence of ARDS in children with SP
3 讨论
在世界范围内SP是造成人口感染性死亡的主要原因之一,其致死率在50%左右。由于儿童免疫系统功能发育不完善,导致SP会给儿童健康带来更大的威胁。ARDS是一种典型的SP并发症,其引发患者呼吸窘迫和低氧血症,给患者带来危及生命的消极影响[13]。因此,对SP患儿疾病发展进行预测,评估患儿是否会发生ARDS,对于治疗方案的调整和改善患儿预后质量均有关键性作用。APACHE Ⅱ评分系统被广泛应用于多种疾病的病情评估,但由于慢性健康状况和年龄因素等限制,同时该系统未对炎性反应剧烈程度进行评估,因此在SP患儿中的评估效能较低,因此采用APS对SP患儿进行病情评估。
SP会导致患儿出现由肺部炎症引发的重要器官衰竭,其中ARDS的发生较为常见,其主要发生机制为SP患儿会发生过度免疫反应,致使大量细胞因子释放,导致细胞因子风暴形成,引发肺损伤,严重时可能造成肺衰竭或死亡[14]。在本研究中,在ARDS组SP患儿中,其病原菌种类更多,PaO2/FiO2偏低,且其APS评分偏高,由于PaO2/FiO2和APS评分均为SP合并ARDS患儿的结果,故未对其进行进一步影响因素分析。致病菌种类越多,可能导致患儿出现更为严重的免疫反应,使机体内细胞因子分泌更为剧烈,造成炎性损伤。同时,由于多种致病菌均存在耐药性,导致患儿治疗效果不佳,随着疾病进展,发生不良转归的风险更高。研究[15]显示,ARDS的发生与严重感染有密切相关性,当致病菌侵袭机体,会使机体炎性因子出现活化,导致促炎因子与抗炎因子的平衡被打破,进而引发ARDS。
Th细胞在健康人群中处于前体状态,而到其受到特异性抗原的刺激,会分化成为Th1和Th2型细胞。当肺部遭受外界刺激或出现损伤时,Th1和Th2型细胞的分化速度均会增加,但是其中分化速度更具优势的为Th1型细胞[16]。Th1和Th2型细胞在分化后会进行细胞因子的产生和释放,以介导免疫反应,其中Th1型细胞因子以IFN-γ为主要代表,参与细胞免疫,而Th2型细胞因子以IL-4为代表,参与机体的体液免疫。IFN-γ/IL-4的比例可以反应Th1/Th2细胞平衡,当IFN-γ/IL-4水平升高时,提示细胞平衡向Th1偏移[17]。在本研究中,ARDS组患儿血清中IFN-γ水平和IL-4水平均明显高于对照组,提示SP继发ARDS患儿机体中细胞因子释放水平明显偏高,进一步反映其免疫反应异常程度较高。且研究中ARDS组患儿IFN-γ/IL-4明显低于对照组,提示促炎因子升高程度更高,其可能原因为ARDS患儿受到外界感染后会产生大量毒素,其毒素经循环系统入侵肺部,使促炎因子的形成和释放水平大大上升,导致炎性因子通过级联反应使ARDS的严重程度进一步上升。
RAGE是HMGB1的一种特异性受体。当机体处于稳态时,HMGB1主要存在于细胞核中,而在机体受到外界刺激后,HMGB1会被释放于细胞外,从而与RAGE进行特异性结合,进而激活下游2条信号通路:一是鸟苷三磷酸酶和CDC42途径,此通路对于细胞运动、迁移和细胞骨架的重塑等生物学效应均有重要参与作用;二是丝裂原活化蛋白激酶途径,此通路对于趋化因子和细胞因子的大量释放均有重要意义[18-19]。既往研究[20]显示,HMGB1/RAGE水平的活化参与了肺损伤。在本研究中,ARDS组患儿HMGB1和RAGE水平均明显高于对照组,提示HMGB1/RAGE是导致患儿肺损伤的关键性因素,出现该结果的原因可能为:RAGE在不同细胞表面均广泛存在,其表达水平一般较低,当其配体发生聚集,会诱导RAGE水平急剧上升。当HMGB1发生聚集并特异性结合RAGE,会将丝裂原活化蛋白激酶途径进行激活,以诱导炎症反应。ENTEZARI等[21]研究显示,对HMGB1/RAGE信号通路的活化进行抑制,能够使其炎症反应被抑制,减轻ARDS的程度。ZHAO等[22]研究证明,HMGB1的表达会使急性肺部炎症出现恶化,导致ARDS的进一步发展,与本研究结果较为一致。通过相关性分析发现,SP患儿血清RAGE、HMGB1表达水平与IFN-γ、IL-4和IFN-γ/IL-4均呈正相关,提示SP患儿血清RAGE、HMGB1表达水平越高,则机体内炎症反应越剧烈。但是值得注意的是,RAGE、HMGB1表达水平和Th1/Th2细胞平衡相关性不显著,出现该结果的原因可能为IFN-γ、IL-4等炎症因子的表达除了受HMGB1/RAGE信号通路的影响外,还受SP的影响。在SP患儿机体中,Th1/Th2细胞平衡受肺部炎症的影响会存在明显异常情况,导致是否继发ARDS对其平衡情况的改变较小。通过对患儿血清中RAGE、HMGB1表达行ROC分析发现,RAGE、HMGB1对于SP患儿是否继发ARDS均有一定的预测价值,两者联合预测的价值更高,其灵敏度和特异度能达到80.4%和81.8%。
综上所述,SP继发ARDS患儿血清中RAGE、HMGB1表达水平较高,其与IFN-γ/IL-4呈正相关性,监测患儿血清RAGE、HMGB1表达对SP患儿继发ARDS的风险有一定的预测价值,在临床上对SP患儿继发ARDS有一定的警示作用。本研究弥补了临床上RAGE、HMGB1表达水平与SP继发ARDS患儿关系研究的不足,通过分析血清RAGE、HMGB1水平与SP患儿继发ARDS的相关性,明确SP患儿继发ARDS的危险因素,为降低SP患儿继发ARDS的风险提供了理论基础。值得注意的是,本研究仍存在一定不足,如样本量较少,可能对统计学结果产生一定的影响,同时本研究未将健康人群与SP患儿、不同程度的ARDS患儿进行分层比较,无法明确RAGE、HMGB1的作用机制。因此在未来的研究中,需要对纳入健康儿童,并对SP继发ARDS患儿根据病情严重程度进行分层比较,深入研究RAGE、HMGB1表达在SP继发ARDS中的作用。

