油菜千粒质量性状的研究进展
王安琪 姚艳梅

摘要:作为油菜的产量三因素之一,千粒质量对油菜产量起到至关重要的作用。本文主要从千粒质量的遗传效应、影响因素、QTL定位、基因克隆、调控机理、反向遗传学等6个方面对千粒质量的研究进展进行了阐述。目前的研究认为油菜千粒质量性状主要由加性效应控制,且受环境及收播期影响;甘蓝型油菜中千粒质量QTL在其十几条染色体上均有分布,其中A09染色体上检测到的位点最多,芥菜型油菜千粒质量性状QTL主要分布在A01、A03、A06、A07、A09、A10、B03、B05等染色体上,白菜型油菜千粒质量QTL的定位目前还未见报道;油菜中千粒质量基因目前仅仅克隆了ARF18、BnaA9.CYP78A9和BnaUPL3.C03等3个基因;油菜千粒质量调控机制主要通过调控种子中的胚乳功能来控制种子的大小以及通过调节角果皮、种皮以及母体细胞的生长发育,直接或间接地控制种子生长,进而影响粒质量的大小;利用反向遗传学在拟南芥中找到AtDWF4、AtSHB1、AtDA1 R358K这3个基因对油菜千粒质量产生的影响。因此本文可以为油菜品种的改良提供理论基础。
关键词:千粒质量;遗传效应;QTL定位;基因克隆;反向遗传学;调控机理
中图分类号:S565.403 文献标志码:A
文章编号:1002-1302(2024)03-0035-05
油菜是我国重要的油料作物,菜籽油的供给量几乎常年占我国植物油供给量的一半左右,是非常重要的油料作物之一。油菜按照栽培类型,可以分为甘蓝型油菜、白菜型油菜和芥菜型油菜。芥菜型油菜(AABB,2n=36)是重要的异源四倍体油料作物,起源于白菜与黑芥种间杂交后的染色体自然加倍[1-2]。芥菜型油菜属于常异花授粉植物,异交率达到5%~30%[3],主要种植于印度、巴基斯坦、非洲、俄罗斯中部、加拿大、东欧以及我国的西南和西北地区,芥菜型油菜具有优良的抗旱、抗病和抗裂角等特性[4-6]。在3种栽培类型的油菜中,甘蓝型油菜的种植面积最广,主要原因在于其具有适应性强、产量高等优点[7]。白菜型油菜具有成熟早、耐寒、抗虫性强等特点,主要种植在高海拔地区[8]。
千粒质量是一个复杂的数量性状,由母体基因型控制,同时也是一个重要的农艺性状[9-10]。油菜是典型双子叶植物,成熟油菜种子由胚、胚乳和种皮组成,三者分别由受精卵、受精中央细胞和珠被组织发育而来。胚、胚乳和种皮三者协同发育,共同决定了种子最终大小和粒质量[11]。单株角果数、每角粒数和千粒质量是构成油菜产量的3个主要因素,千粒质量与每角果粒数和单株角果数呈负相关,受到每角果粒数和单株角果数的制约。近年来,随着育种水平和栽培技术的提高以及种植密度的加大,油菜角果數和角粒数的提高已经达到了一个瓶颈状态,而油菜千粒质量的研究相对还比较少,所以千粒质量性状是未来研究的一个重点[12-15]。
1 油菜千粒质量的遗传效应
千粒质量作为油菜产量三因素之一,其遗传模式已有部分报道,研究者均认为油菜千粒质量性状主要由加性效应控制。Grant等利用6×6双列杂交的试验方法对油菜千粒质量相关性状进行配合力分析,结果表明油菜千粒质量性状由加性效应和非加性效应共同调控[16]。戚存扣等研究认为,油菜千粒质量性状主要由加性效应调控[17]。李开石等采用4×4不完全双列杂交的试验方法,以芥菜型油菜8个自交系为试验材料,对千粒质量性状的遗传效应进行分析,结果表明,油菜千粒质量性状的遗传主要由加性效应控制,遗传力估值为4789%[18]。叶亚琼以120个株系的重组自交系群体为材料,对千粒质量性状QTL进行分析,认为加性效应对千粒质量表型变异的贡献率较高,达到25.63%;而加性与加性互作效应的贡献率较低,为15.01%,因而认为千粒质量性状主要由加性效应控制[19]。
2 千粒质量的影响因素
2.1 播种密度对千粒质量的影响
杨进成等为探究不同播种密度对油菜千粒质量的影响,采用10个水平处理,对云花油早熟1号的千粒质量进行考察,结果表明,千粒质量随着播种密度的增大而逐渐减小[20];顾炳朝等以镇油6号为研究材料,对千粒质量性状进行研究,研究结果也表明千粒质量随着播种密度的增大而逐渐减小[21]。以上研究说明播种密度与千粒质量性状呈负相关,过高的密度会抑制油菜单株生产力的发挥,从而影响油菜千粒质量。
2.2 施肥水平对千粒质量的影响
陈小虎等采用“3414”试验设计方案,研究表明,随着施氮量的增加千粒质量增加,但是过量施氮时千粒质量有所减小,磷、钾肥施用量的增加对千粒质量影响较小[22]。郁寅良等以苏油1号为研究材料,采用225、270、315 kg/hm2这3个施氮水平,对产量相关性状进行研究,结果表明在225~315 kg/hm2施氮量范围内,随氮肥增加千粒质量降低[23]。以上研究都说明,对于千粒质量性状而言,不宜过量施用氮肥,主要因为氮肥促进前期营养体的生长和发育,过量氮肥会影响下一时期的生殖生长。
2.3 播种期及收获期对千粒质量的影响
钟林光等以湘杂油7号为研究材料,设置3个不同的播种时间,研究结果表明千粒质量与播期关系不明显[24]。刘玉霞等以油菜产量2 250 kg/hm2、千粒质量4 g计算,正常黄熟后1周收割,千粒质量平均下降0.198 g,若种子成熟前7 d收割,可使千粒质量下降0.162 g[25]。因为黄熟后收割,籽粒已经不再进行干物质积累,而呼吸代谢会消耗干物质,从而导致千粒质量下降,成熟前收割,灌浆还不充分,此时收割必然会导致千粒质量下降。
2.4 海拔高度对千粒质量的影响
与其他数量性状相同,油菜千粒质量性状也受一定环境影响。2个影响比较大的环境因素为温度和光照,而海拔高度的不同必然会引起温度和光照的不同[26]。卓嘎等对西藏高海拔地区野生芥菜型油菜进行调查,统计出千粒质量较大的野生芥菜型油菜种质资源主要集中在海拔3 800~4 000 m地区,共有15份,占西藏千粒质量较大的野生芥菜型油菜种质资源总数的75.00%;而在海拔3 500~3 800 m 之间则仅分布5份,约占西藏千粒质量较大的野生芥菜型油菜种质资源总数25.00%,其结果表明,野生芥菜型油菜千粒质量随海拔升高而增加,具有垂直分布的生态适应性[27]。
3 油菜千粒质量性状的QTL定位
有关基因或性状QTL的定位方法,一般可以分2种,即连锁分析与关联分析。连锁分析原理是根据基因或性状QTL 与分子标记之间的连锁关系进行定位,利用连锁分析进行基因或QTL定位离不开定位群体,后代的变异来源于双亲,更有利于检测稀有变异,但仅能检测到双亲有分离的位点,可检测到的基因或 QTL数目有限,双亲群体重组率较低[28-30]。全基因组关联分析(GWAS)是基于海量的单核苷酸多态性标记,以连锁不平衡为基础,在全基因组范围内系统地研究群体特定性状与SNPs之间关联的手段[31-33]。连锁分析的相对优势主要有3点:(1)背景比较清晰,适合稀有基因的研究;(2)群体比较容易控制;(3)目的性和结果预期性比较强。关联分析的相对优势也主要有3点:(1)研究材料来源广泛、变异丰富;(2)节约时间;(3)分辨率比较高,可以达到单碱基水平[34-36]。
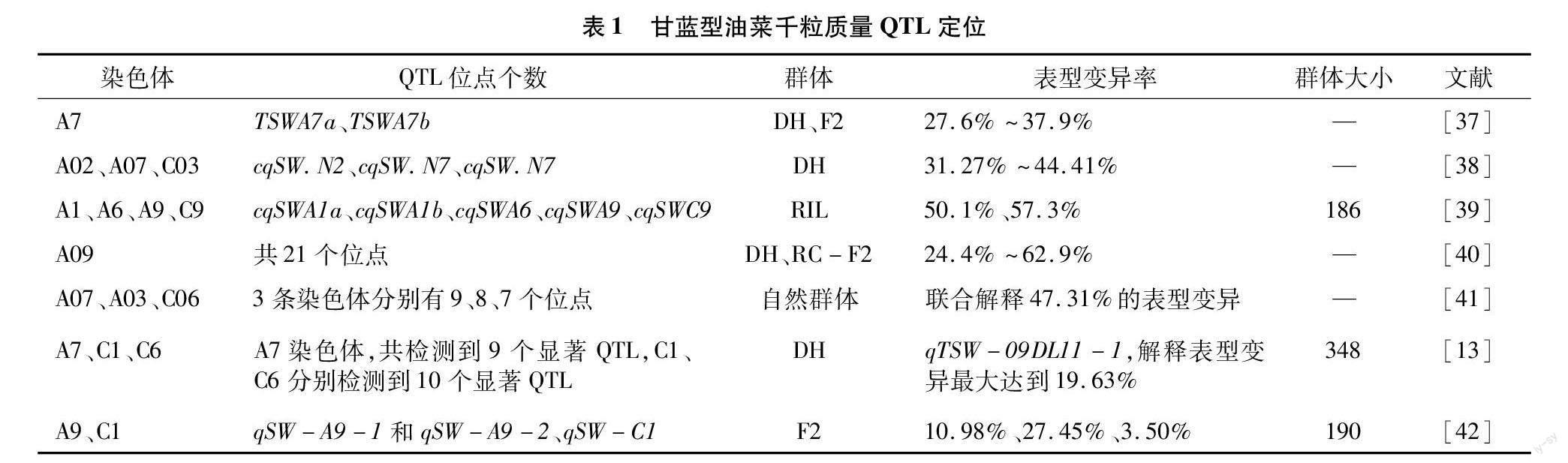
有关油菜千粒质量性状的QTL定位研究在甘蓝型油菜中报道较多,结果表明,甘蓝型油菜中千粒质量QTL在其十几条染色体上均有分布,其中A09染色体上检测到的位点最多,最高可以解释62.9%的表型变异(表1)。有关芥菜型油菜的千粒质量QTL定位研究也有少量报道,检测到的芥菜型油菜千粒质量性状QTL主要分布在A01、A03、A06、A07、A09、A10、B03、B05等染色体上(表2)。白菜型油菜千粒质量QTL的定位目前还未见报道。
4 油菜千粒质量相关基因的克隆分析
研究者们已经对油菜千粒质量相关基因进行了克隆和功能分析,但主要集中在甘蓝型油菜中。例如,Liu等利用包含4 000个单株的BC4F2群体为材料,将甘蓝型油菜粒质量基因位点缩小到标记TSNP13和TSNP16之間的147 kb区域,再利用包含380个大粒表现的甘蓝型油菜品系进行了关联分析,扫描粒质量与A09连锁群上11个QTL连锁标记的关联,结果在SSR-72和SSR89之间显示出明显的峰值,结合精细定位和靶区关联的结果,将甘蓝型油菜粒质量基因位点缩小到50 kb的区间范围内,并在该区域鉴定了7个推定的开放阅读框,经过功能分析克隆了控制甘蓝型油菜粒质量性状的基因ARF18[46]。Shi等是通过将NI(S1)与NIL(S2)杂交形成分离F2群体,并利用重组体定位了控制甘蓝型油菜粒质量性状的候选基因BnaA9.CYP78A9,经过功能分析克隆了控制甘蓝型油菜粒质量性状的基因BnaA9.CYP78A9[47]。最近,还有研究者利用甘蓝型油菜自然群体,对种子大小、含油量和产量进行关联分析,结果鉴定到可以调控甘蓝型油菜粒质量的HECT E3泛素连接酶编码基因BnaUPL3.C03,粒质量高的品系中BnaUPL3.C03表达量较低,且LEC2蛋白水平变高,因而作者提出UPL3是通过介导LEC2的蛋白降解来调控LEC2的蛋白水平,进而调控甘蓝型油菜粒质量的大小[48]。作为异源多倍体,油菜千粒质量性状非常复杂,只在甘蓝型油菜中克隆了少量几个千粒质量相关基因,而在芥菜型油菜和白菜型油菜中,克隆控制千粒质量性状的基因还没有相关报道。
5 千粒质量性状的调控机理
基于调控方式的不同,研究者们对种子大小产生机理的解释大致包括2种:(1)通过调控种子中的胚乳功能控制种子的大小;(2)通过调控角果皮、种皮以及母体细胞的生长发育,直接或间接地控制种子生长[49]。
有关千粒质量性状的调控机制,拟南芥中已经研究得比较清楚,研究者们一致认为拟南芥籽粒的合子途径大概分为2个过程:第1个为胚乳核处于游离状态,快速分裂增殖过程;第2个为胚乳细胞化和胚细胞不断增殖过程。母体组织中主要有以下5种途径会对种子的大小产生影响:(1)转录因子调控种子大小,其中ANT、AP2、TTG2等通过转录调控对种子大小产生影响[50];(2)泛素介导的途径,其中主要有泛素受体、E3泛素连接酶DA2和GW2、泛素特异性蛋白酶对种子大小产生影响[51];(3)G蛋白信号途径,通过AGG3、GS3和DEP1等蛋白信号对种子大小进行调控[52-53];(4)植物激素途径,包括油菜素内酯途径、细胞分裂素途径等[54-55];(5)其他类型的植物生长物质,如KLUH、EOD3等[56-57]。在油菜中也已有一些关于千粒质量形成机理的报道,Liu等认为甘蓝型油菜的千粒质量是由于生长素反应因子ARF18基因的突变,而抑制下游生长素基因的活性,从而调节生长素反应途径,进而调节角果壁中的细胞生长同时影响了粒质量的大小[46]。Shi等认为甘蓝型油菜的千粒质量是由于BnaA9.CYP78A9的3.9 kb上游调控序列中的37 kb CACTA样转座子元件(TE)导致了角果中具有较高浓度的生长素,进而促进角果伸长同时增加了粒质量[47]。还有研究者提出UPL3通过介导LEC2的蛋白降解来调控LEC2的蛋白水平,进而调控油菜粒质量的大小[48]。虽然,甘蓝型油菜千粒质量形成的机理有部分报道,但芥菜型油菜和白菜型油菜的千粒质量基因并没有得到克隆,油菜作为异源多倍体,其千粒质量形成机理非常复杂,需要更多的研究来解析其千粒质量遗传机制。
6 利用反向遗传学对油菜粒质量基因进行克隆分析
反向遗传学指从已知生物信息出发,采用从基因到性状的研究路线,对生物体进行遗传和变异规律的研究,揭示生物的表现型与基因型之间的关系[58-59]。
Sahni等克隆了拟南芥中的BR合成基因AtDWF4,并在甘蓝型油菜中超表达AtDWF4,结果表明,超表达AtDWF4可以促进甘蓝型油菜叶片增大,主枝角果数增多,粒质量增加,最终使甘蓝型油菜单株产量增加;通过转录组分析,可知AtDWF4与抗逆性相关,可能参与了BES1/BZR1介导的植物防御信号[60]。SHB1是拟南芥中参与种子发育的重要调控因子,Xiao等克隆了AtSHB1,并在甘蓝型油菜中进行超表达AtSHB1,发现AtSHB1可以与油菜中的同源基因MINI3和IKU2的启动子相结合,从而促进这些同源基因表达,最终使甘蓝型油菜种子增大;另外,超表达AtSHB1对甘蓝型油菜的品质性状和其他产量性状如每角粒数、单株角果数均没有影响[61]。在拟南芥中,DA1编码泛素受体并负向调控种子大小,且抑制AtDA1的表达可以促进珠被中细胞分裂,进而促进种子和器官增大[62];Wang等在甘蓝型油菜中超表达拟南芥的基因AtDA1R358K,导致甘蓝型油菜中第358位氨基酸由精氨酸变为赖氨酸,进而导致 DA1 蛋白功能缺失;结果在甘蓝型油菜中超表达AtDA1R358K会抑制BnDA1的表达,从而促进甘蓝型油菜种子增大,单株产量增加达13.22%[63]。
7 展望
当前油菜是全球大面积种植的油料作物,也是国内植物食用油的主要来源,但是国内的食用油缺口目前呈扩大趋势,所以对油菜产量的需求也会越来越大。近年来,生物技术的不断发展,为油菜品种的改良提供了优质基因资源和技术支持,根据拟南芥的同源基因功能注释,在甘蓝型油菜中也鉴定出少数几个产量相关的优异基因。
目前油菜千粒质量性状的研究主要集中在甘蓝型油菜中,也在甘蓝型油菜中克隆了少数几个千粒质量性状相关基因,而对芥菜型油菜和白菜型油菜千粒质量性状的研究还比较少,至今还没有一个千粒质量基因被克隆出来,其千粒质量调控机制更不清楚。作为异源多倍体,油菜的千粒质量形成机理非常复杂,需要更多的研究来克隆油菜(包括甘蓝型油菜、白菜型油菜和芥菜型油菜)千粒质量相关基因,并解析其千粒质量遗传机制,进而改良油菜(包括甘蓝型油菜、白菜型油菜和芥菜型油菜)粒质量性状,培育出籽粒质量、产量性状优良的甘蓝型油菜、白菜型油菜或芥菜型油菜新品种。
参考文献:
[1]刘 成,冯中朝,肖唐华,等. 我国油菜产业发展现状、潜力及对策[J]. 中国油料作物学报,2019,41(4):485-489.
[2]赵海菲,杨秀玲,余坤江,等. 芥菜型油菜野生及其衍生种质遗传多样性分析[J]. 中国油料作物学报,2022,44(1):57-62.
[3]Rakow G,Woods D L. Outcrossing in rape and mustard under Saskatchewan prairie conditions[J]. Canadian Journal of Plant Science,1987,67(1):147-151.
[4]劉淑艳,刘忠松,官春云. 芥菜型油菜种质资源研究进展[J]. 植物遗传资源学报,2007,8(3):351-358.
[5]Chèvre A M,Barret P,Eber F,et al. Selection of stable Brassica napus-B.juncea recombinant lines resistant to blackleg (Leptosphaeria maculans).1.Identification of molecular markers,chromosomal and genomic origin of the introgression[J]. Theoretical and Applied Genetics,1997,95(7):1104-1111.
[6]Woods D L,Capcara J J,Downey R K. The potential of mustard [Brassica juncea (L.) Coss]as an edible oil crop on the Canadian Prairies[J]. Canadian Journal of Plant Science,1991,71(1):195-198.
[7]陆红臣,仵汉飞,文 静,等. 甘蓝型油菜多主花序性状的表型特点与遗传分析[J]. 中国油料作物学报,2019,41(6):850-857.
[8]李秀萍,刘青元,杜德志,等. 青海省白菜型春油菜的主要特性[J]. 青海农林科技,1995(1):39-40,10.
[9]戚存扣,盖钧镒,傅寿仲,等. 甘蓝型油菜(Brassica napus L.)千粒重性状遗传体系分析[J]. 作物学报,2004,30(12):1274-1277.
[10]李 娜. 甘蓝型油菜粒重母体调控机理解析[D]. 北京:中国农业科学院,2015:6-10.
[11]林升丽. 全基因组和全转录组关联分析解析油菜千粒重自然变异的遗传机制[D]. 武汉:华中农业大学,2020:1-4.
[12]赵继献,向 阳,戴祥来,等. 甘蓝型油菜千粒重与农艺及品质性状的相关性[J]. 贵州农业科学,2020,48(3):45-49.
[13]赵卫国,王 灏,穆建新,等. 甘蓝型油菜千粒重性状的QTL定位分析[J]. 西北植物学报,2017,37(3):478-485.
[14]冯旭东. 利用关联分析挖掘甘蓝型油菜千粒重优异等位变异[D]. 贵阳:贵州大学,2016:5-15.
[15]董育红,关周博,韦世豪,等. 甘蓝型油菜千粒重的遗传效应分析[J]. 作物研究,2016,30(5):516-519.
[16]Grant I,Beversdorf W D.Heterosis and combining ability estimates in spring-planted oilseed rape (Brassica napus L.)[J]. Canadian Journal of Genetics and Cytology,1985,27(4):472-478.
[17]戚存扣,浦惠明,张洁夫,等. 油菜(Brassica napus L.)千粒重性状主位点组遗传分析[J]. 江苏农业学报,2005,21(1):1-5.
[18]李石开,邱怀珊. 芥菜型油菜千粒重的配合力分析[J]. 西南农业学报,1997,10(4):32-34.
[19]叶亚琼. 小麦株高和千粒重QTL定位及其元分析[D]. 兰州:甘肃农业大学,2015:19-20.
[20]杨进成,李 祥,胡新洲,等. 不同种植密度对免耕山地油菜农艺性状和产量的影响[J]. 中国农学通报,2019,35(14):25-31.
[21]顾炳朝,岳绪国,唐泽庆,等. 种植密度对‘镇油6号油菜产量及构成因子的影响[J]. 上海农业学报,2014,30(3):89-91.
[22]陈小虎,严庆纪,陈芳斌,等. 施肥对湘杂油6号产量影响及最佳施肥量研究[J]. 作物研究,2008,22(3):160-163.
[23]郁寅良,吴正贵,吴玉珍,等. 密度和施肥水平对双低油菜苏油1号产量及分枝习性的影响[J]. 中国油料作物学报,2001,23(1):41-45.
[24]钟林光,王朝晖. 播期和种植密度对油菜品种湘杂油7号产量及品质的影响[J]. 广西农业科学,2010,41(6):536-538.
[25]刘玉霞,汪义龙,丁 瑜,等. 油菜种子成熟度对千粒重和含油量性状的影响[J]. 浙江农业学报,2011,23(3):465-469.
[26]杨 涛,付福友,刘列钊,等. 不同海拔环境中甘蓝型油菜RIL主要性状的差异分析[J]. 西南大学学报(自然科学版),2007,29(8):64-71.
[27]卓 嘎,旦 巴,何 燕,等. 西藏野生油菜种质资源千粒重分析[J]. 种子,2008,27(12):72-76.
[28]Chang F G,Guo C Y,Sun F L,et al. Genome-wide association studies for dynamic plant height and number of nodes on the main stem in summer sowing soybeans[J]. Front Plant Sci,2018,9:1184-1196.
[29]于芮苏,田小康,刘斌斌,等. 玉米抗倒伏相关性状QTL的关联和连锁分析[J]. 作物学报,2022,48(1):138-150.
[30]张 霞. 小偃麦种质系SN304的鉴定及重要性状QTL分析[D]. 泰安:山东农业大学,2021:7-9.
[31]Wang W Y S,Barratt B J,Clayton D G,et al. Genome-wide association studies:theoretical and practical concerns[J]. Nature Reviews Genetics,2005,6(2):109-118.
[32]谭力治,赵毅强. 全基因组关联分析中混合模型的原理、优化与应用[J]. 中国农业科学,2023,56(9):1617-1632.
[33]张 威,许亚男,许文静,等. 大豆株高全基因组关联分析[J/OL]. 中国油料作物学报. https://doi.org/10.19802/j.issn.1007-9084.2022358.
[34]Tibbs Cortes L,Zhang Z W,Yu J M. Status and prospects of genome-wide association studies in plants[J]. The Plant Genome,2021,14(1):e20077.
[35]谢 磊. 小麦穗发芽全基因组关联分析与连锁分析[D]. 乌鲁木齐:新疆农业大学,2021:5-7.
[36]郭向阳. 基于关联分析和连锁分析策略挖掘玉米氮响应的株型性状关键位点[D]. 长沙:湖南农业大学,2020:9-12.
[37]Fan C C,Cai G Q,Qin J,et al. Mapping of quantitative trait loci and development of allele-specific markers for seed weight in Brassica napus[J]. Theoretical and Applied Genetics,2010,121(7):1289-1301.
[38]Zhang L W,Yang G S,Liu P W,et al. Genetic and correlation analysis of silique-traits in Brassica napus L. by quantitative trait locus mapping[J]. Theoretical and Applied Genetics,2011,122(1):21-31.
[39]Yang P,Shu C,Chen L,et al. Identification of a major QTL for silique length and seed weight in oilseed rape (Brassica napus L.)[J]. Theoretical and Applied Genetics,2012,125(2):285-296.
[40]Fu Y,Wei D Y,Dong H L,et al. Comparative quantitative trait loci for silique length and seed weight in Brassica napus[J]. Scientific Reports,2015,5:14407.
[41]張 春,赵小珍,庞承珂,等. 甘蓝型油菜千粒重全基因组关联分析[J]. 作物学报,202 7(4):650-659.
[42]朱恒星,闫晓红,方小平,等. 甘蓝型油菜千粒重性状的QTL初步定位研究[J]. 植物遗传资源学报,2012,13(5):843-850.
[43]Khattak A N. QTL mapping and analysis of agronomic traits in a recombinant inbred line (RIL) population of Brassica juncea[D]. 贵阳:贵州大学,2021:41-44.
[44]Zhao H F,Yan W,Yu K J,et al. QTL identification for nine seed-related traits in Brassica juncea using a multiparent advanced generation intercross (MAGIC) population[J]. Czech Journal of Genetics and Plant Breeding,2021,57(1):9-19.
[45]Dhaka N,Rout K,Yadava S K,et al. Genetic dissection of seed weight by QTL analysis and detection of allelic variation in Indian and East European gene pool lines of Brassica juncea[J]. Theoretical and Applied Genetics,2017,130(2):293-307.
[46]Liu J,Hua W,Hu Z Y,et al. Natural variation in ARF18 gene simultaneously affects seed weight and silique length in polyploid rapeseed[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(37):E5123-E5132.
[47]Shi L L,Song J R,Guo C C,et al. A CACTA-like transposable element in the upstream region of BnaA9.CYP78A9 acts as an enhancer to increase silique length and seed weight in rapeseed[J]. The Plant Journal,2019,98(3):524-539.
[48]Miller C,Wells R,McKenzie N,et al. Variation in expression of the HECT E3 ligase UPL3 modulates LEC2 levels,seed size,and crop yields in Brassica napus[J]. The Plant Cell,2019,31(10):2370-2385.
[49]李文静. 拟南芥种子大小调控基因CY的初步研究[D]. 武汉:华中农业大学,2018:1-2.
[50]Zhang Y Y,Du L,Xu R,et al. Transcription factors SOD7/NGAL2 and DPA4/NGAL3 act redundantly to regulate seed size by directly repressing KLU expression in Arabidopsis thaliana[J]. The Plant Cell,2015,27(3):620-632.
[51]Du L,Li N,Chen L L,et al. The ubiquitin receptor DA1 regulates seed and organ size by modulating the stability of the ubiquitin-specific protease UBP15/SOD2 in Arabidopsis[J]. The Plant Cell,2014,26(2):665-677.
[52]Liu Q,Han R X,Wu K,et al. G-protein βγ subunits determine grain size through interaction with MADS-domain transcription factors in rice[J]. Nature Communications,2018,9:852.
[53]Sun S Y,Wang L,Mao H L,et al. A G-protein pathway determines grain size in rice[J]. Nature Communications,2018,9:851.
[54]Hu S L,Sanchez D L,Wang C L,et al. Brassinosteroid and gibberellin control of seedling traits in maize (Zea mays L.)[J]. Plant Science,2017,263:132-141.
[55]Song X J. Crop seed size:BR matters[J]. Molecular Plant,2017,10(5):668-669.
[56]Fang W J,Wang Z B,Cui R F,et al. Maternal control of seed size by EOD3/CYP78A6 in Arabidopsis thaliana[J]. The Plant Journal,2012,70(6):929-939.
[57]Qi X L,Liu C L,Song L L,et al. PaCYP78A9,a cytochrome P450,regulates fruit size in sweet cherry (Prunus avium L.)[J]. Frontiers in Plant Science,2017,8:2076.
[58]李鵬锋. 甘蓝型油菜氮素利用基因网络的构建及候选基因筛选[D]. 重庆:西南大学,2021:11-12.
[59]艾丽萍,申 奥,高志超,等. 水稻同源异型域转录因子OsHox9的反向遗传学分析[J]. 中国水稻科学,2014,28(3):223-228.
[60]Sahni S,Prasad B D,Liu Q,et al. Overexpression of the brassinosteroid biosynthetic gene DWF4 in Brassica napus simultaneously increases seed yield and stress tolerance[J]. Scientific Reports,2016,6:28298.
[61]Xiao Y G,Sun Q B,Kang X J,et al. SHORT HYPOCOTYL UNDER BLUE1 or HAIKU2 mixepression alters canola and Arabidopsis seed development[J]. New Phytologist,2016,209(2):636-649.
[62]Li Y H,Zheng L Y,Corke F,et al. Control of final seed and organ size by the DA1 gene family in Arabidopsis thaliana[J]. Genes & Development,2008,22(10):1331-1336.
[63]Wang J L,Tang M Q,Chen S,et al. Down-regulation of BnDA1,whose gene locus is associated with the seeds weight,improves the seeds weight and organ size in Brassica napus[J]. Plant Biotechnology Journal,2017,15(8):1024-1033.

