CircRHOT1调节miR-187-3p/SOX4轴对乳腺癌细胞增殖、凋亡和免疫逃逸的影响
孙沛 姜振伟 刘倩
(1.武汉市普仁医院检验科,武汉 430080;2.武汉市普仁医院肿瘤科,武汉 430080)
乳腺癌是世界各地最常见的妇科恶性肿瘤,具有生长迅速、易转移的特性,是导致女性癌症死亡的主要原因之一,临床以手术切除、化疗、免疫治疗等综合治疗为主,但乳腺癌细胞发生的免疫逃逸会限制其临床疗效,因此全面探索乳腺癌生长及免疫逃逸的机制对其临床疗效的提升尤为重要[1-3]。环状RNA ras同源物基因家族成员T1(circular RNA ras homolog family member T1,CircRHOT1)作为一种具有致癌作用的环状RNA,在膀胱癌、肝癌、乳腺癌等恶性肿瘤中高度表达,敲除CircRHOT1可显著抑制膀胱癌增殖和迁移,并增强其对NK细胞敏感性,降低肝癌细胞的生长、迁移和侵袭能力,还可通过增强铁死亡来抑制乳腺癌细胞增殖和体内乳腺癌肿瘤生长,并诱导其大量凋亡[4-6],从机制上讲,CircRHOT1作为微小RNA(miRNA)的海绵来调控下游癌基因表达,进而介导人类癌症发生和进展,通过查询Starbase数据库进行生物信息学分析可知,CircRHOT1可能通过海绵化miR-187-3p来调节性别决定区Y框蛋白4(sex-determining region Y-box 4,SOX4)的表达。研究显示,miR-187-3p是一种具备抗癌功效的微小RNA分子,可介导癌细胞的增殖、凋亡、迁移和肿瘤免疫微环境进展,上调miR-187-3p可抑制人肾透明细胞癌细胞体内外增殖和侵袭,并改善其肿瘤免疫浸润微环境,还能显著降低乳腺癌细胞增殖活性,增强其对吉西他滨的敏感性,并促进其细胞凋亡[7-8];SOX4是调控嵌合抗原受体T细胞功能和恶性肿瘤发生的关键因子,在人类原发性恶性肿瘤中高表达,并可增强乳腺癌在体内外的生长和转移[9],下调SOX4可通过延缓嵌合抗原受体T细胞功能衰竭以提高实体瘤的免疫治疗效果,还可显著降低乳腺癌细胞的增殖和迁移能力,并促使其凋亡[10-11],因而推测CircRHOT1可能通过调节miR-187-3p/SOX4轴影响乳腺癌细胞增殖、凋亡和免疫逃逸,本文通过敲低体外培养的乳腺癌细胞MCF-7中CircRHOT1和上调miR-187-3p来对此推测进行探讨。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 人正常乳腺上皮细胞MCF-10A(货号:CL-0525)、DMEM/F12培养基(货号:PM150312)、人乳腺癌细胞MCF-7(货号:CL-0149)、MEM培养基(货号:PM150410)、人乳腺癌细胞Hs-578T(货号:CL-0114)、DMEM高糖培养基(PM150210)、人乳腺癌细胞MDA-MB-231(货号:CL-0150A)、Leibovitz's L-15培养基(货号:PM151010)购自武汉普诺赛生命科技有限公司;脂质体2000(货号:11668-027)、特级胎牛血清(货号:16000-044)购自美国Gibco公司;总RNA提取试剂Trizol(R1100)、MTT细胞增殖检测试剂盒(货号:M1020)、人外周血淋巴细胞分离液(货号:P8610)、Annexin V-FITC/PI凋亡检测试剂盒(货号:CA1020)、一步法实时荧光定量PCR试剂盒(T2210)购自北京索莱宝科技有限公司;兔抗人Anti-SOX4抗体(货号:abs132989)购自上海优宁维生物科技股份有限公司;FITC标记的抗人CD8抗体(货号:ab95591)、辣根过氧化物酶标记山羊抗兔IgG二抗(货号:ab205718)、小鼠抗人Anti-Bcl-2抗体(货号:ab692)购自美国Abcam公司;双萤光素酶报告基因检测试剂盒(货号:E608001)购自上海生工生物工程股份有限公司;EdU-488细胞增殖检测试剂盒(货号:C0071L)、×10结晶紫染色液(货号:C0121)、兔抗人Anti-GAPDH抗体(货号:AF1186)、免疫荧光染色试剂盒-抗小鼠Alexa Fluor 488(货号:P0188)、兔抗人Anti-Bax抗体(货号:AF0057)、免疫荧光染色试剂盒-抗兔Alexa Fluor 555(货号:P0179)购自上海碧云天生物技术有限公司。
1.1.2 实验仪器 实时荧光定量PCR仪(型号:MA-6000)购自济南泰医生物技术有限公司;定时双稳电泳仪电源、四板转印电泳仪、一体式凝胶成像系统、四板垂直电泳仪(型号:DYY-3C、DYCZ-40S、WD-9413D、DYCZ-24KF)购自北京六一生物科技有限公司;酶标分析仪(型号:HBS-1096A)购自无锡集佳智能科技有限公司;研究级生物荧光显微镜、光学显微镜(型号:RX50、EX30)购自北京知微仪器有限公司;流式细胞仪(型号:CyFlow-Cube8)购自广州吉源生物科技有限公司。
1.2 方法
1.2.1 实时荧光PCR和免疫印迹实验检测MCF-10A、MCF-7、Hs-578T、MDA-MB-231细胞CircRHOT1、miR-187-3p与SOX4表达 取出冻存的MCF-10A、MCF-7、Hs-578T、MDA-MB-231细胞,快速放入40 ℃温水浴中解冻复苏,37.5 ℃下1 000 r/min 离心5 min后,分别加入均混有10%特级胎牛血清的DMEM/F12、MEM、DMEM高糖、Leibovitz's L-15培养基,混匀后放入恒温培养箱中培养,当80%细胞融合后进行传代培养,采用Trizol试剂分别提取传代的各细胞总RNA,然后每种细胞取适量总RNA通过一步法进行实时荧光定量PCR反应,具体反应条件依照一步法实时荧光定量PCR试剂盒说明书设定,CircRHOT1、SOX4用GAPDH做内参对照,miR-187-3p用U6做内参对照,各基因所得循环阈值采用2-ΔΔCt算法计算其相对表达,其引物序列见表1。

表1 各基因引物序列Tab.1 Primer sequence of each gene
取传代的MCF-10A、MCF-7、Hs-578T、MDAMB-231细胞,采用RIPA裂解液分别提取其中总蛋白,通过BCA法测出其浓度后煮沸变性,每种细胞取出15 μg总蛋白通过电泳、湿转实验将其分离后转膜,剪下SOX4、GAPDH蛋白后以5%脱脂奶粉溶液封闭、兔抗人Anti-SOX4、GAPDH一抗孵育、洗膜、辣根过氧化物酶标记的山羊抗兔IgG二抗孵育、洗膜、化学发光法显色、摄片,运用Image J软件定量各蛋白灰度值并分析量化其相对表达。
1.2.2 分组处理MCF-7细胞并采集标本 取传代的MCF-7细胞以1×105个/孔接种于24孔板中培养24 h,随机分为对照组、CircRHOT1敲低组、miR-187-3p mimics组、共转染阴性对照组、CircRHOT1敲低+miR-187-3p inhibitor组,除对照组外的其余各组采用脂质体2000并依照其说明指导分组进行转染:CircRHOT1敲低组转染CircRHOT1 siRNA质粒,miR-187-3p mimics组转染miR-187-3p mimics,共转染阴性对照转染空载质粒和miR-187-3p inhibitor阴性对照,CircRHOT1敲低+miR-187-3p inhibitor组转染CircRHOT1 siRNA质粒和miR-187-3p inhibitor,各组细胞均转染24 h后收集其细胞沉淀作为标本备用。
1.2.3 实时荧光PCR和免疫印迹实验检测各组MCF-7细胞CircRHOT1、miR-187-3p与SOX4表达取出1.2.2中收集的各组MCF-7细胞,分别提取出其总RNA和总蛋白后检测各组CircRHOT1、miR-187-3p与SOX4表达,方法见1.2.1。
1.2.4 EdU染色和平板集落形成实验检测各组MCF-7细胞增殖 EdU染色实验:取传代的MCF-7细胞以1×105个/孔密度接种于24孔板中培养24 h,依照1.2.2中方法分组并进行细胞转染,24 h后加入终浓度为10 μmol/L的EdU工作液孵育2 h,并进行DAPI染色,依照EdU-488细胞增殖检测试剂盒说明指导在荧光显微镜下观察各组细胞并拍照,计算EdU阳性率,EdU阳性率(%)=EdU阳性细胞数/总细胞数×100%。
平板集落形成实验:取传代的MCF-7细胞以50个/孔密度接种于24孔板中培养24 h,依照1.2.2中方法分组并进行细胞转染,24 h后弃去含转染试剂的旧培养基,加入新的混有10%特级胎牛血清的MDM培养基继续培养3周,期间每2 d半换1次培养基,然后弃去培养基,对细胞做漂洗、固定、结晶紫染色、漂洗处理,在光学显微镜下观察各组细胞集落并拍照,计算集落生成率,集落生成率(%)=转染组细胞集落数/对照组细胞集落数×100%。
1.2.5 流式细胞实验检测各组MCF-7细胞凋亡取传代的MCF-7细胞以1×105个/孔细胞的密度接种在24孔板中培养24 h,依照1.2.2中方法分组并进行细胞转染,24 h后胰酶消化并收集各组细胞沉淀,以PBS清洗后重悬,测出其细胞密度后每组取出约1×105个细胞,采用凋亡检测试剂盒做Annexin VFITC/PI双染,PBS清洗后重悬,采用流式细胞仪对各组细胞凋亡情况进行检测。
1.2.6 免疫荧光染色检测各组细胞凋亡相关蛋白Bax和Bcl-2表达比值(Bax/Bcl-2) 取传代的MCF-7细胞以1×105个/孔的密度接种于24孔板中培养24 h,依照1.2.2中方法分组并进行细胞转染,24 h后弃去培养基,对细胞做漂洗、固定、封闭处理,然后加入兔抗人Anti-Bax一抗和小鼠抗人Anti-Bcl-2一抗孵育、漂洗、加入免疫荧光染色试剂盒中Alexa Fluor 555偶联抗兔二抗和Alexa Fluor 488偶联抗小鼠二抗孵育、DAPI染色、漂洗,在荧光学显微镜下观察各组细胞Bax(绿色荧光)和Bcl-2表达(红色荧光),运用Image J软件分别定量其平均荧光强度后计算Bax/Bcl-2,Bax/Bcl-2=绿色平均荧光强度/红色平均荧光强度。
1.2.7 流式细胞实验检测与MCF-7细胞共培养的人外周血淋巴细胞中活化CD8+T细胞比例 采用人外周血淋巴细胞分离液提取本院健康志愿者(获得其知情同意书)外周血中淋巴细胞,本研究通过武汉市普仁医院伦理委员会审批[(k2022)年审第(002)号]。以混有10%特级胎牛血清的MEM培养基重悬,测出其细胞密度后以2∶1(人外周血淋巴细胞∶MCF-7细胞)的比例与MCF-7细胞共培养24 h,依照1.2.2中方法分组并进行细胞转染,24 h后吸出各组培养基,收集其中悬浮生长的淋巴细胞,1 000 r/min、37.5 ℃ 离心5 min后,以PBS清洗后重悬,分别加入FITC标记的抗人CD8抗体避光孵育(每组取一部分细胞加入IgG抗体设空白对照),20 min后再次1 000 r/min、37.5 ℃ 离心 5 min,以PBS清洗、重悬后,采用流式细胞仪对各组淋巴细胞中活化CD8+T细胞比例进行检测。
1.2.8 MTT法检测人外周血淋巴细胞对MCF-7细胞杀伤率 取一个无菌96孔板接种人外周血淋巴细胞和MCF-7细胞建立共培养体系,方法见1.2.7,培养24 h后依照1.2.2中方法分组并进行细胞转染,24 h后吸出各组培养基,弃去其中悬浮生长的淋巴细胞,剩余贴壁生长的MCF-7细胞加入含适量MTT工作液和10%特级胎牛血清的MEM培养基继续培养2 h,然后取出96孔板依照MTT细胞增殖检测试剂盒说明指导检测各组细胞吸光度,计算各组人外周血淋巴细胞对MCF-7细胞的杀伤率,杀伤率(%)=(1-转染组吸光度/对照组吸光度)×100%。
1.2.9 双荧光素酶报告实验检测MCF-7细胞CircRHOT1 对miR-187-3p、miR-187-3p对SOX4的靶向调控 取传代的MCF-7细胞以1×105个/孔的密度接种于24孔板中培养24 h,随机分为野生miR-187-3p+空载组、野生miR-187-3p+CircRHOT1 过表达组、突变miR-187-3p+空载组、突变miR-187-3p+CircRHOT1 过表达组、野生SOX4+miR-187-3p mimics阴性对照组、野生SOX4+CircRHOT1 过表达组、突变SOX4+miR-187-3p mimics阴性对照组、突变SOX4+CircRHOT1 过表达组,采用脂质体2000并依照其说明指导做细胞转染:野生miR-187-3p+空载组转染野生型miR-187-3p和空载质粒,野生miR-187-3p+CircRHOT1 过表达组转染野生型miR-187-3p和CircRHOT1 过表达质粒,突变miR-187-3p+空载组转染突变型miR-187-3p和空载质粒,突变miR-187-3p+CircRHOT1 过表达组转染突变型miR-187-3p和CircRHOT1 过表达质粒,野生SOX4+miR-187-3p mimics阴性对照组转染野生型SOX4 3'-UTR报告质粒和miR-187-3p mimics阴性对照,野生SOX4+CircRHOT1 过表达组转染野生型SOX4 3'-UTR报告质粒和miR-187-3p mimics,突变SOX4+miR-187-3p mimics阴性对照组转染突变型SOX4 3'-UTR报告质粒和miR-187-3p mimics阴性对照,突变SOX4+CircRHOT1 过表达组转染突变型SOX4 3'-UTR报告质粒和miR-187-3p mimics,各组均于转染24 h后收集细胞沉淀,采用双荧光素酶报告基因检测试剂盒并依照其说明指导测定各组双荧光素酶相对活性。
1.3 统计学分析 实验数据采用软件SPSS26.0进行统计学分析,计量资料均采用±s表达。以单因素方差分析对多组间差异进行比较,采用SNK-q检验进行组间两两差异比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 乳腺癌细胞中CircRHOT1、miR-187-3p与SOX4表达检测结果 与人正常乳腺上皮细胞MCF-10A相比,人乳腺癌MCF-7、Hs-578T、MDA-MB-231细胞CircRHOT1、SOX4蛋白与mRNA表达明显升高(P<0.05),miR-187-3p表达明显降低(P<0.05)。见图1、表2。
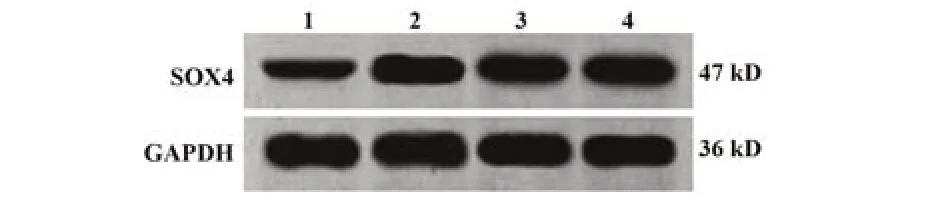
图1 Western blot检测人正常乳腺上皮细胞与乳腺癌细胞系SOX4表达Fig.1 Expression of SOX4 in human normal breast epithelial cells and breast cancer cell lines detected by Western blot
表2 各细胞circRHOT1、miR-187-3p与SOX4的相对表达水平(±s,n=6)Tab.2 Relative expression level of circRHOT1, miR-187-3p and SOX4 in each cell (±s, n=6)
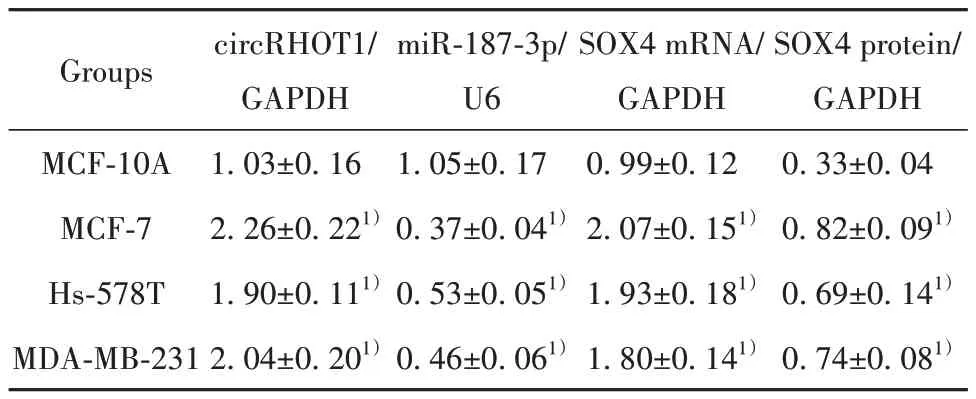
表2 各细胞circRHOT1、miR-187-3p与SOX4的相对表达水平(±s,n=6)Tab.2 Relative expression level of circRHOT1, miR-187-3p and SOX4 in each cell (±s, n=6)
Note:Compared with MCF-10A cells, 1)P<0.05.
SOX4 protein/GAPDH 0.33±0.04 0.82±0.091)0.69±0.141)0.74±0.081)Groups circRHOT1/GAPDH 1.03±0.16 2.26±0.221)1.90±0.111)2.04±0.201)miR-187-3p/U6 1.05±0.17 0.37±0.041)0.53±0.051)0.46±0.061)SOX4 mRNA/GAPDH 0.99±0.12 2.07±0.151)1.93±0.181)1.80±0.141)MCF-10A MCF-7 Hs-578T MDA-MB-231
2.2 各组MCF-7细胞CircRHOT1、miR-187-3p与SOX4表达检测结果 与对照组相比,CircRHOT1敲低组细胞CircRHOT1、SOX4蛋白与mRNA表达降低(P<0.05),miR-187-3p表达升高(P<0.05);miR-187-3p mimics组CircRHOT1表达差异无统计学意义(P>0.05),SOX4蛋白与mRNA表达降低(P<0.05),miR-187-3p表达升高(P<0.05)。与Circ-RHOT1敲低组相比,CircRHOT1敲低+miR-187-3p inhibitor组细胞CircRHOT1表达差异无统计学意义(P>0.05),SOX4蛋白与mRNA表达升高(P<0.05),miR-187-3p表达降低(P<0.05),共转染阴性对照组细胞CircRHOT1、miR-187-3p、SOX4蛋白与mRNA表达差异无统计学意义(P>0.05)。见图2、表3。
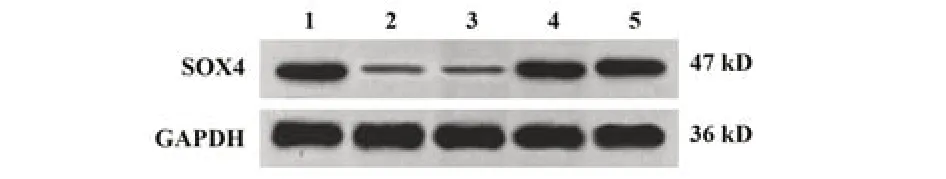
图2 Western blot 检测各组MCF-7细胞SOX4蛋白表达Fig.2 Detection of SOX4 protein expression in MCF-7 cells of each group by Western blot
表3 各组细胞CircRHOT1、miR-187-3p与SOX4的相对表达水平(±s,n=6)Tab.3 Relative expression levels of CircRHOT1, miR-187-3p and SOX4 in cells of each group (±s, n=6)
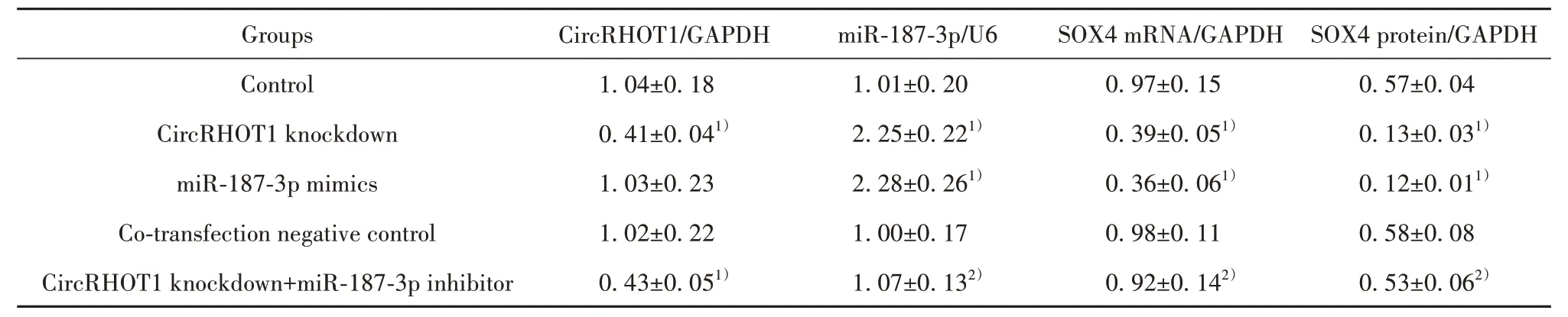
表3 各组细胞CircRHOT1、miR-187-3p与SOX4的相对表达水平(±s,n=6)Tab.3 Relative expression levels of CircRHOT1, miR-187-3p and SOX4 in cells of each group (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with CircRHOT1 knockdown group, 2)P<0.05.
Groups CircRHOT1/GAPDH miR-187-3p/U6 SOX4 mRNA/GAPDH SOX4 protein/GAPDH Control CircRHOT1 knockdown miR-187-3p mimics Co-transfection negative control CircRHOT1 knockdown+miR-187-3p inhibitor 1.04±0.18 0.41±0.041)1.03±0.23 1.02±0.22 0.43±0.051)1.01±0.20 2.25±0.221)2.28±0.261)1.00±0.17 1.07±0.132)0.97±0.15 0.39±0.051)0.36±0.061)0.98±0.11 0.92±0.142)0.57±0.04 0.13±0.031)0.12±0.011)0.58±0.08 0.53±0.062)
2.3 各组MCF-7细胞增殖与凋亡检测结果 与对照组相比,CircRHOT1敲低组、miR-187-3p mimics组细胞EdU阳性率与集落生成率降低(P<0.05),凋亡率升高(P<0.05)。与CircRHOT1敲低组相比,Circ-RHOT1敲低+miR-187-3p inhibitor组细胞EdU阳性率与集落生成率升高(P<0.05),凋亡率降低(P<0.05),共转染阴性对照组细胞EdU阳性率、集落生成率、凋亡率差异无统计学意义(P>0.05)。见图3~5、表4。
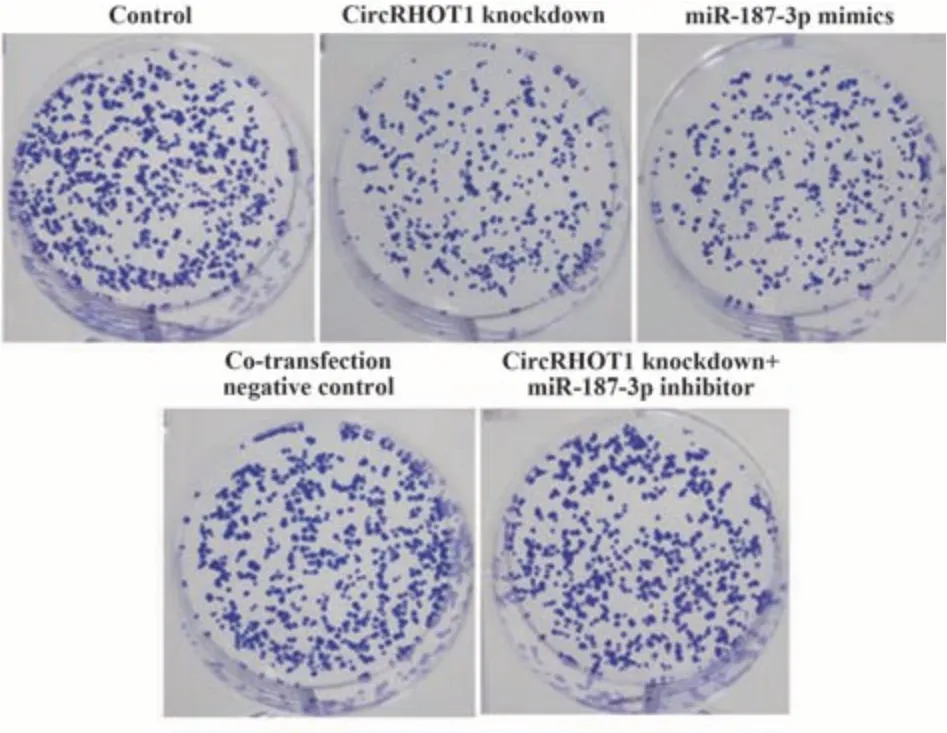
图3 结晶紫染色检测各组MCF-7细胞集落生成(×100)Fig.3 Detection of colony formation of MCF-7 cells in each group by crystal violet staining (×100)
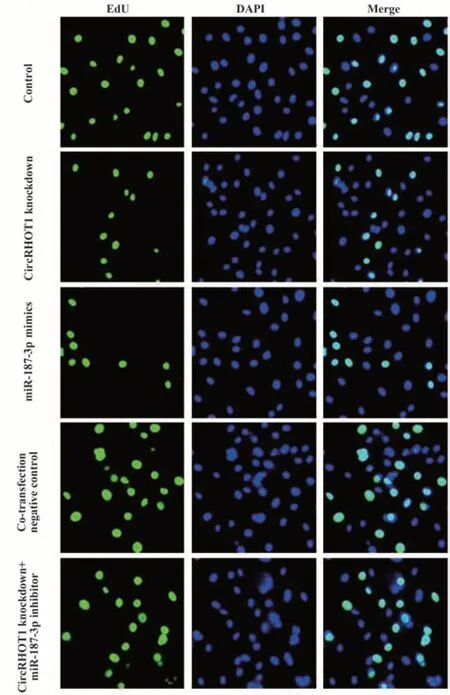
图4 EdU染色检测各组MCF-7细胞增殖(×200)Fig.4 EdU staining to detect proliferation of MCF-7 cells in each group (×200)

图5 流式细胞术检测各组MCF-7细胞凋亡Fig.5 Detection of apoptosis of MCF-7 cells in each group by flow cytometry
表4 各组细胞EdU阳性率、集落生成率、凋亡率(±s,n=6,%)Tab.4 EdU positive rate, colony generation rate and apoptosis rate of cells in each group (±s, n=6,%)

表4 各组细胞EdU阳性率、集落生成率、凋亡率(±s,n=6,%)Tab.4 EdU positive rate, colony generation rate and apoptosis rate of cells in each group (±s, n=6,%)
Note:Compared with control group, 1)P<0.05;compared with Circ-RHOT1 knockdown group, 2)P<0.05.
Groups Control CircRHOT1 knockdown miR-187-3p mimics Co-transfection negative control CircRHOT1 knockdown+miR-187-3p inhibitor EdU positive rate 54.70±8.35 26.20±5.261)23.83±4.641)51.69±9.13 Colony generation rate 100.0±0.00 48.50±10.231)42.14±9.601)96.30±20.15 Apoptosis rate 3.20±0.91 54.91±10.201)49.65±11.141)2.97±0.93 48.78±8.382)90.10±18.302)6.01±1.952)
2.4 各组MCF-7细胞凋亡相关蛋白Bax和Bcl-2表达比值(Bax/Bcl-2)检测 与对照组相比,CircRHOT1敲低组、miR-187-3p mimics组细胞Bax/Bcl-2升高(P<0.05)。与CircRHOT1敲低组相比,CircRHOT1敲低+miR-187-3p inhibitor组细胞Bax/Bcl-2降低(P<0.05),共转染阴性对照组细胞Bax/Bcl-2差异无统计学意义(P>0.05)。见图6、表5。
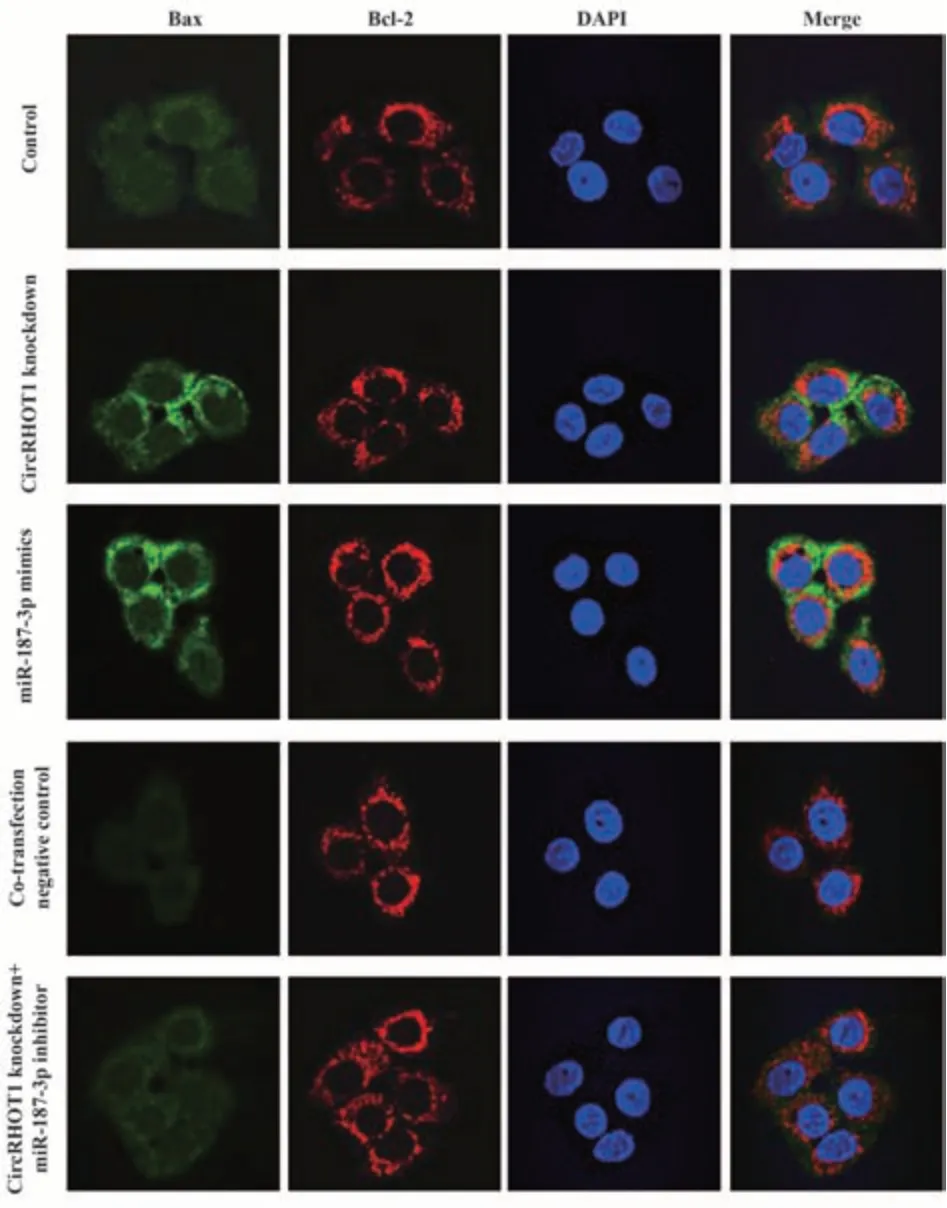
图6 免疫荧光检测各组MCF-7细胞Bax与Bcl-2表达(×1 000)Fig.6 Expressions of Bax and Bcl-2 in MCF-7 cells of each group detected by immunofluorescence (×1 000)
表5 各组细胞Bax/Bcl-2(±s,n=6)Tab.5 Bax/Bcl-2 of cells in each group (±s,n=6)

表5 各组细胞Bax/Bcl-2(±s,n=6)Tab.5 Bax/Bcl-2 of cells in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05;compared with Circ-RHOT1 knockdown group, 2)P<0.05.
Bax/Bcl-2 0.31±0.06 0.59±0.101)0.62±0.121)0.29±0.07 0.36±0.092)Groups Control CircRHOT1 knockdown miR-187-3p mimics Co-transfection negative control CircRHOT1 knockdown+miR-187-3p inhibitor
2.5 各组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞的杀伤率检测结果 与对照组相比,CircRHOT1敲低组、miR-187-3p mimics组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞杀伤率升高(P<0.05)。与CircRHOT1敲低组相比,CircRHOT1敲低+miR-187-3p inhibitor组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞杀伤率降低(P<0.05),共转染阴性对照组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞杀伤率差异无统计学意义(P>0.05)。见表6、图7。
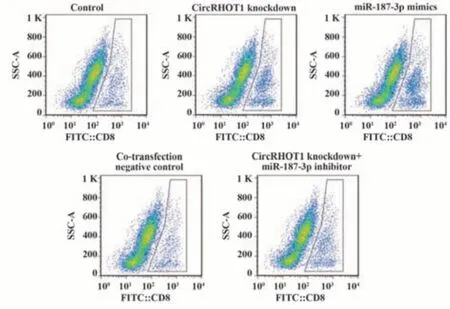
图7 流式细胞术检测人外周血淋巴细胞中活化CD8+T细胞比例Fig.7 Detection of proportion of activated CD8+T cells in human peripheral blood lymphocytes by flow cytometry
表6 各组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞的杀伤率(±s,n=6,%)Tab.6 Proportion of activated CD8+T cells in human peripheral blood lymphocytes and their killing rate to MCF-7 cells in each group (±s, n=6,%)
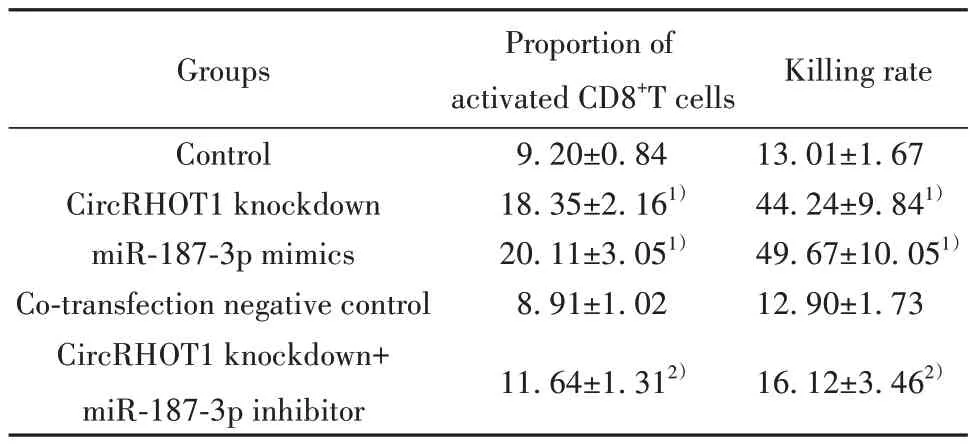
表6 各组人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞的杀伤率(±s,n=6,%)Tab.6 Proportion of activated CD8+T cells in human peripheral blood lymphocytes and their killing rate to MCF-7 cells in each group (±s, n=6,%)
Note:Compared with control group, 1)P<0.05; compared with Circ-RHOT1 knockdown group, 2)P<0.05.
Groups Control CircRHOT1 knockdown miR-187-3p mimics Co-transfection negative control CircRHOT1 knockdown+miR-187-3p inhibitor Proportion of activated CD8+T cells 9.20±0.84 18.35±2.161)20.11±3.051)8.91±1.02 11.64±1.312)Killing rate 13.01±1.67 44.24±9.841)49.67±10.051)12.90±1.73 16.12±3.462)
2.6 MCF-7细胞内CircRHOT1对miR-187-3p、miR-187-3p对SOX4的靶向调节 查询Starbase数据库可知CircRHOT1 与miR-187-3p之间存在结合位点,见图8A。与野生miR-187-3p+空载组比较,野生miR-187-3p+CircRHOT1过表达组相对荧光素酶活性显著降低(P<0.05);突变miR-187-3p+空载组与突变miR-187-3p+CircRHOT1过表达组之间相对荧光素酶活性差异无统计学意义(P>0.05)。见表7。
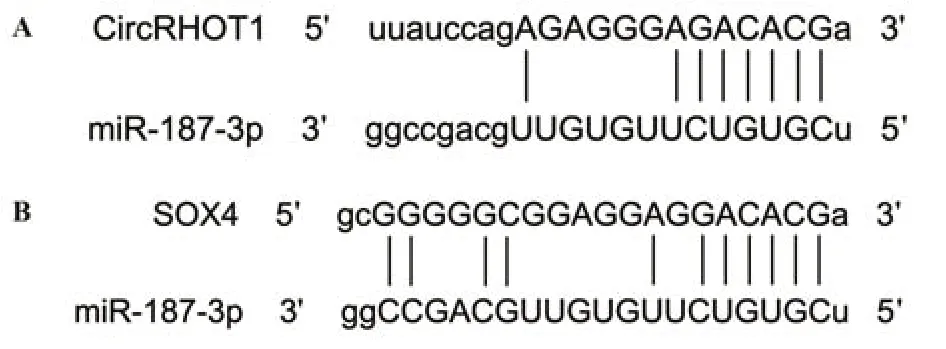
图8 通过Starbase数据库查询得到的CircRHOT1 与miR-187-3p、miR-181-3p与SOX4之间结合位点Fig.8 Binding sites between CircRHOT1 and miR-187-3p,miR-181-3p and SOX4 obtained by querying Starbase database
表7 各组细胞相对荧光素酶活性(±s,n=6)Tab.7 Relative luciferase activity of cells in each group(±s, n=6)
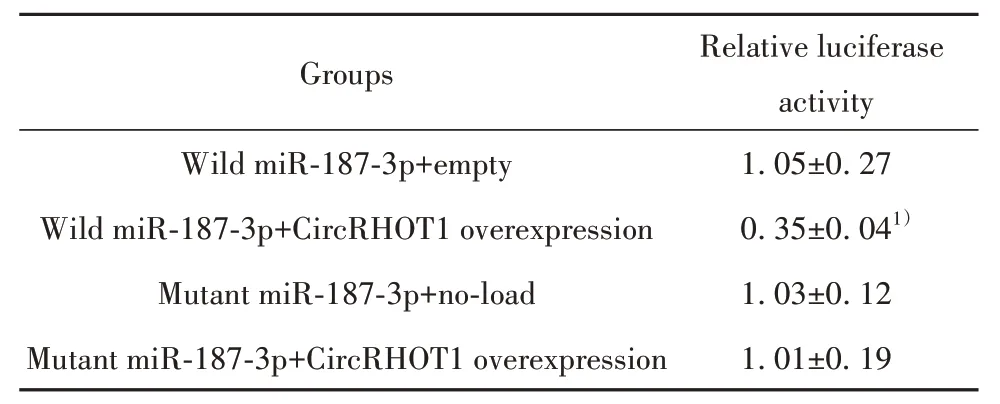
表7 各组细胞相对荧光素酶活性(±s,n=6)Tab.7 Relative luciferase activity of cells in each group(±s, n=6)
Note:Compared with wild miR-187-3p+empty group, 1)P<0.05.
Relative luciferase activity Groups 1.05±0.27 0.35±0.041)1.03±0.12 1.01±0.19 Wild miR-187-3p+empty Wild miR-187-3p+CircRHOT1 overexpression Mutant miR-187-3p+no-load Mutant miR-187-3p+CircRHOT1 overexpression
查询Starbase数据库可知miR-187-3p与SOX4之间有结合位点存在,见图8B。与野生SOX4+miR-187-3p mimics阴性对照组比较,野生SOX4+miR-187-3p mimics组相对荧光素酶活性显著降低(P<0.05);突变SOX4+miR-187-3p mimics阴性对照组与突变SOX4+miR-187-3p mimics组之间相对荧光素酶活性差异无统计学意义(P>0.05)。见表8。
表8 各组细胞相对荧光素酶活性值(±s,n=6)Tab.8 Relative luciferase activity of cells in each group(±s,n=6)
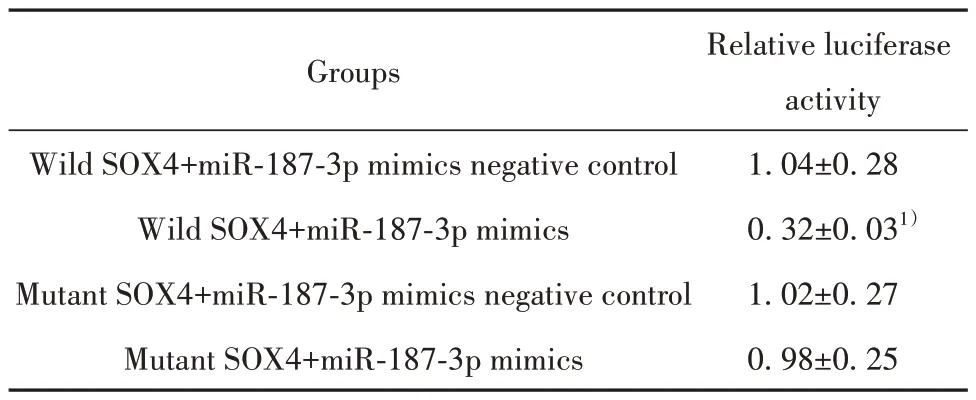
表8 各组细胞相对荧光素酶活性值(±s,n=6)Tab.8 Relative luciferase activity of cells in each group(±s,n=6)
Note:Compared with wild SOX4+miR-187-3p mimics negative control group, 1)P<0.05.
Relative luciferase activity 1.04±0.28 0.32±0.031)1.02±0.27 0.98±0.25 Groups Wild SOX4+miR-187-3p mimics negative control Wild SOX4+miR-187-3p mimics Mutant SOX4+miR-187-3p mimics negative control Mutant SOX4+miR-187-3p mimics
3 讨论
如今乳腺癌临床治疗理念已从“最大可耐受治疗”向“最小的有效治疗”转变,保乳手术逐渐取代了全乳房切除术,很多研究证实保乳术后留下的乳房组织微环境在后续治疗中发挥积极作用,通过增强乳房组织中乳腺癌所处微环境中免疫细胞活性,可诱发抗肿瘤免疫反应,促使全身乳腺癌细胞死亡,因此探寻有效抑制癌细胞增殖和免疫逃逸的手法对于改善乳腺癌患者预后具有积极意义[12-13]。CircRHOT1作为一种致癌基因,在乳腺癌中表达明显升高,可促进乳腺癌体内生长和恶性进展,对其进行敲除能够抑制乳腺癌细胞的增殖、侵袭和迁移,并诱导其凋亡,还可诱导细胞周期阻滞,显著促进非小细胞肺癌和胰腺癌细胞凋亡,降低其增殖活性[6,14-15]。本研究结果显示,人乳腺癌MCF-7、Hs-578T、MDA-MB-231细胞CircRHOT1表达相比人正常乳腺上皮细胞MCF-10A明显升高,以CircRHOT1 siRNA质粒敲低MCF-7细胞CircRHOT1表达,可降低CircRHOT1表达、EdU阳性率、集落生成率,提高细胞凋亡率、Bax/Bcl-2、人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞的杀伤率,表明敲低CircRHOT1可促进促凋亡蛋白表达,降低乳腺癌细胞增殖活力,抑制其免疫逃逸,促进人外周血淋巴细胞中CD8+T活化并增强其对MCF-7细胞杀伤力,对乳腺癌发挥明显抗癌功效。
研究显示,CircRHOT1介导癌症发生发展的机制是通过海绵化miRNA来促进致癌基因表达,查询Starbase数据库可知,CircRHOT1可能通过结合miR-187-3p来调控SOX4表达,且miR-187-3p可在多种癌症中发挥抗肿瘤作用,其过度表达能损害结直肠癌细胞集落形成、细胞迁移和侵袭功能,并诱导增强其化疗敏感性,且与转移性乳腺癌患者无进展生存期和总生存期的增加有关,可显著抑制乳腺癌细胞增殖并促进其凋亡[8,16-17];SOX4作为一种致癌基因在乳腺癌中高表达,并显著促进其肿瘤生长和恶性进展,敲除SOX4可抑制乳腺癌细胞的增殖、迁移和侵袭,并改善嵌合抗原受体T细胞功能,提升其对实体肿瘤的杀伤效果,因此推测敲除Circ-RHOT1抑制乳腺癌细胞增殖和免疫逃逸的分子机制可能是通过上调miR-187-3p来降低SOX4表达[10,18-19]。本研究结果显示,人乳腺癌MCF-7、Hs-578T、MDA-MB-231细胞miR-187-3p表达相比人正常乳腺上皮细胞MCF-10A明显降低,SOX4蛋白与mRNA表达明显升高,以CircRHOT1 siRNA质粒敲低MCF-7细胞CircRHOT1表达,可升高miR-187-3p表达,降低SOX4蛋白与mRNA表达,且双荧光素酶报告实验结果显示CircRHOT1可靶向下调miR-187-3p表达,miR-187-3p可靶向下调SOX4表达,说明CircRHOT1可通过调节miR-187-3p/SOX4轴介导乳腺癌细胞增殖、凋亡和免疫逃逸,且miR-187-3p/SOX4轴参与敲低CircRHOT1对乳腺癌细胞增殖和免疫逃逸的抑制过程。另外联合转染CircRHOT1 siRNA质粒和miR-187-3p inhibitor,相比单独转染CircRHOT1 siRNA质粒,可升高SOX4蛋白与mRNA表达、EdU阳性率、集落生成率,降低miR-187-3p表达、凋亡率、Bax/Bcl-2、人外周血淋巴细胞中活化CD8+T细胞比例及其对MCF-7细胞杀伤率,说明下调miR-187-3p可减弱敲低CircRHOT1对乳腺癌细胞的抗增殖和促凋亡作用,拮抗其对免疫逃逸的抑制,最终消除其对乳腺癌的抗肿瘤功效,提示敲低CircRHOT1抑制乳腺癌细胞增殖、免疫逃逸,并促使其凋亡是通过上调miR-187-3p实现的。
综上所述,本研究证实了CircRHOT1可通过调节miR-187-3p/SOX4轴介导乳腺癌细胞增殖、凋亡和免疫逃逸过程,敲低CircRHOT1可通过上调miR-187-3p而降低SOX4表达,从而明显抑制乳腺癌细胞增殖,促进其凋亡,促使CD8+T细胞活化并增强其杀伤力,减轻乳腺癌免疫逃逸,最终起到显著抗癌作用,本研究揭示了调控乳腺癌生长和免疫逃逸的新分子机制,有助于开发改进其临床免疫和分子靶向治疗方法。

