表面肌电与运动诱发电位在脊髓运动完全性损伤评估中的比较
萧演清 高明明 何泽佳 宋桂芸 宋伟 李晓光 饶家声


【摘要】目的比较基于表面肌电图(sEMG)的脑运动控制方案和基于经颅磁刺激(TMS)的运动诱发电位在脊髓运动完全性损伤患者评估中的敏感性。方法纳入中国康复研究中心2021年3月—2023年4月收治的31例临床诊断为脊髓运动完全性损伤的患者,分别进行基于表面肌电的运动控制检测和基于TMS的运动诱发电位检测。结果31例患者中,27个(87%)至少有一个通道排名4或5。31例患者共测试了248块肌肉(每一例患者共测8块肌肉,分别是左右两侧的股直肌、股二头肌、胫前肌和腓肠肌),其中有79块(32%)肌肉可测量出通道排名4或5。62个肢体中的40个(64%)至少有一个通道排名4或5。31例患者中有21例(68%)有最高排名5的通道。然而,31例患者无一例能检测出運动诱发电位。结论sEMG在脊髓运动完全性损伤患者评估中的敏感性明显高于运动诱发电位。
【关键词】脊髓损伤;表面肌电图;经颅磁刺激;运动诱发电位
【中图分类号】R651【文献标志码】A【文章编号】16727770(2024)02015607
Comparison of surface electromyography and motor evoked potential in assessment of complete spinal cord motor injury XIAO Yanqing, GAO Mingming, HE Zejia, et al. Beijing Key Laboratory for Biomaterials and Neural Regeneration, Beijing Advanced Innovation Center for Biomedical Engineering, School of Biological Science and Medical Engineering, Beihang University, Beijing 100191, China
Corresponding authors: RAO Jiasheng, SONG Wei
Abstract: ObjectiveTo compare the sensitivity of surface electromyography(sEMG) based brain motor control protocol and transcranial magnetic stimulation(TMS) based motor evoked potentials in the evaluation of patients with complete spinal cord motor injury. Methods31 patients diagnosed complete spinal cord motor injury were admitted to the China Rehabilitation Research Center from March 2021 to April 2023 underwent sEMG based motor control detection and TMS based motor evoked potential detection, respectively. Results27 of 31 patients(87%) had at least one channel ranked 4 or 5, and a total of 248 muscles were tested in 31 patients(8 muscles per patient, rectus femoris, biceps femoris, anterior tibialis and gastrocnemius on the right and left sides), of which 79(32%) muscles could be measured with a channel ranked 4 or 5. 40 of 62 limbs(64%) had at least one channel rank 4 or 5, and 21 of 31 patients(68%) had the highest rank 5 channel. However, none of the 31 patients were positive in TMSbased motor evoked potential testing. ConclusionSEMG is significantly more sensitive than motor evoked potentials in the evaluation of patients with complete spinal cord motor injury.
Key words: spinal cord injury; surface electromyography; TMS; motor evoked potentials
脊髓损伤(spinal cord injury,SCI)是一种破坏性神经系统疾病,可导致不可逆的感觉和运动障碍。个体损伤平面和感觉运动损伤程度的准确分类对于医疗和康复管理至关重要。神经电生理检查可以提供损伤后备用运动活动的更详细情况,因此是脊髓损伤神经学分类国际标准(International Standards for Neurological Classification of Spinal Cord Injury,ISNCSCI)的重要补充[1]。
脑运动控制评估(brain motor control assessment,BMCA)最早是一种基于表面肌电图(surface electromyography,sEMG)的测量下肢在严格控制条件下进行各种反射和自主运动时中枢神经系统运动输出的方法,使用肌电图的神经生理学检查可以捕获可能无法触及的最小收缩活动量。事实上,使用肌电图的研究表明,被归类为运动完全性 SCI的患者可以在损伤水平以下保留肌肉自主收缩[27]。
经颅磁刺激(transcranial magnetic stimulation,TMS)可以客观地评估大脑对肢体残余运动控制通路的活动、募集以及可塑性[89]。TMS在初级运动皮层引起的MEP存在已被用于表明SCI 患者皮质脊髓束至少部分保留。据报道,尽管被诊断为运动完全性SCI,仍可在没有检测到运动功能的肌肉中存在运动诱发电位(motor evoked potential,MEP),包括腹部、下肢和盆底肌肉[1012]。
目前为止,还没有研究比较这两种电生理方法在脊髓运动完全损伤患者评估中的敏感性。另外,中国尚未开展利用基于表面肌电的BMCA在脊髓运动完全性损伤中的评估应用。因此,本研究回顾性分析中国康复研究中心住院部2021年3月—2023年4月收治的31例临床诊断为脊髓运动完全性损伤的患者,旨在利用sEMG检测运动完全性SCI患者残余运动控制功能,比较sEMG和运动诱发电位在检测运动完全性SCI患者的残留运动功能的敏感性。
1资料与方法
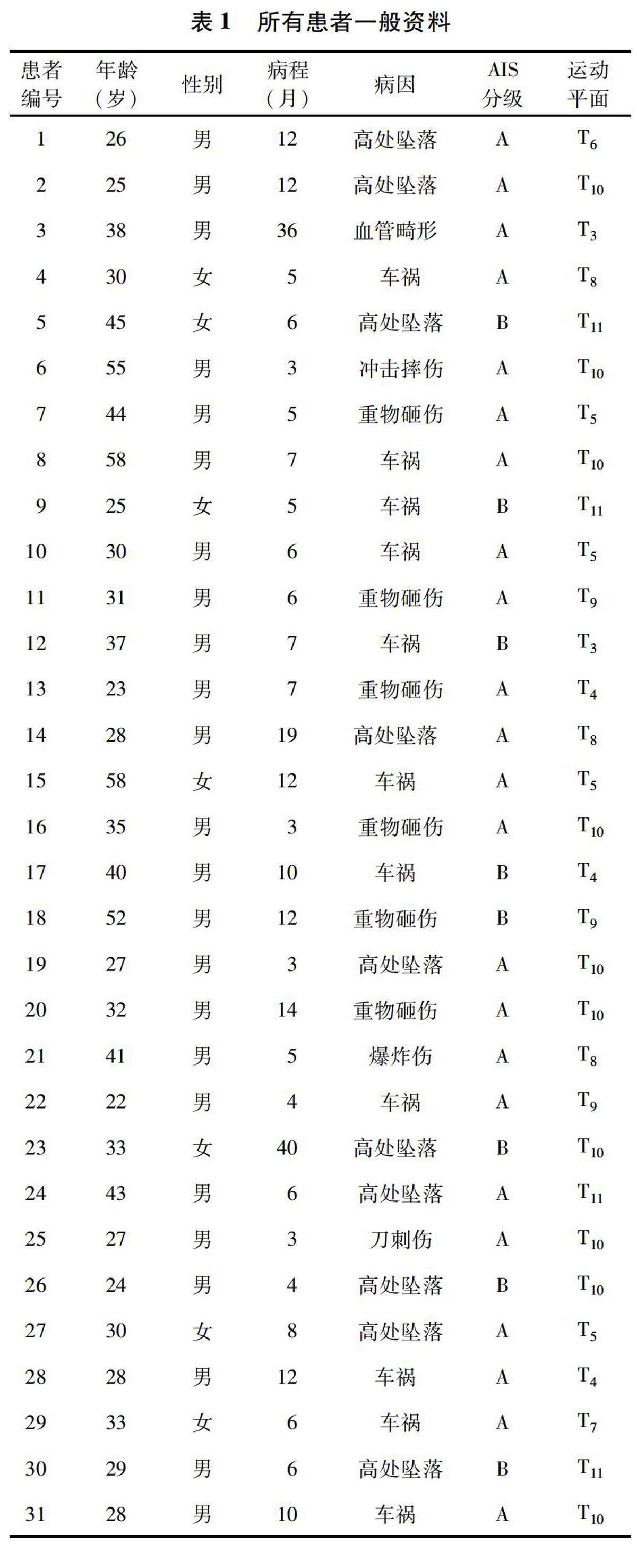
1.1一般资料共入组31例SCI患者,其中男24例,女7例;年龄23~58岁,平均34(34.23±10.58)岁;所有患者病程在3个月及以上,平均(9.41±8.40)个月。所有患者为胸段脊髓运动完全性损伤。基于既往ISNCSCI评估,简明损伤定级标准(abbreviated injury scale,AIS)分布为23例AIS A(运动/感觉完全)和8例AIS B(运动完全/感觉不完全)。排除下肢严重痉挛者、SCI合并脑外伤者、重度认知障碍不能配合者、癫痫者、有其他疾病影响运动和感觉功能者、植入起搏器和其他植入型医疗设备者。在首次AIS分类时确定病变程度后,使用传统肌电图对所有受试者的双下肢胫前肌进行神经传导检查,以排除圆锥/尾状神经病变、伴随的外周神经损伤和先前存在的神经病变的可能性。见表1。所有研究程序均获得医学伦理审查委员会的批准,并在受试者签署知情同意书后进行。
1.2实验设计与程序
1.2.1sEMG数据采集与分析临床检查之后紧接着是基于BMCA的自主运动评估。所用设备是表面肌电测试仪(美国)Noraxon 3 3.8.6,记录双侧股直肌、股二头肌、胫前肌和腓肠肌sEMG。sEMG数据被连续数字化,用时大约40 min,采样率为2 000 Hz,使用12位数模转换。表面肌电数据的记录增益为1 000,带通频率为30~500 Hz。 所有动作均在仰卧位下尝试。方案顺序从5 min放松开始。接下来,要求受试者按顺序尝试双侧髋膝关节屈伸、右侧髋膝屈伸,左侧髋膝屈伸,双侧踝背屈和跖屈,右侧踝背屈和跖屈,左侧踝背屈和跖屈。不管患者是否有能力完成要求的运动任务,都要鼓励他们尽最大努力。指令具体如下:如双侧髋膝关节的屈曲和伸展成对进行两阶段任务测试,测试对象被告知:“请等待声音开始,我们将要求你做一系列自主动作。请尽你最大的努力,即使你可能感觉不到任何移动。记住,我们可以观察到很小的肌肉活动。每个动作重复3次,第一次是将双膝抬到胸前,直到听到二音,然后将双膝伸直,当二音结束时放松。”其余动作指令类同[3]。
在记录期间和之后检查表面肌电数据,以确定信号质量和全带宽数据中是否存在伪影。信号质量验证后,使用均方根(root mean square,RMS)算法计算表面肌电活动范围。这个值被认为是随着时间的推移相应的脊髓运动神经元池活动的估计值。每个动作都是通过事件标记通道识别的,并对每个记录通道(肌肉)提取有效值包络数据的时间段。在每个时间段和基线上每个通道的数据,通过减去每次动作前1 s内的平均活动量进行校正。然后在方案中个体每个运动任务的3次重复中,对基线校正后的动作反应进行平均。然后这些值被用作测量在每次运动任务中肌肉运动输出的数值。系统噪声小于1∶V(RMS)。如果给定肌肉任务的3次收缩试验的平均RMS振幅超过平均静息值(从所有试验计算得出)以上2个标准差,则该值被定义为是“存在”有意义的肌电[4,1314]。
1.2.2运动诱发电位检测与数据分析通过使用常规圆形线圈磁刺激器施加单脉冲TMS来记录运动诱发电位。为了记录来自胫骨前肌(tibialis anterior,TA)的MEP,从顶点大约4 cm的嘴侧开始确定刺激热点。在每个检查阶段,首先在顶点刺激头皮,然后按照标准公布的程序逐步优化线圈位置以获得最大TA的MEP来确定最佳头皮位置。确定运动阈值,并在1.2倍运动阈值下记录MEP,同时所有具有足够肌肉力量的受试者轻微激活他们的TA(约为最大力量的10%)。不能产生力量的患者被要求尽可能多地发挥意志神经支配。单相经颅单脉冲刺激的持续时间为100 μs。采样频率为2 000 Hz,带通滤波器设置为30 Hz~1 kHz。TMS每5~6 s进行一次。如果存在明确的反应,则在所需刺激强度下施加3~5个代表性TA的MEP。如果存在可见但不明确的肌肉反应,则施加多达10个刺激,以优化离线存储的3个反应以供进一步分析。4次重复MEP试验中最快反应的开始时间被确定为开始潜伏期。MEP振幅是从基线到负峰值(即多相电位中的最高负峰值)计算的,用于4次试验中最大的反应。分析两侧的TAMEP潜伏期和振幅。
MEP存在/不存在的临界值是一个可重复的电位,其振幅至少比背景肌电图活动高100 μV。潜伏期根据身高相关的标准值。如果MEP的潜伏期比正常值延长2个标准差以上(MEP正常潜伏期=0.199×高度6.966),则视为延迟。除非另有规定,否则所有数据均以均数±标准差(x±s)的形式给出。统计MEP存在的患者数量,平均波幅,以及潜伏期[1517]。
1.3统计学分析sEMG确定活动通道,目视检查等级。对每个通道的所有试验进行目视检查是一种有效的分析方法。以与Calancie等[14]使用的排序系统相似的方式,根据观察到的活性模式,每个收集的通道的排序为15(图1)。尽管排序是主观的,但使用指南对通道进行排序,保证结果的可靠性。(1)无明显活动,基线噪声;(2)检测到稀疏运动单元动作电位,为单一棘波而非爆发波,但与运动线索无明确相关性;(3)检测到爆发活动,但与运动线索无明确相关性;(4)爆发活动,与线索相关但没有精确性(几个假阳性)或没有可重复性;(5)反复爆发的可見活动,在2~3个线索内相关性良好。符合每个标准的轨迹示例如图1所示。对于后续分析,排名4或5的通道被称为活动通道。统计所有参与者每个肢体的活动通道总数,并统计引出运动诱发电位的患者数量及其平均波幅及潜伏期。
2结果
使用目视检查,31个患者中,27个(87%)至少有一个通道排名4或5,31例患者共测试了248块肌肉(每一例患者共测8块肌肉,分别是左右两侧的股直肌、股二头肌、胫前肌和腓肠肌),其中有79块(32%)肌肉可测量出通道排名4或5;62个肢体中的40个(64%)至少有一个通道排名4或5,31例患者中有21例(68%)有最高排名5的通道(表2、图2)。图3显示了其中一个患者等级为5的活动通道。31例患者MEP均未引出(图4)。
在视觉检查分析中排名为4的通道用蓝色条显示,排名5的通道用紫色条显示;共有27个患者至少有一个通道排名4或5,13,14,17,24号患者未见活动通道
3讨论
许多研究已经证明,即使通过标准临床试验诊断为完全SCI的病例,在SCI中仍存在完整的神经元轴突。解剖学检查发现,即使在严重的SCI后,脊髓实质的连续性仍然存在[18]。解剖学研究报道,约50%~75%的“临床完全性”SCI在损伤节段表现出一定的连续性[1921]。此外,早在1986年,使用sEMG记录的生理学研究被用于证明完全性SCI病变中存在通路的连续性[22]。McKay等[4]发现64%最初归类为运动完全性损伤的受试者(n=67)有残余运动控制的证据。在另一项研究中,Calancie等报告了一个小样本群体,归类为脊髓运动完全性损伤,保留了一侧足部肌肉的随意sEMG控制[23]。Sherwood等[24]定义了术语“不完全(discomplete)”来描述临床上完全损伤但病变下方残留脊髓功能影响的神经生理学证据的病变。
本研究结果显示,31个临床诊断为脊髓运动完全性损伤的患者中,27个患者(87%)在表面肌电检查任务中显示至少一块肌肉存在可测量的肌肉激活。这与先前的研究一致,临床完全性SCI患者中有84%是脊髓運动不完全性损伤(discomplete)[24]。Moss等[25]检查了12例脊髓运动完全性损伤受试者的下肢肌电信号,发现89%的肌肉有明显的活动,每名参与者至少有2块肌肉被确定为活动通道。这些研究结果显示了临床上被归类为运动完全性的SCI患者通过sEMG可检测出意志肌电,sEMG检测残余的神经功能具体有高度的敏感性。
此外,本研究已经排除了痉挛或自发活动造成的假阳性。由于许多原因,对这些类型的信号进行分类并不像传统的肌电分析那样简单。信号的性质包括可能产生假阳性的混杂因素,如痉挛或自发活动。由于大多数受试者多年来没有尝试激活这些肌肉,最初的尝试可能没有产生任何残余下行轴突的最佳激活,也得不到本体感觉反馈,肌肉也很可能萎缩。这些因素使得建立意志活动肌电的临界值标准成为一项艰巨的任务。将标准设置得太严格将导致可能的意志活动被忽视,设置得太松可能意味着噪音或自发活动被计为意志活动。本研究通过目视检查,按照分类标准,可以很容易地将特定信号的潜在效用进行分类。
TMS作为另外一种非侵入性电生理技术,已被反复提出作为补充SCI患者临床评估的方法[2628]。然而大多数临床分类为运动完全性损伤(AIS A和B)的SCI患者腿部肌肉缺乏MEP,研究发现只有2%的一小部分患者在康复过程中表现出较小的MEP[29]。另一研究发现,临床运动完全性颈髓损伤患者,也只有7%的上肢MEP反应呈阳性[30]。在本研究中,31例胸段脊髓运动完全性损伤的患者,无一例MEP阳性。
然而,一项纵向研究监测了305例完全性和不完全性SCI患者在急性创伤性SCI后15 d、1个月、3个月、6个月和12个月时的小指展肌MEP[31]。在AIS A患者中,63%在整个研究过程中都有一些MEP。该研究结果表明,临床诊断完全性损伤的患者中,需要多次随访检测,才有可能检测到MEP。
TMS研究结果之间的这种差异与检测技术存在相当大的试验间可变性有关。MEP振幅在同一受试者中高度可变[3235],因此需要连续测量来获得受刺激皮层部位的皮质脊髓兴奋性的可靠估计。尽管MEP振幅变化的性质尚不清楚,一些生理因素也会影响MEP幅度,如刺激前收缩、注意力、唤醒、动作电位的去同步和传入反馈。最近研究发现,损伤程度也是影响MEP可靠性的重要因素,在较高肌力级别的肌肉中获得的TMS指标的可靠性大约是在较低肌力级别肌肉中收集的指标的两倍。肌力较差的不完全性SCI和慢性期患者表现出更大的指标变异性[36]。
除了这些生理因素外,刺激次数[3738]、线圈方向[39]、最佳头皮位置[40]和环境噪声等物理参数也可能在MEP振幅的可变性中发挥重要作用。刺激强度[110%静息运动阈值(resting motion threshold,rMT)和120%rMT]也是一个重要因素[38]。运动阈值,定义为TMS强度[表示为最大刺激器输出(maximum stimulator output,MSO)的百分比],用于引发一致的MEP,在SCI受损的肌肉中TMS强度通常更高[41]。在某些情况下,即使在最大强度(即100%MSO)下,阈值也可能太高而无法引发MEP,从而导致假阴性解释,可能存在的残余连通性因此未被发现。
这种“discomplete”的发现能为临床医生治疗SCI患者提供重要的信息。 首先,根据定义,“discomplete”损伤的患者有穿过损伤区的神经通路,可能为未来的治疗方法提供前提。因此,在选择破坏性手术治疗此类患者痉挛或疼痛时应谨慎。其次,这种亚临床测量方法可以用来描述横穿SCI的运动控制,从而能早期识别自主控制,并给予训练和支持,随着时间的推移,自主控制可能成为有用的运动。最后,新的和有前途的干预措施,可利用不完全性SCI标志物的神经联系所提供的兴奋和抑制功能在基础神经科学实验室等待恢复有用的功能,促进保护未受损神经元,操纵突触,神经植入和其他治疗策略从动物研究模型向人类患者群体的转化。
雖然在SCI评估中,TMS运动诱发电位是临床上更常用的技术,但是,在完全性SCI的患者TMS检测中存在个体中的变异性较大,总体阴性率较高的问题。相反,sEMG在完全性SCI患者评估中的敏感性更高,大量的研究证实该技术在临床诊断完全性运动损伤的脊髓患者中检测出残余运动功能控制的百分比都在60%以上。国际上基于表面肌电的BMCA评估方案在临床上的应用已经有30余年的历史。目前国际上SCI治疗新技术的临床试验如脊髓电刺激植入术在术前大多会采用包括BMCA在内的电生理评估[6,42]。梅奥医学中心对1例AIS A级的T6损伤患者进行脊髓电刺激植入,术前TMS运动诱发电位阴性,而基于表面肌电的BMCA检测是阳性,从而确定患者是“discomplete”[6]。2021年美国迈阿密大学的截瘫计划报道了一项1期研究,将自体纯化的施旺细胞悬浮液移植到患有亚急性完全胸部SCI的参与者的损伤中心,试验期间进行纵向电生理评估,结果发现自主sEMG对检测腿部运动功能最为敏感[43]。然而,到目前为止中国还没有在脊髓完全性损伤患者的评估中开展这项评估技术。本研究为国内第一次尝试使用这项技术应用于脊髓运动完全性损伤患者的评估,结果显示出高度敏感性,同时通过目视检测指南保证结果的有效性。鉴于上述“discomplete”的临床意义,本研究建议,有条件的医疗机构开展这项技术,使更多临床诊断脊髓完全损伤的患者获益。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1]Rupp R,BieringSrensen F,Burns SP,et al.International standards for neurological classification of spinal cord injury:revised 2019[J].Top Spinal Cord Inj Rehabil,2021,27(2):122.
[2]Sherwood AM,McKay WB,Dimitrijevic' MR.Motor control after spinal cord injury:assessment using surface EMG[J].Muscle Nerve,1996,19(8):966979.
[3]Mckay WB,Sherwood AM,Tang SF.A manual for the neurophysiological assessment of motor control:the Brain Motor Control Assessment(BMCA) protocol.Appendix 1[J].Restorative Neurology of the Injured Spinal Cord,2011,2(1):262283.
[4]McKay WB,Lim HK,Priebe MM,et al.Clinical neurophysiological assessment of residual motor control in postspinal cord injury paralysis[J].Neurorehabil Neural Repair,2004,18(3):144153.
[5]Zoghi M,Galea M.Brain motor control assessment post early intensive hand rehabilitation after spinal cord injury[J].Top Spinal Cord Inj Rehabil,2018,24(2):157166.
[6]Grahn PJ,Lavrov IA,Sayenko DG,et al.Enabling taskspecific volitional motor functions via spinal cord neuromodulation in a human with paraplegia[J].Mayo Clin Proc,2017,92(4):544554.
[7]Simo CR,DE Holanda LJ,Urbini LF,et al.Surface electromyography to identify topdown modulation in complete chronic spinal cord injury[J].Eur J Phys Rehabil Med,2022,58(1):144149.
[8]Anon.Spinal Cord Injury(SCI) facts and figures at a glance[J].J Spinal Cord Med,2016,39(3):370371.
[9]Anderson KD.Targeting recovery:priorities of the spinal cordinjured population[J].J Neurotrauma,2004,21(10):13711383.
[10]Squair JW,Bjerkefors A,Inglis JT,et al.Cortical and vestibular stimulation reveal preserved descending motor pathways in individuals with motorcomplete spinal cord injury[J].J Rehabil Med,2016,48(7):589596.
[11]Bjerkefors A,Squair JW,Chua R,et al.Assessment of abdominal muscle function in individuals with motorcomplete spinal cord injury above T6 in response to transcranial magnetic stimulation[J].J Rehabil Med,2015,47(2):138146.
[12]Williams AMM,Eginyan G,Deegan E,et al.Residual innervation of the pelvic floor muscles in people with motorcomplete spinal cord injury[J].J Neurotrauma,2020,37(21):23202331.
[13]Heald E,Hart R,Kilgore K,et al.Characterization of volitional electromyographic signals in the lower extremity after motor complete spinal cord injury[J].Neurorehabil Neural Repair,2017,31(6):583591.
[14]Calancie B,Molano MR,Broton JG.EMG for assessing the recovery of voluntary movement after acute spinal cord injury in man[J].Clin Neurophysiol,2004,115(8):17481759.
[15]Rossini PM,Barker AT,Berardelli A,et al.Noninvasive electrical and magnetic stimulation of the brain,spinal cord and roots:basic principles and procedures for routine clinical application.Report of an IFCN committee[J].Electroencephalogr Clin Neurophysiol,1994,91(2):7992.
[16]Caramia MD,Cicinelli P,Paradiso C,et al.‘Excitability changes of muscular responses to magnetic brain stimulation in patients with central motor disorders[J].Electroencephalogr Clin Neurophysiol,1991,81(4):243250.
[17]Tranulis C,Guéguen B,PhamScottez A,et al.Motor threshold in transcranial magnetic stimulation:comparison of three estimation methods[J].Neurophysiol Clin,2006,36(1):17.
[18]Kakulas BA.Pathology of spinal injuries[J].Cent Nerv Syst Trauma,1984,1(2):117129.
[19]Kakulas BA.Neuropathology:the foundation for new treatments in spinal cord injury[J].Spinal Cord,2004,42(10):549563.
[20]Christiansen L,Perez MA.Targetedplasticity in the corticospinal tract after human spinal cord injury[J].Neurotherapeutics,2018,15(3):618627.
[21]Kakulas A.The applied neurobiology of human spinal cord injury:a review[J].Paraplegia,1988,26(6):371379.
[22]Dimitrijevic MR,Faganel J,Lehmkuhl D,et al.Motor control in man after partial or complete spinal cord injury[J].Adv Neurol,1983,39:915926.
[23]Calancie B,Molano MR,Broton JG.Abductor hallucis for monitoring lowerlimb recovery after spinal cord injury in man[J].Spinal Cord,2004,42(10):573580.
[24]Sherwood AM,Dimitrijevic MR,McKay WB.Evidence of subclinical brain influence in clinically complete spinal cord injury:discomplete SCI[J].J Neurol Sci,1992,110(12):9098.
[25]Moss CW,Kilgore KL,Peckham PH.A novel command signal for motor neuroprosthetic control[J].Neurorehabil Neural Repair,2011,25(9):847854.
[26]Hubli M,Kramer JLK,Jutzeler CR,et al.Application of electrophysiological measures in spinal cord injury clinical trials:a narrative review[J].Spinal Cord,2019,57(11):909923.
[27]Petersen JA,Spiess M,Curt A,et al.Upper limb recovery in spinal cord injury:involvement of central and peripheral motor pathways[J].Neurorehabil Neural Repair,2017,31(5):432441.
[28]Arora T,Desai N,Kirshblum S,et al.Utility of transcranial magnetic stimulation in the assessment of spinal cord injury:Current status and future directions[J].Front Rehabil Sci,2022,3:1005111.
[29]Petersen JA,Spiess M,Curt A,et al.Spinal cord injury:oneyear evolution of motorevoked potentials and recovery of leg motor function in 255 patients[J].J Neurol Rehabil,2012,26(8):939948.
[30]Petersen JA,Spiess M,Curt A,et al.Upper limb recovery in spinal cord injury:involvement of central and peripheral motor pathways[J].J Neurol Rehabil,2017,31(5):432441.
[31]Petersen JA,Spiess M,Curt A,et al.Spinal cord injury:oneyear evolution of motorevoked potentials and recovery of leg motor function in 255 patients[J].Neurorehabil Neural Repair,2012,26(8):939948.
[32]Faro Viana F,Cotovio G,da Silva DR,et al.Reducing motor evoked potential amplitude variability through normalization[J].Front Psychiatry,2024,15:1279072.
[33]Roy Choudhury K,Boyle L,Burke M,et al.Intra subject variation and correlation of motor potentials evoked by transcranial magnetic stimulation[J].Ir J Med Sci,2011,180(4):873880.
[34]Vallence AM,Rurak BK,Fujiyama H,et al.Covariation of the amplitude and latency of motor evoked potentials elicited by transcranial magnetic stimulation in a resting hand muscle[J].Exp Brain Res,2023,241(3):927936.
[35]Rsler KM,Petrow E,Mathis J,et al.Effect of discharge desynchronization on the size of motor evoked potentials:an analysis[J].Clin Neurophysiol,2002,113(11):16801687.
[36]PotterBaker KA,Janini DP,Frost FS,et al.Reliability of TMS metrics in patients with chronic incomplete spinal cord injury[J].Spinal Cord,2016,54(11):980990.
[37]Goldsworthy MR,Hordacre B,Ridding MC.Minimum number of trials required for withinand betweensession reliability of TMS measures of corticospinal excitability[J].Neuroscience,2016,320(2):205209.
[38]Cuypers K,Thijs H,Meesen RLJ.Optimization of the transcranial magnetic stimulation protocol by defining a reliable estimate for corticospinal excitability[J].PLoS One,2014,9(1):e86380.
[39]BrasilNeto JP,Cohen LG,Panizza M,et al.Optimal focal transcranial magnetic activation of the human motor cortex:effects of coil orientation,shape of the induced current pulse,and stimulus intensity[J].J Clin Neurophysiol,1992,9(1):132136.
[40]Dannhauer M,Huang ZP,Beynel L,et al.TAP:targeting and analysis pipeline for optimization and verification of coil placement in transcranial magnetic stimulation[J].J Neural Eng,2022,19(2):PMC9131512
[41]Sfreddo HJ,Wecht JR,Alsalman OA,et al.Duration and reliability of the silent period in individuals with spinal cord injury[J].Spinal Cord,2021,59(8):885893.
[42]Darrow D,Balser D,Netoff TI,et al.Epidural spinal cord stimulation facilitates immediate restoration of dormant motor and autonomic supraspinal pathways after chronic neurologically complete spinal cord injury[J].J Neurotrauma,2019,36(15):23252336.
[43]Santamaria AJ,Benavides FD,Saraiva PM,et al.Neurophysiological changes in the first year after cell transplantation in subacute complete paraplegia[J].Front Neurol,2021,11(1):514181.