lncRNA SNHG4通过EP300-SNHG4-GPX4轴抑制乳腺癌细胞铁死亡
隋世尧 郑玮 杨子涵 庞达
作者单位:1.哈尔滨医科大学附属肿瘤医院乳腺外科一病区(哈尔滨 150081);2.哈尔滨医科大学附属肿瘤医院门诊手术室
乳腺癌已成为威胁女性健康的头号杀手,其发病率位居女性恶性肿瘤第一位,致死率位居第二位,仅次于肺癌,故乳腺癌的早诊早治迫在眉睫[1]。铁死亡(Ferroptosis)这一概念由Stockwell及其同事于2012年提出,依赖于细胞内活性氧(ROS)水平而与凋亡完全不同,其促进剂能够有效杀伤凋亡抵抗的癌细胞[2]。谷胱甘肽过氧化物酶4(Glutathion peroxidase-4,GPX4)催化铁死亡过程中谷胱甘肽中和ROS反应,已被证实是铁死亡过程中的关键酶并与肿瘤的发生发展密切相关,其抑制剂RSL3已被证实可杀伤乳腺癌细胞并可协同增强顺铂对肺癌细胞的杀伤作用[3,4]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度为200~100 000 nt的非编码RNA分子,其家族成员SNHG4位于第5号染色体上,全长1 100 bp。在肿瘤领域,SNHG4被广泛认为是肿瘤促进因子:在骨肉瘤中,SNHG4与病人肿瘤大小及不良预后均呈正相关,SNHG4通过与miR-224-3p竞争性结合从而增强骨肉瘤细胞的增殖、侵袭以及上皮-间质转化(EMT)能力[5];在宫颈癌中,SNHG4通过募集miR-148a-3p从而降低c-Met表达,最终促进肿瘤凋亡抑制[6];此外,在前列腺癌中,SP1可通过转录激活SNHG4,从而通过竞争性结合机制抑制miR-377表达,最终上调ZIC5表达从而增强癌细胞的增殖与转移[7]。然而,SNHG4是否可影响乳腺癌细胞铁死亡仍需要进一步研究。组蛋白乙酰化是基因表达过程中重要的调控机制之一,乙酰化的组蛋白可吸引其他转录因子(如BRD4)的聚集并启动下游基因表达[8]。E1A结合蛋白P300(E1A binding protein p300,EP300)是已知的组蛋白乙酰基转移酶,可促进组蛋白乙酰化从而调控基因表达。在BRCA阴性乳腺癌中,EP300高表达被认为是肿瘤复发及转移的高危因子[9];机制层面,EP300已被证实可促进乳腺癌细胞的EMT过程从而增强肿瘤转移[10];另外,EP300可通过结合FOXA1增强子促进后者表达从而增强乳腺癌细胞的增殖。但是,目前EP300在乳腺癌中的研究仅局限于增殖与转移,其是否可调控乳腺癌细胞的铁死亡尚无报道。
本文通过系列实验揭示SNHG4在乳腺癌组织中的表达情况及其与生存预后的关系,并探讨SNHG4抑制乳腺癌细胞铁死亡的相关机制。
1 材料与方法
1.1 研究对象
选取2017年1月—2018年12月于我院接受手术治疗的乳腺癌患者共100例,收集肿瘤组织及距肿瘤外缘3~5 cm的癌旁组织。整理患者临床病理资料,包括患者年龄、肿瘤大小、免疫组化类型、淋巴结转移、雌激素受体(Estrogen receptor,ER)及孕激素受体(Progesterone receptor,PR)状态。纳入标准:(1)患者自愿参与本研究并签署知情同意书;(2)术前未经新辅助放、化疗等干预措施;(3)均经外科手术治疗;(4)病理学诊断为浸润性乳腺癌。排除标准:(1)双侧乳腺癌;(2)男性乳腺癌;(3)Ⅳ期乳腺癌;(4)术前已接受新辅助治疗,包括化疗,内分泌治疗或中药治疗。本实验的组织收集已经过哈医大附属肿瘤医院伦理委员会审查(KY2022-23)。
1.2 研究方法
诊断标准:雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子2(HER2)的表达水平采用免疫组化法检测,分子分型参照2020版CSCO乳腺癌指南:(1)三阴性型:ER、PR及HER2均为阴性;(2)HER2阳性型:HER2过表达或扩增,ER、PR均为阴性,Ki67任意比例,或HER2过表达或扩增,ER阳性,PR任何,Ki67任意比例;(3)Luminal型:HER2阴性或者低表达,ER阳性,PR阳性,Ki67任意比例。
1.3 主要试剂
DMEM培养基、RPMI-1640培养基及Opti-MEM培养基购于美国Gibco公司,PBS购于中国Solarbio公司,GPX4兔抗人单克隆抗体、EP300兔抗人单克隆抗体、β-Actin鼠抗人单克隆抗体购于美国Abcam公司,DMSO购于中国Solarbio公司,CCK-8试剂盒购于中国Beyotime公司,干扰RNA片段si-SNHG4,si-EP300及SNHG4过表达质粒由上海吉玛公司完成,引物合成由上海GeneRay公司完成。
1.4 细胞培养
本研究中主要培养了MDA-MB-468与Hs578T共两种人源乳腺癌细胞系。MDA-MB-468和Hs578T细胞用含10%胎牛血清的DMEM培养基在37℃、5%CO2培养箱进行培养,细胞系筛选应用的MDA-MB-231,HCC70及SUM159细胞系用含10%胎牛血清的DMEM培养基在37℃、5%CO2培养箱进行培养,BT549,MDA-MB-435,及HCC1937细胞系用含10%胎牛血清的RPMI-1640培养基在37℃、5%CO2培养箱进行培养。
1.5 细胞转染
细胞消化离心后加入至6孔板,而后补充2 mL细胞培养液/孔,每孔加入250 μL Opti-MEM培养基和Lipofectamine 2000转染试剂7.5 μL充分混匀。再将siRNA混合液或过表达质粒加入至6孔板细胞中,待转染48 h后提取RNA,72 h后提取蛋白用于后续实验检测,实验应用转染序列见表1。

表1 细胞转染siRNA及过表达质粒序列
1.6 细胞增殖实验(CCK-8)
细胞消化后离心,收集转染shRNA 48 h后的细胞,接种96孔板,密度为5 000个/100 μL。实验组别分别为空载体组(NC组),SNHG4敲降组(shSNHG4-1组、shSNHG4-2组),铁死亡抑制剂组(Fer-1组),SNHG4过表达组,SNHG4敲降+铁死亡抑制剂组(shSNHG4-1+Fer-1组、shSNHG4-2+Fer-1组),铁死亡促进剂组(RSL3组),SNHG4敲降+铁死亡促进剂组(shSNHG4-1+RSL3组、shSNHG4-2+RSL3组)以及SNHG4过表达+RSL3组,以上细胞均在敲降SNHG4后加入试剂,37℃,5%二氧化碳培养。每组细胞均设置3个复孔。加入细胞悬液约5 h后细胞基本贴壁,此时加入药物(Fer-1,10 μM,RSL3,1 μM),作用24 h后加入10 μL CCK-8溶液,细胞培养箱内继续孵育1 h,使用酶标仪测定490 nm吸光度。根据所测的吸光度值进行统计分析。
1.7 RT-PCR实验
Real-time RCR反应使用Roche公司的FastStart Universal SYBR Green Master(Rox)试剂盒,总反应体系为10 μL,使用GAPDH作为内参,每个样本均设置3个孔为平行对照(表2)。2-△△Ct法计算作为目的基因相对表达量,△△Ct=(目的基因Ct值-管家基因Ct值)实验组-(目的基因Ct值-管家基因Ct值)对照组。根据此公式计算出目的基因相对对照组的表达量。共设置空载体组(NC)组,SNHG4敲降组(shSNHG4-1、shSNHG4-2组)以及SNHG4过表达组。细胞筛选实验应用MDA-MB-468,MDA-MB-231,HCC1937,SUM159,HCC70,MDA-MB-435,BT549,Hs578T细胞系进行检测。应用SNHG4中位表达值区分高低表达量,高于中位表达值定义为“高表达”,低于中位表达值定义为“低表达”。
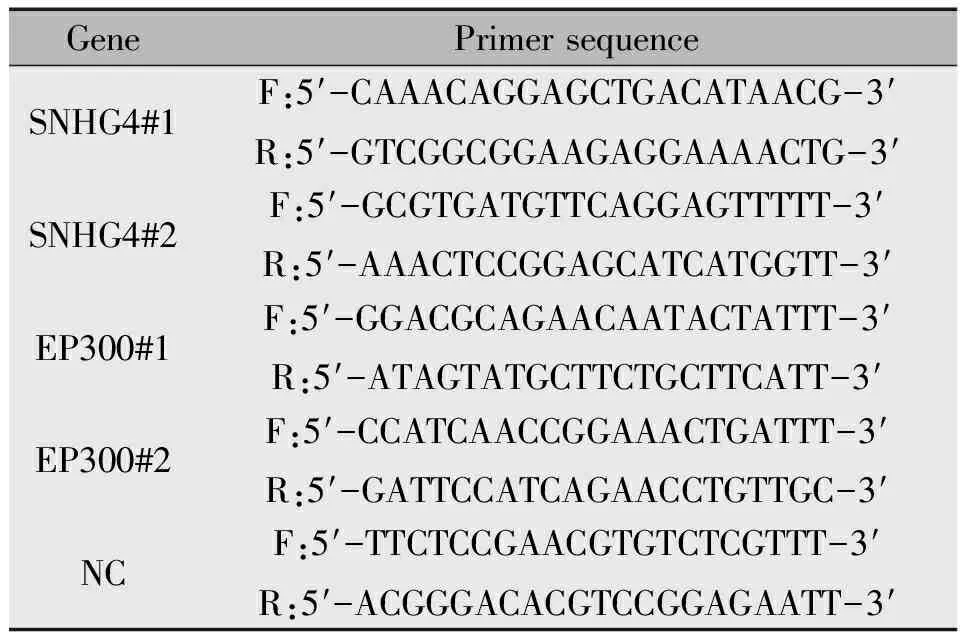
表2 Real-time-PCR引物序列
1.8 Western blot实验
细胞消化离心后进行RIPA裂解液处理提取蛋白,而后进行浓度测定并煮沸变性处理。配制好胶后,将胶板固定于相应电泳槽内,加入蛋白样品,恒压70 V进行电泳,而后经过转膜(300 mA,90 min),封闭1 h,一抗经1∶1 000稀释后进行4℃过夜孵育,以β-Actin为内参。次日PBST洗膜三次,应用荧光二抗室温孵育1 h,再次PBST洗膜3次,应用化学发光超敏显色剂(碧云天公司,碧云天公司)1∶1混合显色。
1.9 铁含量测定实验
细胞消化后离心,弃掉上清后使用ScienCell公司生产的铁含量测定试剂盒(ScienCell,8448)中的缓冲液(Assay Buffer)制备成200 μL的细胞悬液。4℃下13 000 g离心10 min,取上清。准备好稀释样品的溶液(实验缓冲剂:还原剂:样品=93∶2∶5)共1 mL,与等体积的工作液混合,离心5 min,取上清应用酶标仪测量590 nm吸光度。
1.10 丙二醛(MDA)含量测定实验
细胞消化后离心弃掉上清后使用MDA含量测定试剂盒(南京建成公司,A003-1-2)中的5号提取液0.5 mL,混匀2 min,超声破碎细胞制成悬液,取样0.1 mL放置于1.5 mL离心管中,取样0.1 mL放置于1.5 mL离心管中。配制上样液,涡旋混匀,95℃水浴40 min,将液体分别取250 μL加入至96孔板中,使用酶标仪测定530 nm下各个孔的吸光度。
1.11 公共数据分析
SNHG4上游转录因子预测数据来源于JASPAR数据库(http://jaspar.genereg.net/),SNHG4上游组蛋白修饰位点分析来源于ENCODE数据库(www.encodeproject.org/)。
1.12 随访
采用门诊复查和电话等方式了解病人术后情况。随访开始日期为患者初次诊断为浸润性乳腺癌。随访截止日期为2023年2月。研究的终点包括无病生存期(Disease free survival,DFS)和总生存期(Overall survial,OS)。DFS指从病理确诊为乳腺癌到首次观察到复发的时间,OS指从病理确诊为乳腺癌到随访结束或死亡的时间。
1.13 统计分析
实验数据分析采用GraphPad Prism 8.0和SPSS 17.0软件,所有实验均重复三次,计量资料数据以均数±标准差表示。相分析配对资料使用配对t检验,两组间比较采用t检验,三组及以上比较使用方差分析。应用Pearson线性相关分析SNHG4与GPX4,以及EP300与SNHG4的相关性。生存资料的分析使用Kaplan-Meier方法和Log-rank检验,P<0.05为差异具有统计学意义。
2 结果
2.1 SNHG4在乳腺癌中的表达情况及与生存预后的关系
RT-PCR提示SNHG4在肿瘤组织的表达高于癌旁组织(t=9.658,P=0.001)(图1A);SNHG4在侵袭转移能力最强的Basal-Like型乳腺癌中表达高于Luminal型及HER-2型(图1B,P<0.001),故后续实验我们选择Basal-Like型乳腺癌细胞系进行相关实验。随后我们选取ER(+)乳腺癌样本34例,并随机抽取剩余67例ER(-)乳腺癌样本中的34例进行分析,发现SNHG4在预后较差的ER(-)乳腺癌中表达高于ER(+)者(图1C,t=88.47,P<0.001)。SNHG4高表达与乳腺癌病人的OS及DFS短相关(图1D-E,P<0.01),且SNHG4表达与肿瘤大小有关(P<0.001),与肿瘤转移无关(表3)。以上结果说明SNHG4可能作为癌基因促进乳腺癌的发生发展。

图1 乳腺癌患者SNHG4表达与病人生存预后的关系Figure 1 Relationship between SNHG4 expression and prognosis of breast cancer patientsNote:A.The expression of SNHG4 in tumor tissues was higher than that in normal tissues;B.The expression of SNHG4 was higher in Basal-Like breast cancer than that in Luminal and Her-2;C.The expression of SNHG4 in estrogen receptor-negative breast cancer samples was higher than that in estrogen receptor-positive breast cancer samples;D.The overall survival of breast cancer patients with high expression of SNHG4 was lower than those with low expression;E.The disease-free survival of breast cancer patients with high expression of SNHG4 was lower than those with low expression.*** P<0.001.
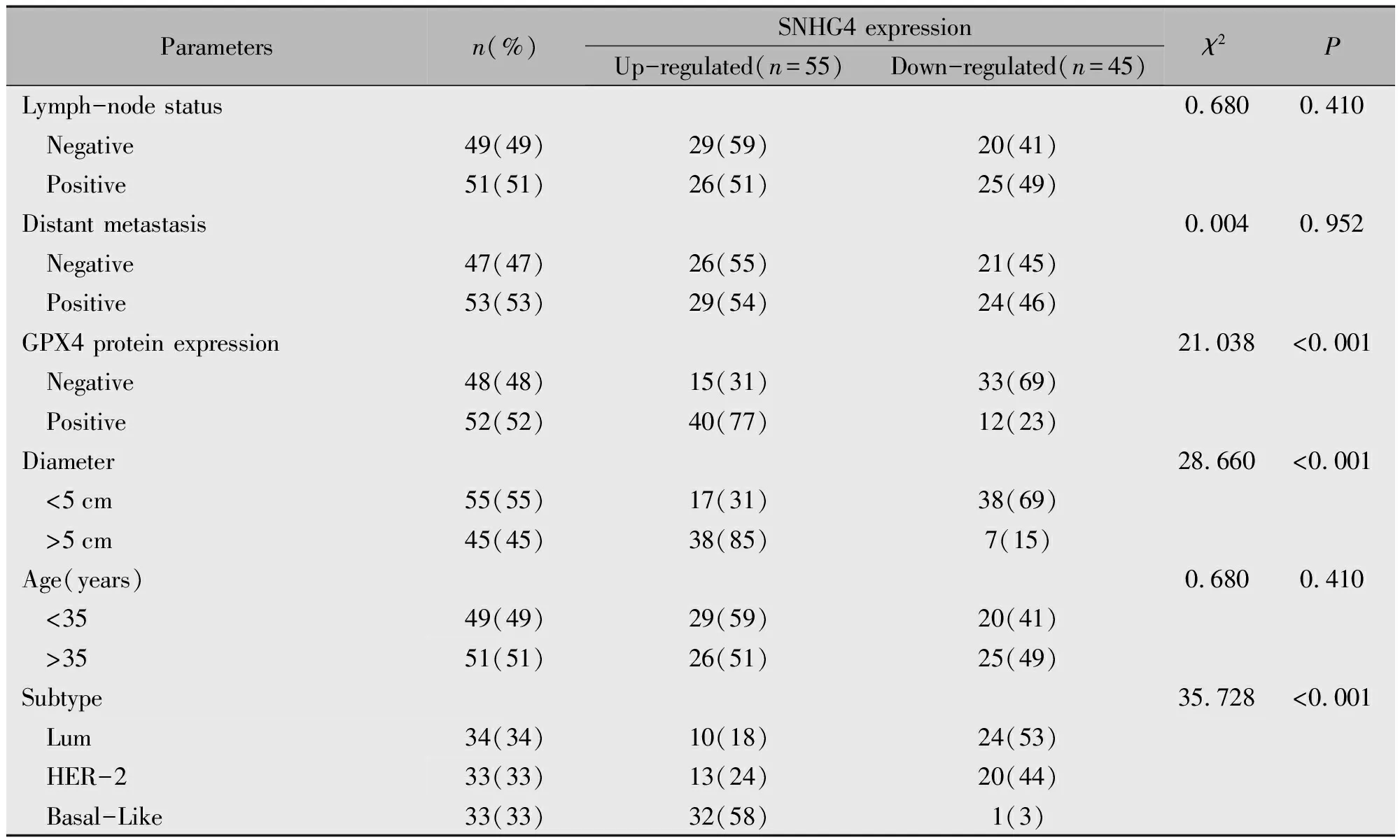
表3 乳腺癌患者SNHG4表达情况与临床病理特征的关系[n(%)]
2.2 SNHG4低表达对乳腺癌细胞铁死亡的诱导作用
细胞筛选实验发现SNHG4在MDA-MB-468细胞系中表达最高(P<0.01),在Hs578T细胞系表达最低(P<0.01),故后续实验应用MDA-MB-468细胞系进行SNHG4敲降实验,应用Hs578T细胞系进行SNHG4过表达实验(图2A,P<0.05)。构建SNHG4敲降/过表达细胞系(见材料与方法1.5)后(图2B-C,P<0.01)我们发现SNHG4低表达可导致细胞活力降低(图2D,P<0.01),过表达SNHG4组细胞活力增强(图2E,P<0.01)。应用铁死亡抑制剂Ferrostatin-1(Fer-1)后我们发现SNHG4低表达介导的细胞活力下降可被Fer-1所逆转(图2D,P<0.01),随后我们对敲降/过表达SNHG4后的细胞内铁含量及ROS水平进行了检测(ROS水平应用脂质过氧化产物MDA水平检测),结果表明敲降SNHG4后细胞内ROS及铁含量均上调(图2F,G,P<0.01),而过表达SNHG4后细胞内ROS及铁含量均下调(图2H,I,P<0.01)。以上研究表明SNHG4与乳腺癌细胞铁死亡负相关。
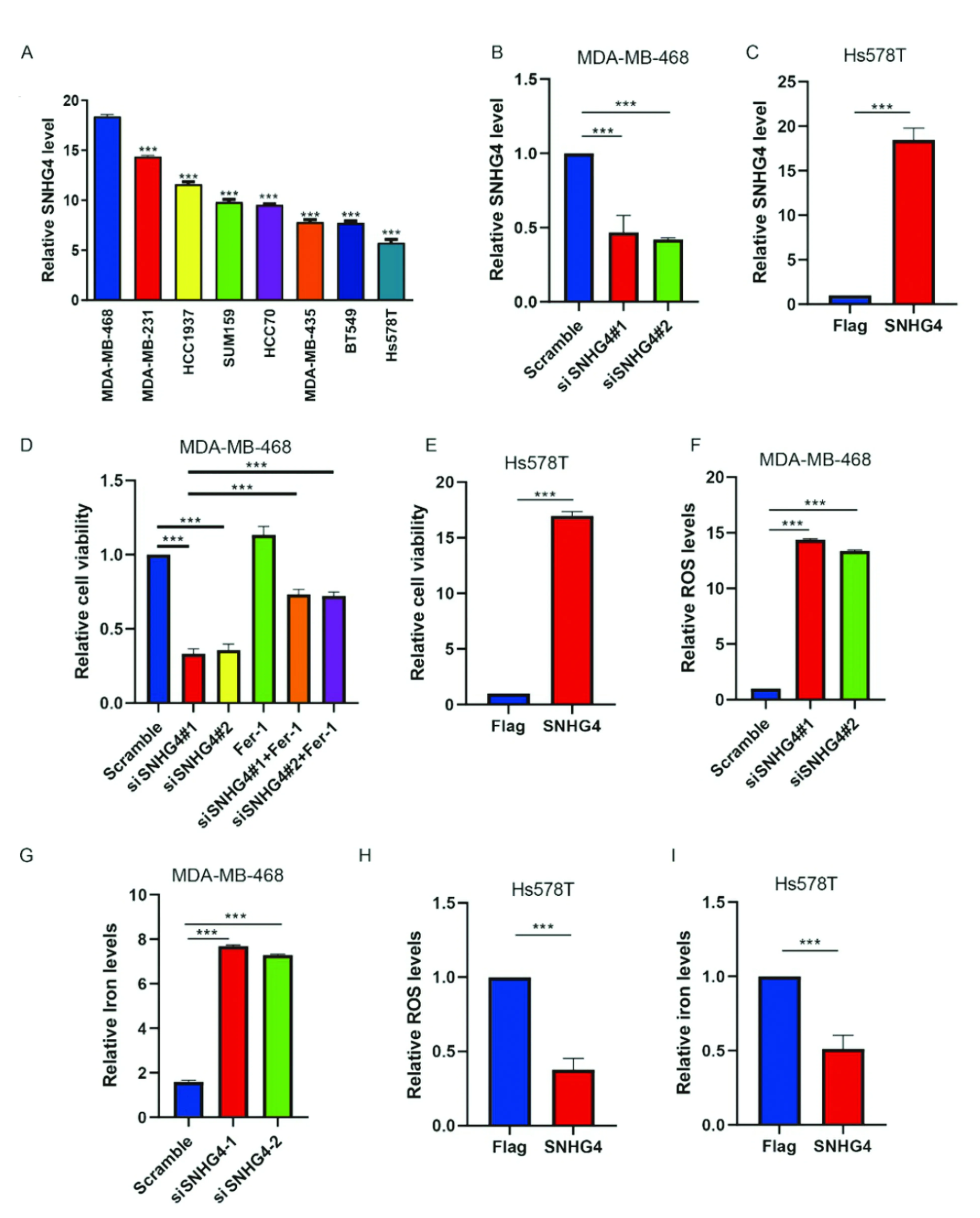
图2 SNHG4对乳腺癌细胞铁死亡的抑制作用Figure 2 SNHG4 showed an inhibited effect of ferroptosis on breast cancerNote:A.The expression of SNHG4 in Basal-Like breast cancer cell lines;B.SNHG4 knockdown plasmid efficiency;C.SNHG4 overexpression plasmid efficiency;D.The decrease of cell viability caused by SNHG4 knockdown could be reversed by Fer-1;E.Overexpression of SNHG4 resulted in enhanced cell viability;F.The levels of intracellular ROS were up-regulated after SNHG4 knockdown;G.The content of intracellular iron was up-regulated after SNHG4 knockdown;H.After overexpression of SNHG4,the levels of intracellular ROS were down-regulated;I.After overexpression of SNHG4,the content of intracellular iron was down-regulated.*** P<0.001.
2.3 SNHG4低表达与铁死亡促进剂的乳腺癌细胞的协同杀伤作用
我们首先检测了SNHG4与GPX4的关系,通过对本单位生物样本库乳腺癌样本(n=100)进行分析发现SNHG4与GPX4表达正相关(图3A,表2,P<0.01),故我们应用RSL3与SNHG4敲降联合处理乳腺癌细胞,研究表明RSL3联合SNHG4敲降可协同杀伤乳腺癌细胞,其效果优于单药作用(图3B,P<0.01)。进一步研究表明,联合用药后细胞内ROS水平及铁含量均得到协同性增强(图3C,D,P<0.01),而过表达SNHG4后RSL3的杀伤作用降低(图3E,P<0.01),ROS及铁含量亦被逆转(图3F,G,P<0.01)。这说明抑制SNHG4联合铁死亡促进剂可作为治疗乳腺癌的手段。
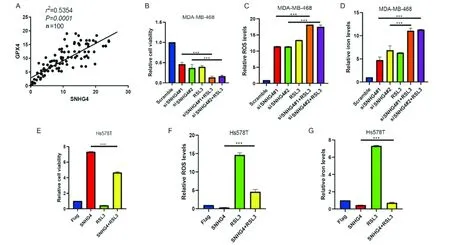
图3 敲降SNHG4联合铁死亡促进剂乳腺癌细胞的协同杀伤作用Figure 3 Synergistic effect of SNHG4-knock-down combined with inducers of ferroptosis on anti-cancerNote:A.SNHG4 was positively correlated with GPX4 expression;B.SNHG4 killed tumor cells synergically with iron death promoter RSL3 after knockdown;C.After knockdown,SNHG4 synergistic with iron death promoter RSL3 up-regulated the levels of intracellular ROS;D.After knockdown,SNHG4 synergized with iron death promoter RSL3 up-regulated the content of intracellular iron;E.Overexpression of SNHG4 could inhibit the antitumor effect of RSL3;F.Overexpression of SNHG4 could reverse the up-regulation effect of RSL3 on the levels of intracellular ROS;G.Overexpression of SNHG4 could reverse the up-regulation effect of RSL3 on the content of intracellular iron.***P<0.001.
2.4 SNHG4抑制乳腺癌细胞铁死亡的作用机制
构建SNHG4敲降的乳腺癌细胞系后对GPX4表达进行了检测,发现SNHG4敲降后GPX4表达下调(图4E,P<0.01),因此SNHG4对铁死亡的抑制作用可能通过调控GPX4表达实现。JASPAR数据库分析得知,组蛋白乙酰化转移酶EP300可能作为转录因子上调SNHG4表达(表4),这一点我们也通过分析ENCODE数据库得到证实(图4A),SNHG4上游确实存在EP300结合位点,且生物样本库分析表明EP300与SNHG4表达正相关(图4B,P<0.01)。随后我们进行RT-PCR实验发现敲降EP300(图4C,P<0.01)后SNHG4表达下调(图4D,P<0.01),蛋白印迹结果表明敲降EP300后GPX4表达下调(图4F,P<0.01)。因此推测EP300作为转录因子上调SNHG4表达,后者通过上调GPX4表达抑制乳腺癌细胞铁死亡。

图4 SNHG4通过EP300-SNHG4-GPX4轴抑制乳腺癌细胞铁死亡Figure 4 SNHG4 inhibited ferroptosis of breast cancer cells through EP300-SNHG4-GPX4 axisNote:A.There are binding sites upstream of SNHG4;B.The expression of SNHG4 was positively correlated with histone acetyltransferase EP300;C.Knockdown efficiency of EP300 plasmid;D.The expression of SNHG4 was down-regulated after EP300 knockdown;E.GPX4 expression was down-regulated after SNHG4 knockdown;F.The expression of GPX4 was down-regulated after EP300 knockdown.***P<0.001,when compared with the Scramble group.

表4 Jaspar数据库预测SNHG4上游调控因子
3 讨论
乳腺癌是全球女性最易罹患的恶性肿瘤,其病程中出现的多器官转移是导致病人死亡的主要原因。乳腺癌的发生发展是诸多因素相互作用、相互制约、相互影响下的极其复杂的病理过程,故乳腺癌的发病机制需从多层面多角度进行解析[12]。虽然在临床工作中可采用手术、化疗、放疗、内分泌治疗以及靶向治疗等多种方法治疗乳腺癌,仍有部分病人因乳腺癌死亡。铁死亡已被证实可杀伤乳腺癌细胞,但其内在机制仍需要进一步研究,包括铁死亡在乳腺癌中的调控靶点以及铁死亡促进剂对乳腺癌细胞的杀伤能力等[13]。LncRNA与肿瘤发生发展的多个阶段具有密切联系,其扮演的角色涉及多个生物学过程及分子信号通路。然而lncRNA在铁死亡中的作用仍需要进一步挖掘。目前研究表明lncRNA GABPB1-AS1通过下调其反义基因GABPB1从而降低过氧化物酶PRDX5的表达,增强肝癌细胞内脂质过氧化并引发铁死亡,靶向GABPB1-AS1可有效杀伤肝癌细胞而对临近正常肝细胞无明显影响[14];此外,胶质瘤细胞可通过上调DLEU1表达抑制肿瘤细胞铁死亡[15]。随着铁死亡相关分子生物学技术的发展,部分研究已发现lncRNA对铁死亡的调控靶点。LncRNA MT1DP可通过竞争性结合miR-365a-3p从而下调抗氧化因子NRF2表达,增强铁死亡促进剂Erastin对肺癌细胞的杀伤能力[16]。另有研究发现lncRNA P53RRA可通过增加p53入核从而促进乳腺癌细胞的铁死亡,p53蛋白的核内定位降低了铁死亡抑制因子SLC7A11表达,故推测P53RRA促进p53的核定位导致GSH合成抑制及铁死亡[17]。此外,在一项对非小细胞肺癌细胞接受小分子抗癌药物XAV939处理后的研究发现,224个lncRNA表达异常,且功能主要集中于通过SLC7A11调控铁死亡过程[18]。可见lncRNA与铁死亡之间有着千丝万缕的联系,应用干扰lncRNA表达诱导乳腺癌细胞铁死亡或可成为未来治疗乳腺癌的新思路。
本研究首先通过系列实验明确了SNHG4在乳腺癌组织高表达,且与病人的生存预后负相关。随后应用细胞学实验对干扰SNHG4表达后乳腺癌细胞的增殖能力以及铁死亡相关指标进行了检测,发现敲降SNHG4导致乳腺癌细胞发生铁死亡,故我们推测应用铁死亡促进剂或可增强敲降SNHG4对乳腺癌细胞的抑制作用,体外实验证明敲降SNHG4联合RSL3可协同杀伤乳腺癌细胞。目前,GPX4作为铁死亡的关键酶已被多篇报道,故本研究对GPX4与SNHG4的关系进行研究,发现敲降SNHG4后GPX4表达下调,这也解释了SNHG4低表达能够与GPX4抑制剂RSL3协同杀伤乳腺癌的现象。随后我们对SNHG4上游进行了探索,发现组蛋白乙酰转移酶EP300可能在转录层面增强SNHG4表达。故未来或可通过组蛋白乙酰化酶抑制剂联合RSL3治疗乳腺癌。
然而,本实验仍然存在着不足之处,首先,铁死亡的发生不仅限于GPX4表达改变,其他铁死亡相关因子,如SLC7A11,ACSL4等需要进一步研究以发现他们与SNHG4的表达相关性;另外SNHG4的作用机制为通过内源性竞争结合miRNA从而促进下游基因表达,故SNHG4是否可通过相同机制促进GPX4表达需要进一步挖掘;最后,由于铁死亡不仅发生在乳腺癌组织,故铁死亡促进剂联合SNHG4干扰治疗的并发症仍需要临床试验探索。综上所述,本实验为未来研究lncRNA与乳腺癌细胞铁死亡提供了新的思路,拓宽了乳腺癌治疗范畴,为乳腺癌的治疗方案优化提供了线索。

