瓦斯灰类高氯锌渣脱氯及联产氯化铵可行性研究*
周立峰 彭 伟 王振杰 蒋正华 周梅花 王金秀
(1.凯里生态环境监测中心;2.贵州省轻工业科学研究所;3.麻江县金泰工业回收有限责任公司)
随着钢铁工业、铅锌等有色金属冶炼工业的迅速发展,产生了大量成分复杂的含锌二次资源,其中包括次氧化锌烟尘、高炉瓦斯灰、锌窑渣等[1-4]。这些废渣中往往含有部分可回收利用的有价金属元素,综合回收此类冶炼锌渣可弥补原生锌资源和伴生金属资源的不足,但此类冶炼锌渣,特别是高炉瓦斯灰废渣普遍存在成分复杂,氟、氯含量高等问题,若不能有效去除氟、氯等杂质成分,对后续电解锌工艺及金属锌产品质量影响较大[5-9]。
目前,常用的脱氯方法主要有焙烧法和碱洗法。焙烧法是通过在多膛炉和回转窑中高温焙烧,使氟、氯以氟化物和氯化物形式挥发脱除,该法应用广泛,脱除效果较好,但是设备投资大、效率低,而且对氯含量高的原料脱出难度较大,效率较低,适用性较差。碱洗法是在碱性环境下,通过复分解反应,使氟、氯以纳盐形式溶解到溶液中,金属元素进入渣相,通过液固分离从而实现氟、氯的脱出,该法投资小,氟、氯脱除效果较好,但用水量大,且废水难处理[10-13]。
以贵州某废渣综合利用公司的瓦斯灰类高氯锌渣为原料,采用水洗—氨化两步法,解决传统湿法炼锌工艺技术处理高氯锌渣时只回收锌而丢弃氯的问题,实现同步联产氯化铵,试验过程中产生的冷凝水,循环用于水洗工序,实现三废零排放[14]。
1 试验原料与试剂
瓦斯灰类高氯锌渣取自贵州某废渣综合利用公司,硫酸、氨水、氯化钙和碳酸氢铵均为分析纯试剂,原料化学成分分析结果见表1。

?
2 试验方法及原理
2.1 试验方法
取100 g不同研磨粒径的原料,放入50 ℃水洗槽中,加入少量的硫酸,水洗2 h 后,固液分离,得到水洗液(为消除砷对后续试验的影响,需在水洗后先加入铁盐进行除砷,得到水浸液);随后向水洗液中通入氨水,调节pH 值,在充分反应一段时间后过滤,得到含氯废液;随后含氯废液中先加入适量的氯化钙溶液过滤,再加入一定量的碳酸氢铵过滤,得到净化后的含氯化铵溶液,经减压蒸馏、冷凝、结晶,得到氯化铵产品。
2.2 试验原理
将合适粒度的高氯冶炼渣在适宜温度下进行水洗,利用铅不溶于水及硫酸,铁、锌、镉和铜在碱性条件下产生氢氧化铁沉淀、锌与碳酸根产生碳酸锌沉淀等特性,使铅、铁和锌等有价金属与氯分离,最后剩余氯化铵,蒸馏冷凝后结晶析出,化学反应方程式如下。
3 试验结果与讨论
3.1 高氯冶炼渣脱氯率试验
水洗是基于原料中的氯化锌和其他氯化物大部分溶于水,而氧化锌不溶于水的特点,用水洗涤使氯离子进入溶液,通过过滤与不溶的氧化锌分离。试验在水浴锅中加热至一定温度,然后缓慢加入一定质量的铜锌烟尘,开始计时。搅拌强度以将烟尘搅拌入溶液无沉淀即可。搅拌到指定时间后,从水浴锅中取出烧杯,过滤料浆,并用一定量的水冲洗。滤渣烘干称重并测定其中的氯质量分数,根据测定结果计算氯浸出率,即脱氯率。
3.1.1 研磨细度对高氯冶炼渣脱氯率的影响
在固液比为1∶10、反应时间1 h、反应温度60 ℃的条件下,进行研磨细度试验,试验结果见图1。

由图1 可见,随着高氯锌渣原料研磨细度的提高,脱氯率呈上升趋势;当研磨细度达0.2 mm 后,脱氯效率处于基本平稳状态,此时,脱氯率为97.63%,说明研磨细度对高氯冶炼渣脱氯率有显著影响,粒度太粗,高氯冶炼渣未能达到有效的单体解离[15];脱氯率之所以不能达到100%,一是水洗后的液固分离,渣中必然含有水分溶解的部分氯离子;二是再生锌物料中含有一定数量不溶于水的氯化物,如PbCl2和PbFCl[16]等;故研磨细度选择0.2 mm。
3.1.2 固液比对高氯冶炼渣脱氯率的影响
在研磨细度0.2 mm、反应时间1 h、反应温度60 ℃的条件下,进行固液比试验,试验结果见图2。

由图2 可见,随着固液比的提高,脱氯率呈先迅速上升,后增幅减缓的趋势,这与孙红燕等[17]使用碳酸钠碱洗脱除高铅氧化锌烟尘中的氟氯时固液比对脱氯率的试验情形一致;当固液比为1∶10时,脱氯率已达97.73%,可有效去除氯离子,故固液比选择1∶10。
3.1.3 反应时间对高氯冶炼渣脱氯率的影响
在研磨细度0.2 mm、固液比1∶10,反应温度60 ℃的条件下,进行反应时间试验,试验结果见图3。
由图3 可见,脱氯率呈先迅速上升,后趋于平稳的状态;当反应时间为80 min 时,已能达到较好的除氯状态,这与王明辉等[18]的水洗锌渣研究最佳反应时间情形基本一致,随着反应时间的增加,增长趋缓,故反应时间选择80 min。

3.1.4 反应温度对高氯冶炼渣脱氯率的影响
在研磨细度0.2 mm、固液比10∶1、反应时间80 min的条件下,进行反应温度试验,试验结果见图4。

由图4 可见,随着反应温度的升高,脱氯率呈先上升后趋于平稳的状态;当反应温度为60 ℃时,已能实现氯离子98.21%以上的去除;故反应温度选择60 ℃。
3.2 氯化铵溶液净化试验
3.2.1 氨水加入量对氯化铵的质量影响
将上述基本脱氯完全的水洗液通入氨水进行试验,pH值对氯化铵结晶含氮量的影响见图5。

通过试验发现,当氨水添加量过低时,水体中的pH值未达到7.5时,无法产生氢氧化铁、氢氧化锌、氢氧化铜和氢氧化镉沉淀;当溶液pH 值达到7.5 时,溶液中出现沉淀。当氨水增加量过高时,pH 值超过8之后,锌融于氨水中形成锌氨络离子,对后续试验产生影响[19-21],反应方程式为
调节溶液pH值为7.5,过滤沉淀后,得含氯废液。此外,由于氢氧化锌沉淀反应不完全,含氯废液中仍有部分锌存在。为进一步纯化含氯废液,消除溶液中剩余的SO42-和Zn2+,加入过量氯化钙,充分形成硫酸钙沉淀,消除SO42-,过滤后,加入一定量的碳酸氢铵,形成碳酸锌沉淀和碳酸钙沉淀,消除Zn2+和之前添加过量的Ca2+。过滤后,得到净化后的氯化铵溶液,最后经减压蒸馏、冷凝、结晶,得到氯化铵产品。
3.2.2 氯化钙添加量试验
当碳酸氢铵与溶液中钙离子和锌离子之和的摩尔比为1.05∶1 时,氯化铵结晶含氮量随氯化钙加入量的变化见图6。
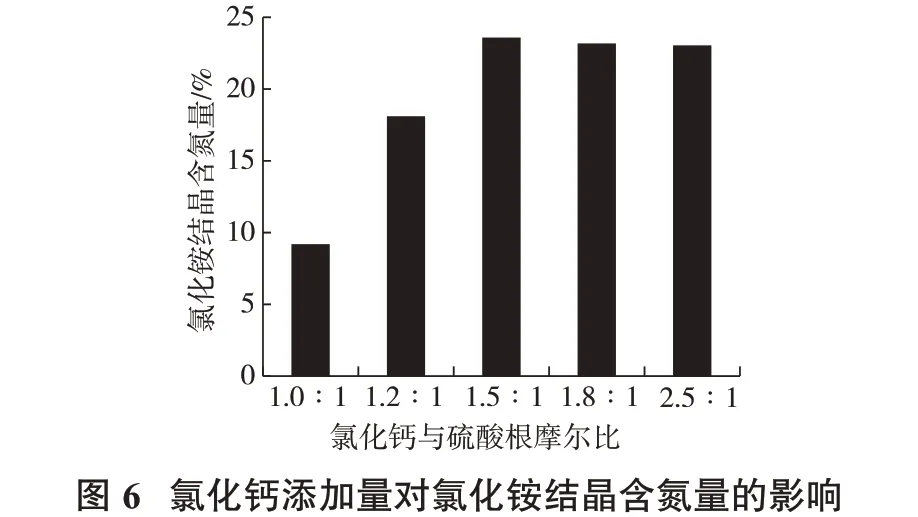
由图6 可见,随着氯化钙添加量的提高,形成了硫酸钙沉淀,消除了溶液中的SO42-,提高了氯化铵结晶的含氮量;当加入氯化钙的量与硫酸根的摩尔比达1.5∶1 时,已趋于稳定;随着加入量的继续增加,整体产品质量增大,导致氯化铵结晶中氮含量降低;因此,氯化钙添加量为与硫酸根的摩尔比达1.5∶1 时为宜。
3.2.3 碳酸氢铵添加量试验
当氯化钙与溶液中硫酸根的摩尔比为1.5∶1 时,氯化铵结晶含氮量随碳酸氢铵加入量的变化见图7。

由图7 可见,随着碳酸氢铵添加量的提高,形成了碳酸锌和碳酸钙沉淀,脱除了溶液中的Zn2+和Ca2+,提高了结晶氯化铵的含氮量;当加入碳酸氢铵的量与钙、锌离子之和的摩尔比达1.05∶1 时,已趋于稳定;随着加入量的继续增加,整体产品质量增大,导致氯化铵结晶含氮量降低;因此,碳酸氢铵添加量为与溶液中钙、锌离子之和的摩尔比达1.05:1 时为宜。
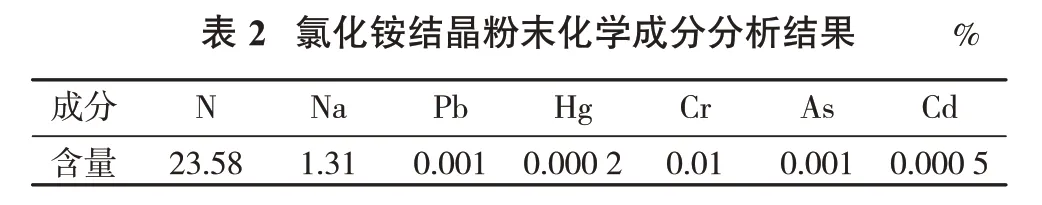
将以上最优试验条件下净化纯化后的氯化铵溶液经减压蒸馏、冷凝、结晶,得到氯化铵粉末。对该氯化铵结晶进行成分分析,分析结果见表2。
?
由表2可知,氮含量23.58%,钠、铅、汞、铬、镉、砷含量均很低,对比《氯化铵》(GB/T 2946—2018)产品质量标准,达到了农业用氯化铵合格品质量标准。
4 结 论
在高氯冶炼渣研磨细度为0.2 mm、固液比1∶10、反应时间80 min、反应温度60 ℃时,高氯锌渣的脱氯率达95%以上。通过加入氨水至溶液pH 值为7.5 时,能生成沉淀,脱除水洗液中的铁、铜和镉。当氯化钙添加量为与硫酸根的摩尔比达1.5∶1 和碳酸氢铵添加量为与溶液中钙、锌离子之和的摩尔比达1.05∶1时,能使含氯废液中的SO42-和Zn2+有效脱除,得到纯化后的氯化铵溶液,经减压蒸馏、冷凝、结晶,得到氯化铵粉末,氯化铵结晶氮含量23.58%,达到了农业用氯化铵合格品质量标准。

