红蓝光诱导下红地球葡萄VvBES1-1基因表达模式分析
党仕卓 周 娟 汤学燊 刘 鑫 张亚红, 袁 苗
(1宁夏大学葡萄酒与园艺学院,宁夏 银川 750021;2宁夏大学林草学院,宁夏 银川 750021)
葡萄(Vitisvinifera)栽培面积广泛,经济效益高,是世界古老的果树,也是宁夏乃至西北地区设施果树的主栽树种。葡萄花芽分化质量是衡量葡萄质量和产量的基础[1],葡萄花芽分化进程复杂,需要外部环境和内部因素的整合[2],而光在此过程起关键作用。光是影响植物形态发生的重要信号,也是形态建成和花芽形成的关键因子[3-4]。研究表明,红蓝光组合能促进花芽分化,提高花蕾质量和数量[5];在葡萄补光试验中红蓝4∶1(R4B1)是促进红地球葡萄花芽分化的最佳补光比例,能显著提高葡萄产量及品质[6-8]。光可通过控制激素平衡来调节植物营养和生殖平衡,植物中光信号介导脱落酸(abscisic acid,ABA)和赤霉素(erythromycin,GA)代谢基因的转录强烈抑制黑暗萌发,却抑制油菜素内酯(brassinolide,BR)途径促进光形态建成,BR、GA与光共同调控细胞伸长和光形态建成[3,9-10]。
BR 是一种促生长类固醇激素,在调节胚轴伸长、光形态建成及花发育等方面发挥重要作用[11-12]。研究表明,BR能促进葡萄[13]、番茄(Solanumlycopersicum)[14]果实成熟并提高其产量;而油菜素唑(brassinazole,Brz)显著延缓果实成熟[13]。BR 的生理作用和信号通路研究主要集中于拟南芥(ArabidopsisthalianaL.)、番茄和豌豆(PisumsativumL.)[15]。BES1是BR信号转导途径重要的转录因子,调控下游BR 生物合成基因并被其他物种证实在调控植物花发育方面发挥重要作用。转录因子CmBES1促进菊花(ChrysanthemummorifoliumRamat.)舌状花花瓣融合发育[16],地钱(Marchantia polymorpha)MpBES1调节细胞分裂和分化[17]。BR 信号和光信号相互作用调控植物生长发育,光敏色素作用因子PIF4 (phytochrome interacting factor 4)与BES1互作调控细胞伸长和植株生长[18]。拟南芥中BR ENHANCED EXPRESSION 1(BEE1)是BES1和隐花色素2(CRY2)介导开花的整合子,BES1-BEE1-FLOWERING LOCUS T(FT)是调控光周期开花的一条新的信号通路[19],表明光信号介导BR 信号途径在调节植物花发育中起重要作用。
花芽分化不良在设施葡萄栽培过程中普遍存在,发光二极管(light emitting diode,LED)补光技术有助于葡萄花芽分化[20-21]。目前关于光调控花芽分化机制研究主要聚焦在表型、生理及组学研究中,但就光介导激素信号尤其是BR 信号调控红地球葡萄花芽分化的分子机制尚不清晰。宁夏大学葡萄酒与园艺学院张亚红课题组(本课题组)前期研究发现,BR在红蓝光组合补光促进红地球葡萄花芽分化中发挥重要作用。鉴于此,本研究分析转录组数据后获得植物器官边界关键转录因子BES1家族基因VvBES1-1,对其进行生物信息学分析及同源克隆;利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析VvBES1-1组织表达与时空表达模式;在烟草中异源表达VvBES1-1明确其生物学功能,以期为后续开展红蓝光调控设施红地球葡萄花芽分化的机理提供依据。
1 材料与方法
1.1 植物材料
本试验以11 年生红地球葡萄为供试材料,种植于宁夏大学试验基地贺兰园艺产业园(38°20′N,106°16′E)15 号阴阳结合型日光温室阴棚。本研究以课题组前期试验筛选获的最佳复合光比例,红光∶蓝光=4∶1(R4B1)处理葡萄,以温室自然光(CK)为对照,处理间以反光膜相隔。共24株葡萄,分2个小区,每小区12 株,每处理设补光灯10 盏,在每组试验行树体上方30 cm 处安置补光灯补光,从葡萄萌芽期开始直至成熟期结束,每天8∶00—22∶00 进行补光,补光的光照强度为200 μmol·m-2·s-1,进行常规肥水管理。
参照刘鑫等[6]对葡萄花芽分化时期的划分进行采样,随机采集新生根、花序、卷须、茎、叶片以及健壮枝条的饱满花芽。样品采集后立即用液氮速冻,保存于-80 ℃冰箱,用于RNA 提取及后续研究。为减少昼夜节律对基因表达差异带来的干扰,将采样时间固定于早上9点。
转基因烟草(本氏烟草NicotianabenthamianaDomin)种植于22 ℃光照培养室(光照16 h/黑暗8 h)培养,相对湿度为75%~80%。
1.2 试验方法
1.2.1 RNA 提取及cDNA 合成 参考总RNA 提取试剂盒(Omega,美国)说明书提取红地球葡萄不同组织,不同时期花芽的总RNA。用Nano Drop 微量紫外检测仪(Thermo Scientific,美国)测定提取的RNA 样品浓度,用0.8%琼脂糖凝胶电泳检测RNA 完整性。并以不同时期花芽RNA 混样为模板,参照HisScriptR ⅢReverse Transcriptase 试剂盒(Vazyme,南京)获得第一链cDNA。反转录后的cDNA保存于-80 ℃冰箱备用。
1.2.2 基因克隆与生物信息学分析 根据前期转录组数据用Primer 8.0 软件对获得基因的基因编码序列(coding sequence,CDS)设计特异性扩增引物VvBES1-1-F/VvBES1-1-R(表1)。以红地球葡萄花芽的cDNA为模板扩增目的片段,PCR 体系共25 μL:cDNA 2 μL,VvBES1-1-F/VvBES1-1-R 各1 μL,Phanta Max Super-Fidelity DNA Polymerase(Vazyme,南京)12.5 μL,ddH2O 8.5 μL。扩增程序:95 ℃预变性2 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1.5 min,29 个循环;72 ℃终延伸10 min。扩增产物经1.0%琼脂糖凝胶电泳检测后用DNA 凝胶回收试剂盒(TIANGEN,北京)回收目的片段。
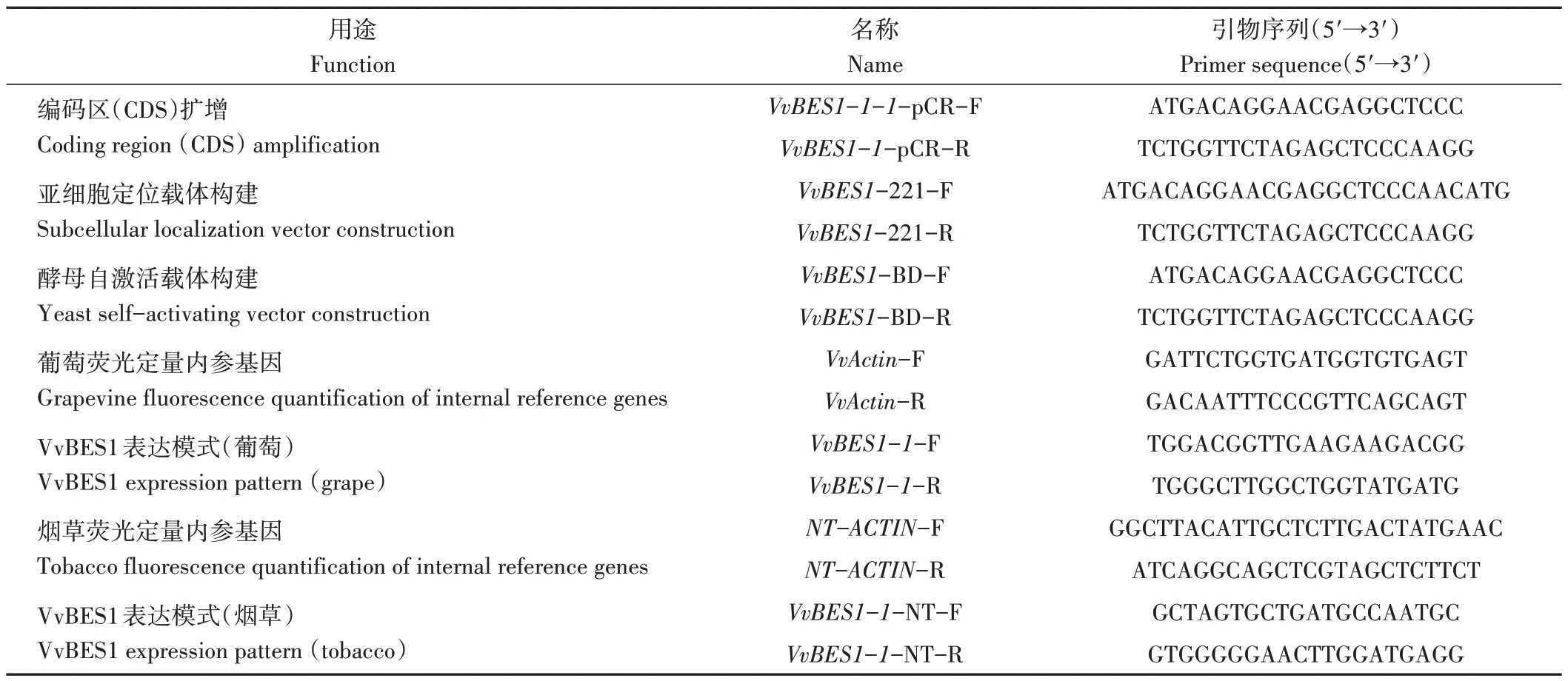
表1 红地球葡萄VvBES1-1克隆、亚细胞定位、自激活及过表达载体构建引物Table 1 VvBES1-1 subcellular localization,autoactivation analysis and overexpression vector construction primers in Red Globe grape
使用ExPASy(https://web.expasy.org/protparam)在线分析VvBES1-1 理化性质;利用ExPASy Prot Scale 分析VvBES1-1蛋白疏水性;亚细胞定位预测用在线分析工具PSORT Ⅱ Prediction(http://www.genscript.com/posort.html)和Plant-PLOC(https://www.csbio.sjtu.edu.cn/bioinf/plant)进行亚细胞定位分析;使用在线工具cNLS Mapper(https://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)、Nuc Pred(https://nucpred.bioinfo.se/cgi-bin/single.cgi)预测VvBES1-1核定位信号(nuclear localization signal sequence,NLS)序列;在NCBI 数据库中下载所需序列,利用MEGA 11 软件的近邻相接法(Neighbor-Joining,NJ) 构建进化树分析 (Boot strap检验重复值设置为1 000);并用DNAMAN 9进行多序列比对。
1.2.3 酵母载体构建和自激活活性检测 采用诱饵载体pGBKT7(BD),去掉目的基因序列的终止密码子后,利用BamHI 和EcoRI 双酶切BD 载体,随后利用同源重组试剂盒将回收的PCR 产物与酶切后的线性载体连接,连接产物转入大肠杆菌[Escherichiacoli(Mig.) Cast.&Chalm.] DH5α 感受态细胞后涂布于加有硫酸卡那霉素(kanamycin,kana)抗性的固体溶菌肉汤(luria-bertani,LB)培养基,37 °C 倒置培养12 h。挑取阳性克隆送生工生工生物工程(上海)股份有限公司测序,将测序正确的诱饵载体质粒含kan 抗性的固体LB 培养基上活化,根据质粒提取试剂盒说明书提取质粒(TIANGEN,北京)。通过PEG/LiAc 法将其转入酿酒酵母(Saccharomycescerevisiae)Y2H Gold 感受态细胞,涂于SD/-Trp 营养缺陷型固体培养基后放入30 ℃恒温培养箱中培养2~3 d。3 d 后挑取单菌落并稀释后点样于含有5-溴-4-氯-3-吲哚基-α-D-吡喃半乳糖苷(Xα-Gal) 和金担子素(aureobasidin A,AbA)的SD/-Trp培养基上,放入30 ℃恒温培养箱中培养3 d,并观察其生长情况。
1.2.4VvBES1-1遗传转化烟草及阳性株系筛选鉴定构建过表达载体(同1.2.3)后电击法转化农杆菌并采用农杆菌介导的叶盘转化法[22]异源转化本氏烟草:将5 周苗龄无菌烟草叶片用手术刀切成小块接种于预培养基,预培养2~3 d 后置于OD600=0.2 的农杆菌悬浮液侵染10~15 min。已侵染的叶片用无菌滤纸吸干残留的菌液,接种于共培养基上暗培养48~72 h。依次转至筛选培养基、生根培养基进行培养,每隔14 d更换一次培养基。空载体遗传转化烟草的步骤同上。
1.2.5 qRT-PCR 分析 将1.2.1 中提取的总RNA 浓度统一调整为0.5 μmol·L-1,每个反转录反应使用1 μmol·L-1RNA。qRT-PCR 参考QuantiNova®SYBR®PCR 试剂盒(QIAGEN,德国)说明书;反应在qTOWER 2.2 (Analytik Jena,德国)上按照说明书进行,数据用2-△△CT法[23]进行数据处理。用SPSS 26 软件对试验数据进行统计分析,并利用单因素方差分析(ANOVA)进行显著性分析。所有试验均设3 次重复,选用VvActin作为内参。
转基因植株光照处理和激素处理所用材料为5 周龄转基因烟草和野生型烟草(光照培养箱中)光照处理分为R4B1、自然光及暗处理(遮光);在0、2、4、6 h共4个时间点采集试验样品;激素处理以5 mmol·L-1BR 处理2 h,DMSO溶剂处理2 h作对照,采集试验样品(同1.1)。利用总RNA提取试剂盒分别提取处理后烟草及野生型烟草总RNA 并反转录,通过qRT-PCR 检测烟草中VvBES1-1的表达量,以烟草Actin作为内参,方法同上。
2 结果与分析
2.1 VvBES1-1基因克隆
参考本课题组前期转录组数据,根据目的基因CDS 序列设计特异性引物(表1),以红地球葡萄花芽反转录的cDNA 为模板扩增,电泳结果显示扩增条带大小与目的基因大小一致(图1)。将目的片段扩增产物回收后送上海生工测序,测序结果比对完全正确,VvBES1-1的CDS序列长度为1 026 bp,分别编码342个氨基酸。
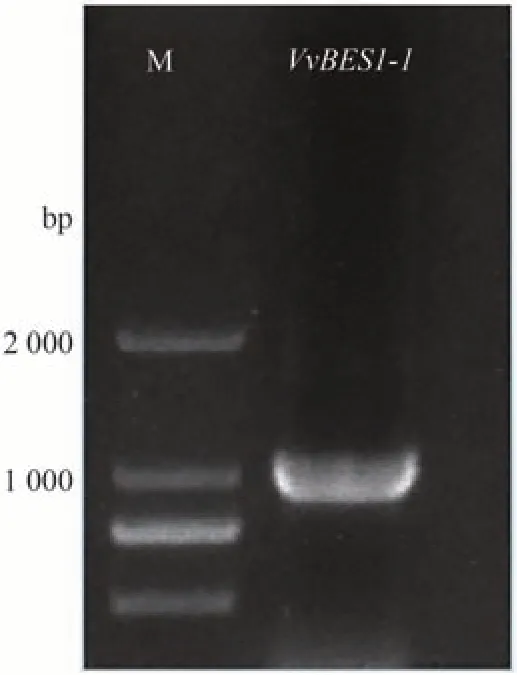
图1 红地球葡萄VvBES1-1基因扩增产物Fig.1 Amplification product of VvBES1-1 gene of Red Globe grape
2.2 VvBES1-1生物信息学分析
采用ExPASy 分析VvBES1-1 蛋白分子量和理论等电点,VvBES1-1 分子量为3.629 628 kDa,理论等电点(pI)为8.53(表2),可见VvBES1-1 蛋白属于碱性氨基酸(pI>7),其次VvBES1-1 平均疏水性为-0.611。综上,该蛋白为碱性亲水性蛋白。

表2 红地球葡萄VvBES1-1蛋白理化性质Table 2 Physicochemical properties of VvBES1-1 protein in Red Globe grape
利用在线SOPMA 程序对VvBES1-1 蛋白二级结构进行预测,结果表明:VvBES1-1 蛋白的二级结构主要包括α 螺旋、延伸链、无规卷曲和β 转角种类型(图2-A),无规则卷曲和α 螺旋是VvBES1-1蛋白多肽链的主要结构元件,比例分别为68.91%、18.48%,其次为延伸链8.21%、β转角4.40%。
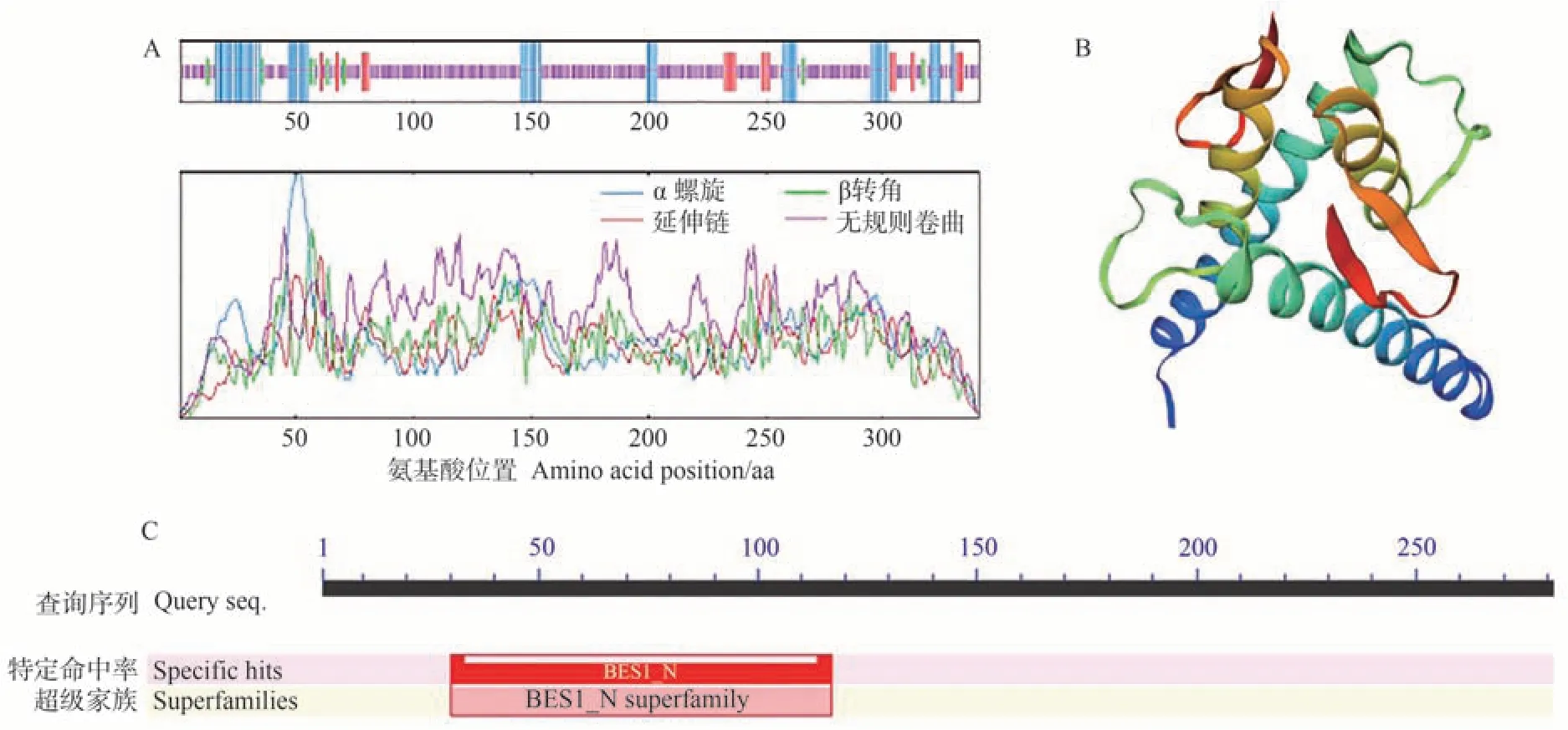
图2 红地球葡萄VvBES1-1蛋白二、三级结构Fig.2 The secondary and tertiary structure of Red Globe grape VvBES1-1 protein
为进一步了解VvBES1-1蛋白的结构,利用SWISSMODEL 对VvBES1-1 蛋白进行三维结构的建模分析,结果如图2-B 所示。VvBES1-1 蛋白的主要结构是无规则卷曲和α螺旋,与二级结构预测的结果一致。
利用MEGA11.0 软件中的邻接法,将红地球葡萄VvBES1-1 序列与其他17 个物种的BES1 蛋白构建系统进化树,Boot strap 值为1 000 (图3)。结果表明,VvBES1-1 与河岸葡萄[XP 034698454.1]氨基酸序列相似度为99.71%,同高粱BES1[XP 002454981.1]蛋白相似性最低,为60.29%。经聚类分析后,发现可聚类为2个分支,第一分支包括开心果[XP 031269808.1]、枣[XP 015875603.1]、茶[XP 028056898.1]等;第二分支包括海枣[XP 008796066.1]、姜[XP 042398453.1]、高粱[XP 002454981.1]等。综上,VvBES1-1与河岸葡萄亲缘关系最近。
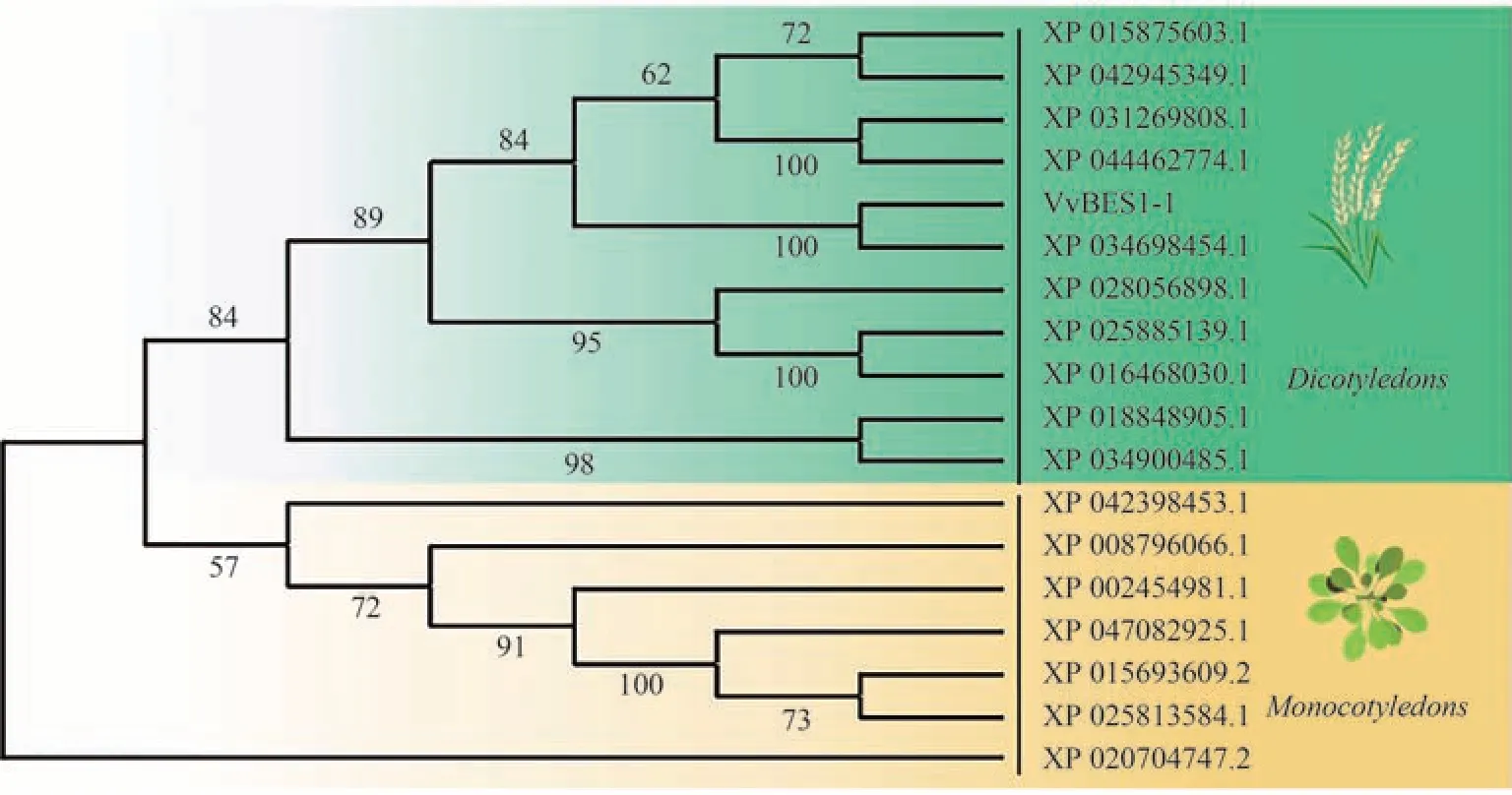
图3 红地球葡萄VvBES1-1与其他植物中BES1蛋白的系统发育树Fig.3 Phylogenetic tree of Red Globe grape VvBES1-1 and BES1 protein in other plants
多重序列比对结果显示,5 种果树的BES1 蛋白序列相似性较高,均包含一个完整的BES1_N 结构域,表明VvBES1-1 是一个典型的BES1_N 型BES1 转录因子。功能域分析表明,VvBES1-1在双子叶植物中均含有BES1_N 功能域,但序列存在不保守情况,表明该基因在不同物种中存在进化差异(图2-C、图4)。

图4 红地球葡萄VvBES1-1与其他植物中BES1蛋白多序列比对结果和NLS序列预测Fig.4 Red Globe grape VvBES1-1 multi-sequence alignment and NLS sequence prediction results of BES1 protein in other plants
通过在线工具cNLS Mapper和Nuc Pred对VvBES1-1的NLS序列预测发现,VvBES1-1在高度保守的BES1_N结构域序列中包含一段预测的NLS(图4),其活性评分为5.7。Nuc Pred 在线工具预测发现该段NLS 活性得分为0.65。
2.3 VvBES1-1转录因子自激活活性分析
以酵母菌菌株Y2H Gold 为试验材料,将VvBES1/BD分别转化至酵母菌体内,并对其进行自激活活性分析。结果表明,含VvBES1-1的菌株能在一缺培养基(SD/-Trp)上正常生长,并且将单克隆菌株在SD/-Trp/AbA培养基上培养时,菌株生长也未受到抑制,能正常生长。在SDO/A/X培养基上阳性对照(PGADT7-T+p53/BD)正常生长并且变蓝,而双阴性对照(PGADT7-T+Lam/BD 和BD 空载体)单克隆菌株均不能正常生长(图5),证明VvBES1-1有自激活活性,表明该转录因子被激活后可能通过识别特异的核苷酸序列启动和调控下游靶基因的表达从而调节红地球葡萄花芽分化进程。
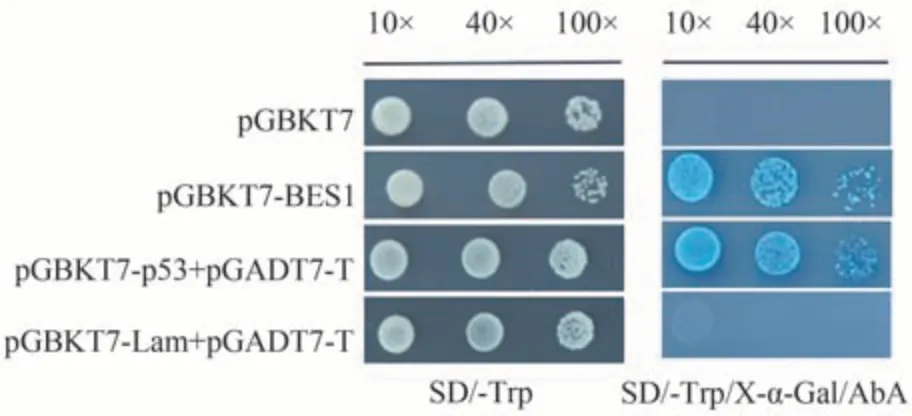
图5 红地球葡萄VvBES1-1自激活活性分析Fig.5 Detection of autoactivation activity of VvBES1-1 receptor binding bait protein in Red Globe grape
2.4 VvBES1-1时空表达分析
如图6 所示,在R4B1 处理下VvBES1-1基因在红地球葡萄花芽分化过程中表达量均低于对照组,图6显示红地球葡萄花芽在6 月15 日处于始分化期,对照组花芽中VvBES1-1基因在6 月15 日前表达量逐渐增加,显著高于R4B1,在此期间表明前期VvBES1-1基因表达量降低促进花芽分化进程。6月30日—7月15日,葡萄花芽始原基开始分化并决定能否形成花原基,在该阶段VvBES1-1基因表达水显著低于对照。观察整个分化时期内对照组VvBES1-1基因的表达趋势,发现VvBES1-1在6 月15 日的表达量最高,进一步说明VvBES1-1可能在花芽分化中起作用。7月15日—8月30 日花芽分化阶段处于花序主轴发育和花序二级轴发育,R4B1 处理下VvBES1-1基因的表达水平显著低于对照组,并且维持在一个低表达水平状态,表明VvBES1-1表达量低有利于花芽后期分化。VvBES1-1基因在R4B1 处理下较对照组均显著下调表达,推测红蓝光下VvBES1-1基因在红蓝光介导红地球葡萄的花芽分化的过程中表达量下调。
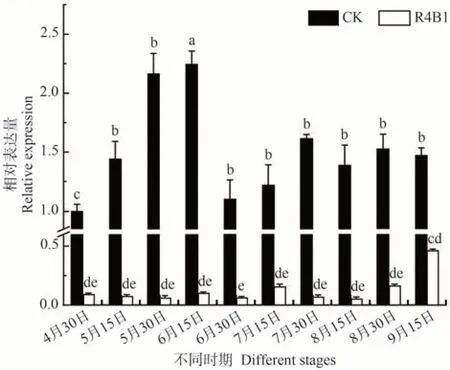
图6 R4B1下红地球葡萄VvBES1-1基因时空表达模式Fig.6 Spatiotemporal expression pattern of VvBES1-1 gene in Red Globe grape under light of R4B1
2.5 VvBES1-1组织特异性表达分析
为明确R4B1处理下VvBES1-1在红地球葡萄不同组织器官中的表达情况,选取红地球葡萄的根、茎、叶、花芽、花及卷须进行组织特异性表达分析。结果表明,VvBES1-1在各组织器官中均有表达(图7)。在温室自然光中VvBES1-1在叶片和花芽中的表达量较高,其中温室自然光叶片中的表达量是R4B1处理叶片中的6倍,而根中的表达量最低;R4B1 处理下,VvBES1-1在茎和花芽中的表达量最高,花中的表达量最低。VvBES1-1基因在叶片和花芽中的表达量显著下降,而R4B1 处理下BRs上调表达同成花率正相关,这说明R4B1处理下BR信号通路中VvBES1-1表达量下降。
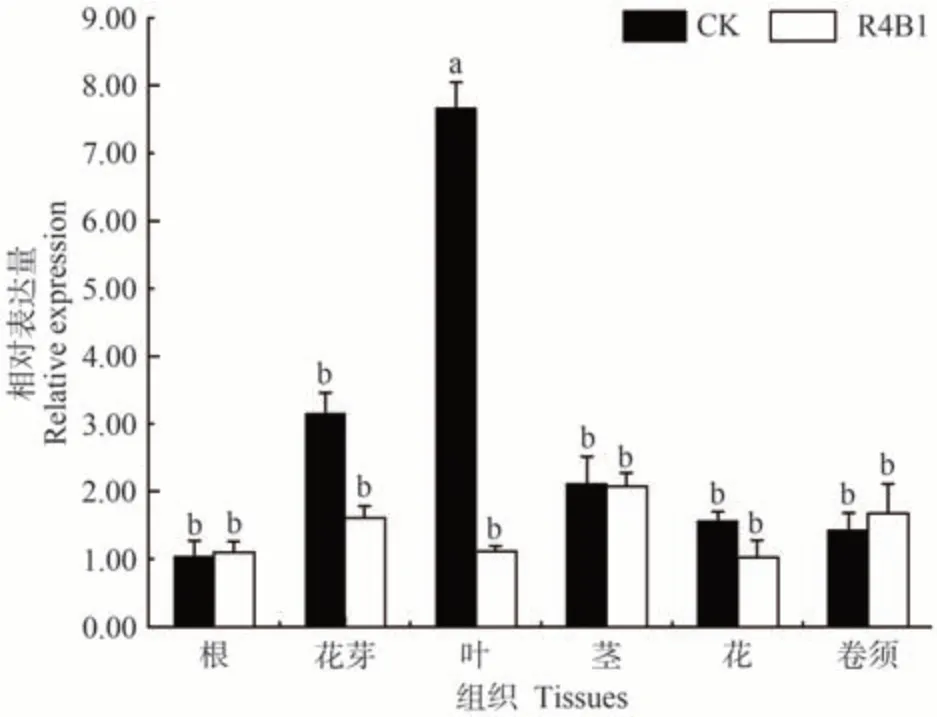
图7 R4B1下VvBES1-1基因在红地球葡萄不同组织中的表达水平Fig.7 The expression level of VvBES1-1 gene in different tissues of Red Globe grapeunder light of R4B1
2.6 转烟草阳性鉴定及表型分析
在本氏烟草中构建过表达载体并利用农杆菌通过叶盘法进行遗传转化,采用十六烷基三甲基溴化铵法(hexadecyltrimethyl ammonium bromide,CTAB)法提取转基因烟草基因组DNA后进行阳性植株鉴定,鉴定结果显示,转化的阳性植株能够扩增出与VvBES1-1大小一致的条带,野生型烟草中则未鉴定出目的条带(图8-A),由此可以确定目的基因成功整合到烟草基因组中。对T3代表型观察发现,过表达VvBES1-1烟草相比野生型开花时间较晚且叶片数增加,节间缩短(图8-B、C),这表明VvBES1-1过表达可能推迟烟草开花时间。根据阳性鉴定结果,随机选择其中2株开展后续功能研究验证。

图8 转VvBES1-1烟草阳性鉴定及表型Fig.8 Positive identification and phenotyping of trans- VvBES1-1 tobacco
2.7 光参与调控BR信号通路
为进一步明确光是否参与调控BR 信号通路,研究了不同光处理下外源激素喷施前后VvBES1-1基因的表达水平。研究结果显示,不同光处理下VvBES1-1在转基因和野生型烟草中均有表达,由图9-A可看出,自然光下烟草中VvBES1-1基因表达量最高,显著高于其他材料,约为暗处理下烟草中的20 倍,R4B1 处理下转基因烟草中VvBES1-1的表达量比野生型多,约为野生型烟草中基因表达量的3 倍。暗处理下转基因烟草和野生型烟草中VvBES1-1基因表达量较少,同其他两处理相比未发生较大变化。图9-B显示在激素信号处理后,随着浓度的变化,VvBES1-1的表达量发生明显变化。在5 mmol·L-1处理后,红蓝光下转基因烟草中VvBES1-1的表达量显著上升,日光下野生型烟草处理组的表达水平趋势同转基因烟草中的一致均高于对照组。由此表明,光参与BR 信号通路,VvBES1-1基因可能在光调控转基因烟草生长发育过程中下调表达。
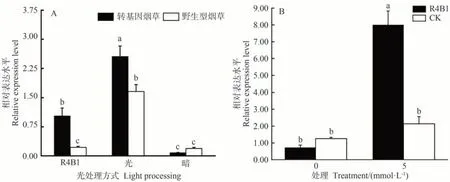
图9 不同光处理下外源激素喷施前后VvBES1-1基因的表达水平Fig.9 The expression level of VVBES1-1 gene before and after exogenous hormone spraying under different light processing
2.8 VvBES1-1基因表达依赖光
前人在拟南芥中的研究表明,BES1蛋白积累模式依赖于光[9],为验证葡萄中光是否能够诱导VvBES1-1基因表达,本研究通过qRT-PCR 进行分析。结果显示,与暗处理相比,R4B1 和自然光显著诱导了VvBES1-1基因的表达,且在自然光下VvBES1-1的表达量更高(图10)。自然光下,VvBES1-1基因表达水平呈现先降低后升高的趋势。转基因烟草在不同光处理2 h 时,VvBES1-1表达量均低于0.5 达到最低,表达水平呈现自然光>R4B1>暗处理的模式;但在不同光处理4 h时,R4B1下转基因烟草中VvBES1-1的表达量有所升高,并高于自然光处理;在处理6 h 后又恢复之前的表达模式。由此表明,暗处理下,VvBES1-1基因表达量较低且相对稳定,而在光和R4B1 诱导下VvBES1-1基因表达量整体显著升高,表达水平呈现先减后增的模式;并且R4B1处理4 h后VvBES1-1的表达量显著高于自然光,但在其他时间段刚好相反,这表明葡萄花芽中光诱导VvBES1-1基因表达。
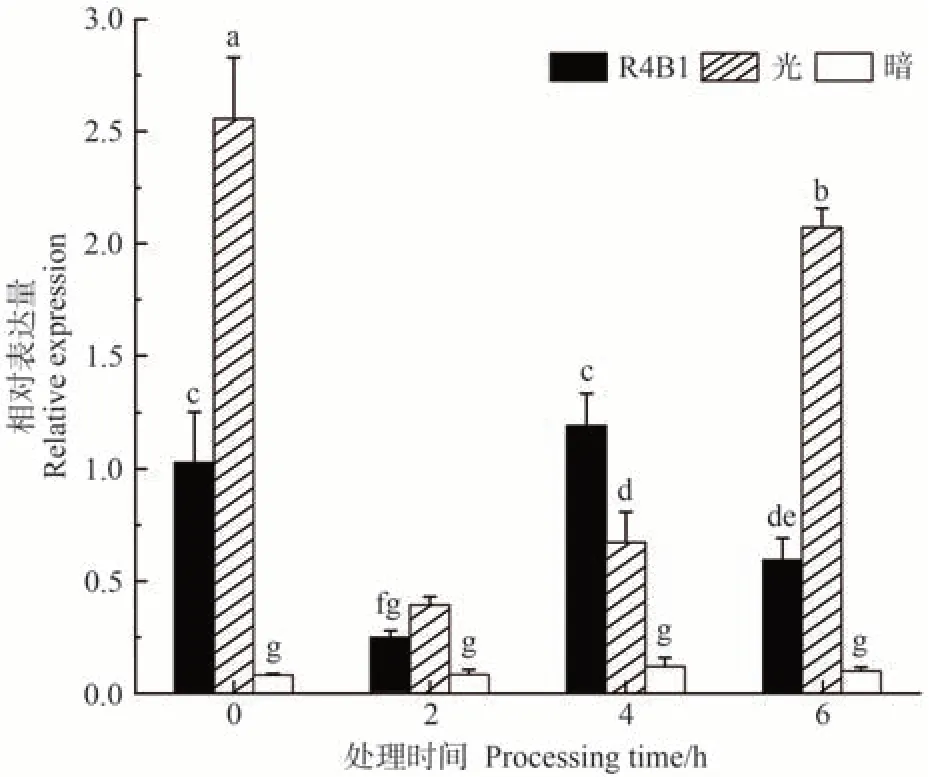
图10 R4B1、自然光、黑暗处理不同时间后转基因烟草中VvBES1-1基因的表达水平Fig.10 The expression level of VvBES1-1 gene in transgenic tobacco after R4B1,natural light and dark treatment for different time
3 讨论
花芽形成同光质具有相关性,光可以通过信号传导和调节激素水平来调节植物生长。BR被誉为“第六激素”,BR 信号的关键成分调控多种植物生长发育过程和胁迫响应[24-27]。对豌豆、拟南芥、黄瓜和水稻中内源BR 水平的研究发现,BR 在光形态建成中发挥积极作用[28-29]。BES1 及其家族成员经研究发现在调控花器官边界形成具有重要作用[16,19,24],但BR 信号的这些关键成分参与光调控葡萄花芽分化的分子机制还不清楚。本研究从红地球葡萄中克隆获得BES1 转录因子VvBES1-1,该基因CDS 全长为1 026 bp,编码342 个氨基酸。
近年来对BR 信号的研究不断深入,BR 信号的关键因子在其他植物中也得到了一定的研究。辣椒(CapsicumannuumL.)CaBES1[30]和荔枝(LitchichinensisSonn.)LcBES1[31]等都含有BES1_N结构域。本研究结果显示VvBES1-1 也含有家族保守的BES1_N 结构域,是典型的BES1 家族蛋白,BES1_N 是该基因行使功能的主要基序。VvBES1-1与拟南芥中BES1家族基因结构类似,暗示VvBES1-1基因功能可能跟拟南芥中的相似,上述研究结果同前人一致。拟南芥中对于BES1定位于细胞核还是细胞质存在争议,Jiang 等[32]提出BES1蛋白在BES1-S形式(含BES1_N结构域且在该结构域中存在NLS)之外还有一种新的形式BES1_L,并阐明此种形式在N 端多出一段肽段,多出的肽段具有NLS功能,它不仅能促进自身的细胞核定位,还能促进BES1-S 和BZR1 的细胞核定位。本研究结果显示,VvBES1-1 在高度保守的BES1_N 结构域存在的情况下,存在一段NLS 促使VvBES1-1 蛋白定位于细胞核中。亚细胞定位预测该蛋白定位于细胞核的可能性较大,表明该基因可能在细胞核中调控BR 信号通路下游基因,但其在细胞中的具体位置需进一步试验证明。葡萄为果树,系统进化分析结果显示VvBES1-1 和河岸葡萄在同一分支,同芒果、开心果、碧根果、枣等果树的亲缘关系较近,表明该基因在进化过程中保守性较高。
同源基因间因物种不同而表现出不同的组织表达差异,此种差异可能与生理功能、区域化分布及物种特异性相关[33]。LcBES1在检测的各荔枝组织和器官中均有表达,各组织中的表达量存在差异[31];GhBES1基因家族成员表达量具有组织特异性[34];苦荞FtBES1在各器官中也具有组织特异性[35]。本研究中,VvBES1-1基因在葡萄不同组织中均有表达,并呈现明显的组织表达特异性,与前人研究结果类似。Zhang等[4]发现光照条件下,拟南芥核因子C 亚基蛋白(NUCLEAR FACTOR-Y Subunit C,NF-YC)直接负调控BR 合成基因BR6ox2的表达,抑制BR 途径调控下胚轴伸长。本研究结果显示,在R4B1 处理下VvBES1-1基因下调表达,受光信号调控显著,与上述前人研究结果一致,说明在补光后葡萄中的VvBES1-1的表达可能受到抑制。
植物对光能的吸收是光合作用及生长发育的基础,光和BR 拮抗调控植物发育从黑暗条件下暗形态建成向光照条件下光形态建成的转换,许多参与光信号和BR 信号的突变体具有相似表型,表明光和BR 之间联系密切[4]。外源喷施BR 结果显示,VvBES1-1响应BR 信号;暗处理下转基因烟草及野生型烟草VvBES1-1表达量较稳定,R4B1 及自然光下VvBES1-1表达量极显著,表明VvBES1-1响应光信号。拟南芥中,BR 信号负调控光信号介导的植物下胚轴抑制作用[4,23]。本研究中对转基因株系表型分析发现VvBES1-1过表达植株具有花期延迟、节间缩短、植株矮化等特征,同时对转基因烟草进行不同时间补光处理后发现,VvBES1-1基因在R4B1 处理下较对照组表达量显著下降,推测BR 信号途径中VvBES1-1基因可能在光信号介导转基因烟草生长发育过程中下调表达。综上,VvBES1-1在光信号介导的红地球葡萄花芽分化过程中可能发挥重要作用,本研究为深入分析BES1蛋白在红地球葡萄花芽分化过程中的调控功能提供理论依据,并为VvBES1-1基因参与光介导BR 信号调控红地球葡萄花芽分化机理的研究提供参考。
4 结论
本研究从红地球葡萄中克隆获得VvBES1-1基因,经生物信息学分析可知,VvBES1-1 可能为BES1-S 型蛋白,同河岸葡萄聚为一类。该转录因子具有转录激活活性和组织特异性,时空表达模式显示VvBES1-1在花序二级轴发育期表达量达到最高,R4B1抑制该基因表达。在烟草中的异源转基因试验表明,VvBES1-1响应BR 信号,VvBES1-1在光介导BR 信号调控花芽分化的过程中呈倒“V”形表达,转基因植株具花期延迟、节间缩短等表型特征。综上所述,VvBES1-1参与光介导BR信号调控红地球葡萄花芽分化,但其表达量不是决定花芽分化与否的主要因素,后续还需检测开花基因的表达量,并对其互作机制进行深入研究。

