间作刺槐对魔芋根际细菌群落结构及软腐病发生的影响
何 斐 刘 欢 李 川 崔 鸣 魏梦琳 丁龙飞 刘 斌 段 杉
(安康学院现代农业与生物科技学院,陕西 安康 725000)
魔芋(Amorphophalluskonjac)软腐病是由胡萝卜软腐果胶杆菌胡萝卜亚种(Pectobacteriumcarotovorumsubsp.carotovorum)[1]、环状果胶杆菌(Pectobacterium aroidearum)[2]、迪基氏菌属(Dickeyaspp.)[3]等病原菌侵染引起的土传和种传病害,危害极其严重,防治困难,至今未找到一种有效的防治方法。前人研究表明,作物土传病害的发生与根际微生物相关,且一些有益微生物可以有效降低土传病害的发病率[4]。Dong等[5]研究证实,芽孢杆菌(Bacillus)能降低槟榔芋(Colocasia esculenta)软腐病的发病率;Dong 等[6]研究发现,黄粘球菌(Myxococcusxanthus)作为潜在的生防制剂,可以通过捕食和分泌胞外裂解酶来有效防治番茄(Lycopersicon esculentum)细菌性青枯病;假单胞菌属(Pseudomonasspp.)中的许多菌株可以有效缓解病原细菌和病原真菌引起的土传病害[7-8]。众多研究表明,作物抵抗土传病害的能力与其根际细菌群落的丰度和多样性密切相关[9]。
间作是一种能有效抑制作物土传病害的生态农业种植制度。目前,间作控病机理特别是作物根际微生物层面的研究逐渐得到重视。间作能增加土壤生物多样性以及有益微生物种类和数量,从而减轻土传病害[10]。Jin 等[11]利用小麦(Triticumaestivum)与黄瓜(Cucumis sativus)间作,发现小麦间作促进了黄瓜根际潜在有益微生物的生长,进而降低了黄瓜枯萎病的严重程度。Yu 等[12]研究表明,与西瓜(Citrullusvulgaris)单作相比,间作小麦的西瓜根际细菌群落更稳定,其枯萎病发病指数更低。然而,根际微生物影响病原菌和间作作物的方式极其复杂,且不同间作搭配组合的抗病效果有所差异。因此有必要对特定作物间作模式下的根际微生态特征进行深入研究。从微观角度了解间作作物病害地下部机理有助于对特定作物间作控病的具体措施进行宏观调控,为优化栽培管理措施及构建可持续发展的间作技术体系提供理论依据和技术支撑。
关于魔芋软腐病与土壤微生物多样性之间关系的研究已有相关报道。如何斐等[13]研究表明,魔芋软腐病发病率和病情指数与魔芋根系和根际土壤丛枝菌根真菌总侵染率、侵染强度和孢子密度呈极显著负相关;Yang 等[1]研究发现,胡萝卜软腐果胶杆菌胡萝卜亚种侵染导致魔芋根际土壤细菌和真菌群落发生明显改变。但有关魔芋软腐病防治与土壤微生物多样性之间关系的研究较少,特别是间作刺槐(Robiniapseudoacacia)对魔芋根际微生物多样性影响的研究尚少见报道。长期生产实践证明,间作刺槐能有效防控魔芋软腐病的发生[14],然而其微生态机理尚有待研究。基于此,本研究借助Illumina 高通量测序技术分析刺槐‖魔芋种间互作对魔芋根际细菌群落结构的影响及其与软腐病发病率之间的关系,旨在为通过间作套种等农艺措施改善土壤微生态环境及土传病害防控提供理论支撑,也为深入理解特定作物间作套种模式下的根际微生态特征提供依据。
1 材料与方法
1.1 试验设计与实施
试验于2021年5月3日在安康学院农学大棚进行。刺槐和魔芋根系分隔采用两室根箱隔网装置(图1)设置3个处理:(1)塑料膜全隔单作(film complete separation,F)作为对照;(2)25 μm 尼龙网隔半间作(mesh semiseparation,M),水分和养分可穿过,但根系不能通过;(3)无隔间作(non-separation,N)。每处理重复3次。
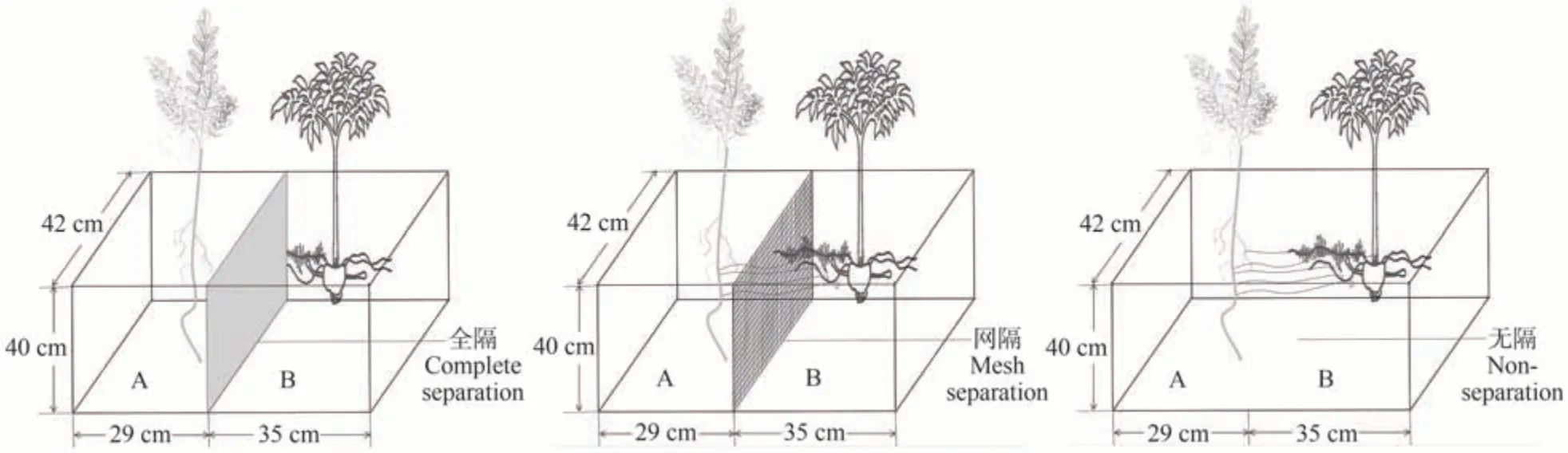
图1 刺槐(A)和魔芋(B)不同根系分隔处理模式图Fig.1 Schematic diagram of R.pseudoacacia (A) and A.konjac (B) plants under different root separation treatments
以种植1 年魔芋的连作土壤(第一茬魔芋软腐病平均发病率为3.7%)作为供试土壤,其类型为黄棕壤,基本理化性质:pH 值7.07,全氮1.46 g·kg-1,全磷0.87 g·kg-1,全钾20.05 g·kg-1,速效氮27.9 mg·kg-1,速效磷70.2 mg·kg-1,速效钾108.4 mg·kg-1,有机质14.69 g·kg-1。土壤去杂后添加有机肥50 g·kg-1,育苗基质20 g·kg-1,充分混匀用作栽培基质。
挑选饱满的刺槐种子用10% H2O2消毒15 min,蒸馏水冲洗6 次、无菌水浸泡18 h,置于铺有湿润纱布的托盘上,25 ℃光照培养箱中催芽,每天光照10 h、换1 次水。当刺槐种子胚根生长至约0.1 cm 时播种在A室根箱中,刺槐出苗后生长至3 cm 时,各处理保留长势一致的5株幼苗。
挑选质量为20 g、顶芽健康露白的魔芋球茎作为供试种芋,播种前用20%噻菌铜悬浮剂均匀喷雾消毒和晾晒。在A 室刺槐生长30 d 后,将消毒晾晒处理后的魔芋播种至B 室中,各处理播种3 株。播种后将根箱置于透光率为50%的遮阳网下,植株生长期内2 d浇1次水,浇至土壤相对含水量为75%。
于2021 年9 月10 日球茎膨大期采集各处理的魔芋根系,同时采用抖根法[15]收集魔芋根际土壤。每个处理各采集3 个根系(root,R)样品和3 个根际土壤(soil,S)样品,将采集的根系样品用大量无菌水反复冲洗处理干净后放入液氮速冻,再转存于-80 ℃超低温冰箱,用于分析细菌多样性。土壤样品剔除沙石等杂物后,部分土样转入无菌冻存管中,储存于-80 ℃冰箱,用于16S rDNA 测序分析土壤细菌多样性及实时荧光定量PCR分析氮循环关键功能基因拷贝数;剩余土样自然风干后过0.25 或1 mm筛,用于测定土壤理化性质。
1.2 测定项目与方法
1.2.1 土壤理化性质的测定 土壤理化性质测定参考《土壤农化分析》[16],采用凯氏定氮法测定土壤全氮(total nitrogen,TN)含量;通过碱解扩散法测定土壤碱解氮(alkali-hydrolyzable nitrogen,AN)含量;采用氢氧化钠熔融-钼锑抗比色法测定土壤全磷(total phosphorus,TP)含量;采用碳酸氢钠-钼锑抗分光光度法测定土壤速效磷(available phosphorus,AP)含量;采用氢氧化钠熔融-火焰光度法测定土壤全钾(total potassium,TK)含量;采用醋酸铵-原子吸收火焰分光光度计法测定土壤速效钾(available potassium,AK)含量;采用重铬酸钾氧化-外加热法测定土壤有机碳(soil organic carbon,TOC)含量;采用电位法(水土比2.5∶1)测定土壤pH值。
1.2.2 魔芋软腐病病害调查 于魔芋播种后50(出苗期)、75(发病高峰期)和200 d(球茎膨大期)分别调查统计魔芋软腐病害严重程度。发病程度分4个等级:0级,健康无发病症状;1级,<25%植株出现软腐病症;2级,25%~75%植株出现软腐症状;3级,>75%植株受侵染。根据费甫华等[17]的方法计算魔芋软腐病病情指数(disease index,DI)和防治效果(control efficiency,CE):
1.2.3 DNA 提取和PCR 扩增测序 按照FastDNA®Spin Kit for Soil 试剂盒(美国MPbio 公司)说明书步骤分别提取魔芋根系和根际土壤总DNA,用1%琼脂糖凝胶电泳检测DNA 完整性,使用NanoDrop 2000 核酸定量仪(美国赛默飞世尔科技公司)检测DNA 浓度和纯度。以细菌V3~V4 区的16S rDNA 序列进行PCR 扩增,引物序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[18]。
使用TransGen AP221-02试剂盒(北京全式金公司)进行PCR 扩增。反应体系为20 μL:5×FastPfu缓冲液4 μL,2.5 mmol·L-1三磷酸脱氧核苷酸2 μL,5 μmol·L-1上下游引物各0.8 μL,FastPfu聚合酶0.4 μL,1%牛血清白蛋白溶液(大连TaKaRa 公司)0.2 μL,DNA 模板10 ng,补ddH2O 至20 μL。PCR 程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,28次循环;72 ℃终延伸10 min。
使用1%琼脂糖凝胶电泳检测PCR 产物,按照AxyPrepDNA 凝胶回收试剂盒(美国Axygen 公司)说明书进行PCR 产物纯化,用QuantiFluorTM-ST(美国Promega 公司)进行定量。通过Illumina NovaSeq 6000 PE250 平台进行测序,由上海派森诺生物科技股份有限公司提供技术支持。
1.2.4 氮循环关键功能基因实时荧光定量PCR 分析 采用实时荧光定量PCR(quantitative real time polymerase chain reaction,qRT-PCR)检测固氮过程(nifH)、氨氧化过程(氨氧化古菌AOAamoA和氨氧化细菌AOBamoA)、反硝化过程(narG、nirS、nirK和nosZ)的7 个功能基因拷贝数。qRT-PCR 反应在Light Cycler®480 thermocycler(美国Axygen公司)平台进行,定量引物序列及反应条件见表1。反应体系为20 μL:SYBR®Premix Ex Taq(大连TaKaRa 公司)10 μL,10 μmol·L-1正反向引物各1 μL,10 ng·μL-1土壤DNA 1 μL,1%牛血清白蛋白溶液(大连TaKaRa 公司)0.2 μL,ddH2O 6.8 μL。

表1 氮循环关键功能基因qRT-PCR引物及反应条件Table 1 qRT-PCR primers and reaction conditions for key functional genes related to nitrogen cycling
用插入目的片段且拷贝数已知的质粒DNA,经过10 倍系列稀释,构建标准曲线,每个标准品重复3 次。质粒的制作:采用表1 中相应的引物对氮循环关键功能基因进行PCR 扩增,用胶回收试剂盒(大连TaKaRa公司)进行目的基因回收纯化。纯化的目的基因连接到pMD18-T 质粒载体上,导入感受态细胞中。经蓝白斑筛选,挑出阳性克隆转接LB 液体培养基37 ℃、160 r·min-1摇床振荡培养18 h,部分菌液送至上海生工测序部进行测序验证。扩大培养阳性克隆菌落,用TIANprep Mini Plasmid Kit 质粒小提试剂盒(天根生化科技(北京)有限公司)提取质粒DNA。用Nanodrop 2000C 分光光度计(美国赛默飞世尔科技公司)测定质粒浓度。基于测出的质粒浓度,调整PCR 体系中模板的加入量。采用LightCycler®480荧光定量PCR仪(美国Axygen公司)进行扩增,以循环数阈值(cycle threshold,Ct)为横坐标,以标样拷贝数的对数值[log10(拷贝数)]为纵坐标,绘制标准曲线。
通过将土壤氮循环关键功能基因Ct 值与标准曲线比较,用获得的拷贝数,参照文献[25]的公式计算每克干土中的功能基因拷贝数。
1.3 数据分析
采用QIIME 2 分析流程[26]进行质控、拼接和降噪处理,聚类为扩增子序列变体(amplicon sequence variants,ASVs),比对Silva 138/16s_bacterial 数据库,设置阈值为0.7,按最小样本序列抽平。生信分析在上海派森诺基因云平台(https://www.genescloud.cn/)中进行,原始数据上传至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)旗下的序列阅读档案(Sequence Read Archive,SRA)数据库(登录号:PRJNA906959,各样本序列登录号SAMN31943274~SAMN31943291)。
使用Mothur 软件[27]进行细菌群落α 多样性分析,利用基于Bray-Curtis 距离的主坐标分析(principal coordinates analysis,PCoA)分析不同处理细菌β 多样性,结合Adonis 分析进行处理间差异检验;使用Canoco 5 软件进行细菌群落与土壤因子之间的冗余分析(redundancy analysis,RDA)。运用微科盟生科云平台(https://www.bioincloud.tech/)进行细菌群落Circos图的制作。在chiplot 在线网站(https://www.chiplot.online/)进行Pearson 相关性分析和绘图。使用SPSS 22.0 软件对不同处理间氮循环关键功能基因拷贝数进行单因素方差分析,以Duncan 多重比较法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 魔芋根系和根际土壤细菌多样性指数
2.1.1 α 多样性指数 由表2 可知,无隔处理的魔芋根系和土壤细菌Observed species 和Chao 1 指数均最大,细菌物种最丰富,与全隔处理相比差异达到显著水平。不同分隔处理魔芋根系细菌多样性水平也存在一定的差异,无隔处理的魔芋根系细菌群落多样性水平最高,其Shannon 指数显著高于网隔和全隔处理。而魔芋根系和土壤细菌群落的Simpson 指数在不同分隔处理之间无显著差异。

表2 不同分隔处理下魔芋根系和根际土壤细菌α多样性指数Table 2 Alpha diversity indices of bacterial communities in A.konjac roots and rhizosphere soils under different separation treatments
2.1.2 β 多样性指数 为明确各处理在细菌群落物种组成上的差异性,采用PCoA 比较不同分隔处理魔芋根系和根际土壤细菌群落的β多样性差异。结果表明(图2),主成分PCo1 和PCo2 分别解释了41.2%和8.2%的群落结构差异,两者累计贡献率达49.4%。无隔和网隔2种土壤样品间的细菌群落存在重合,说明2种土壤样品中的细菌物种组成差异较小;结合Adonis分析表明,无隔、网隔和全隔魔芋根际土壤样品中细菌群落的β 多样性差异显著(P=0.006,R2=0.313),3 个处理的魔芋根系细菌群落β 多样性差异亦显著(P=0.005,R2=0.393)。

图2 基于Bray-Curtis距离的魔芋根系和根际土壤细菌群落β多样性主坐标分析(PCoA)Fig.2 Principal coordinates analysis (PCoA) of bacterial community beta diversity in roots and rhizosphere soils of A.konjac based on Bray-Curtis similarities
2.2 魔芋根系和根际土壤细菌群落结构组成
18 个样本按最小样本序列数抽平1 次,每个样本得到34 675 条有效序列。ASV 稀疏曲线均趋于平缓(图3-A),表明本研究中测序深度已基本覆盖了样品中所有物种,序列信息可以充分反映细菌群落的真实信息。不同处理魔芋根际细菌群落测序结果表明,无隔处理魔芋根系和根际土壤细菌的ASV 总数最大,分别为4 649 和7 346 个;全隔处理最少,分别为3 296 和6 713个(图3-B)。
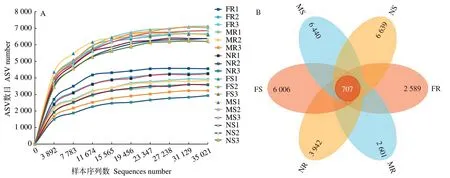
图3 不同分隔处理下魔芋根系和根际土壤细菌群落稀疏曲线(A)和韦恩图(B)Fig.3 Rarefaction curve (A) and Venn diagram (B) of bacterial communities in roots and rhizosphere soils of A.konjac under different separation treatments
2.2.1 门水平 由图4-A可知,不同分隔处理细菌门水平的群落结构组成相似,但细菌门相对丰度存在差异。6 个样品中,相对丰度≥1.0%的已知优势细菌包括9 门,而相对丰度<1.0% 的其他细菌门占比在0.67%~2.98%之间。
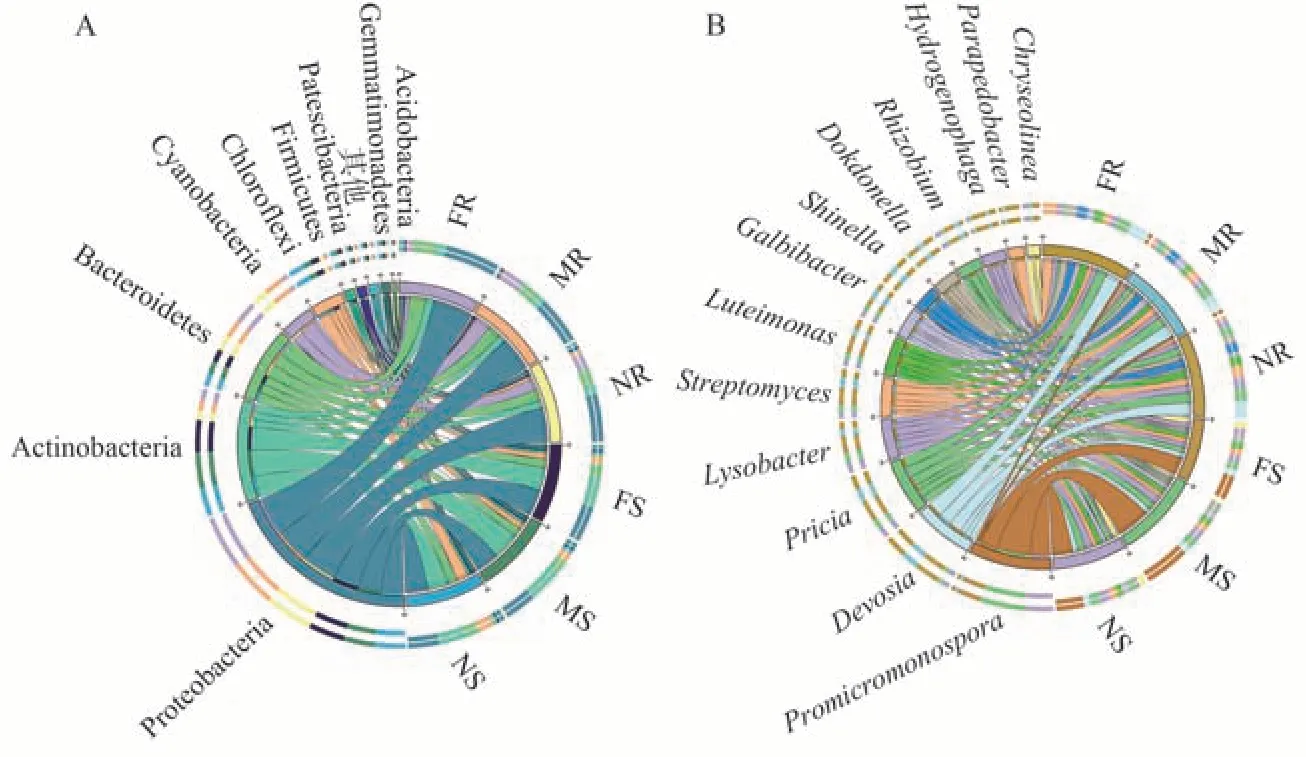
图4 不同分隔处理下魔芋根系和根际土壤细菌门水平(A)和属水平(B)的群落组成Fig.4 Bacterial community composition in roots and rhizosphere soils of A.konjac at the phylum (A) and genus (B) levels under different separation treatments
在魔芋根系中,放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)在全隔、网隔、无隔处理中所占比例均表现为依次降低的趋势,分别为11.46%、10.32%、10.05%和21.79%、17.03%、16.14%;而绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)在全隔、网隔和无隔处理中所占比例依次增加,分别为1.79%、2.21%、4.56%和0.36%、0.37%、1.07%。
在魔芋根际土壤中,变形菌门(Proteobacteria)和蓝藻门(Cyanobacteria)在全隔、网隔、无隔处理中所占比例均依次降低,分别为35.40%、31.16%、30.35%和0.25%、0.09%、0.06%;厚壁菌门(Firmicutes)也表现出相同趋势,在3 个处理中所占比例依次减少,分别为4.01%、3.93%和3.75%。
2.2.2 属水平 不同分隔处理细菌属水平群落组成见图4-B。在相对丰度≥1.0%的优势细菌属中,相较于全隔处理,网隔和无隔条件下魔芋根系中细菌属相对丰度均上升的有链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)、溶杆菌属(Lysobacter)和Chryseolinea属;根际土壤中细菌属相对丰度均上升的有原小单孢菌属(Promicromonospora)、戴沃斯菌属(Devosia)、极地所菌属(Pricia)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)、Galbibacter属、申氏杆菌属(Shinella)和溶杆菌属(Lysobacter)。此外,藤黄单胞菌属(Luteimonas)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)、溶杆菌属(Lysobacter)和Chryseolinea属相对丰度在无隔处理魔芋根系和根际土壤中最高,而独岛菌属(Dokdonella)、噬氢菌属(Hydrogenophaga)和类土地杆菌属(Parapedobacter)相对丰度在全隔处理魔芋根系和根际土壤中最高。
2.3 细菌属组成与土壤因子的关系
为了分析不同分隔处理下魔芋根系和根际土壤细菌群落属组成产生差异的关键土壤因子,对细菌群落属组成与土壤理化性质进行RDA 分析。结果显示(图5),RDA1 和RDA2 累计解释魔芋根际细菌群落99.05%的变异量,其中AN 对魔芋根际细菌群落影响显著(P<0.05),解释其群落结构变异的67.43%。其他土壤因子对其无显著影响。从图5 也可看出,原小单孢菌属(Promicromonospora)和Galbibacter属相对丰度均与TN、TK、AN 和TOC 含量呈正相关;溶杆菌属(Lysobacter)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)和极地所菌属(Pricia)相对丰度与TP、AK、AP 和TOC 含量呈正相关,极地所菌属(Pricia)、藤黄单胞菌属(Luteimonas)、Chryseolinea属、噬氢菌属(Hydrogenophaga)和类土地杆菌属(Parapedobacter)相对丰度与土壤pH值呈正相关;噬氢菌属(Hydrogenophaga)和类土地杆菌属(Parapedobacter)相对丰度与除pH 值之外的其他土壤理化性质指标均呈负相关关系。其他如戴沃斯菌属(Devosia)、申氏杆菌属(Shinella)和独岛菌属(Dokdonella)细菌相对丰度也与土壤理化性质指标表现出一定的相关关系。
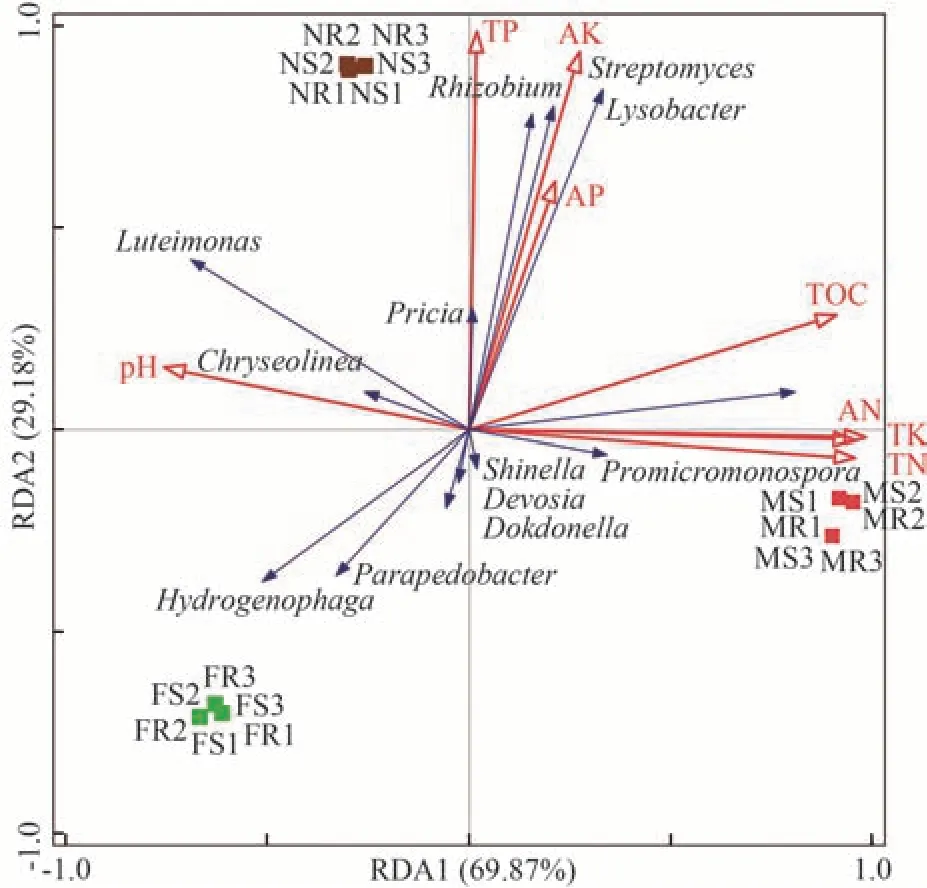
图5 魔芋根系和根际土壤细菌群落属组成与土壤因子的冗余分析(RDA)Fig.5 Redundancy analysis (RDA) of bacterial community composition at the genus level in roots and rhizosphere soils of A.konjac in relation to soil factors
2.4 魔芋根际土壤氮循环关键功能基因的表达丰度
通过qRT-PCR 对固氮微生物中编码氮循环关键酶的7 个基因(nifH、AOAamoA、AOBamoA、narG、nirK、nirS和nosZ)丰度进行绝对定量分析。结果显示(图6),网隔和无隔处理的nifH基因拷贝数分别较全隔处理显著增加82.36%和19.73%(图6-A)。反硝化微生物nosZ和nirS基因拷贝数变幅分别为8.52×107~12.16×107和2.39×107~3.62×107copies·g-1,均呈现出无隔>网隔>全隔的变化趋势,且全隔和网隔处理间无显著差异,但无隔处理的nosZ和nirS基因拷贝数分别较全隔处理显著增加42.79%和51.54%(图6-B 和6-C)。反硝化微生物nirK基因拷贝数变幅为9.21×108~13.96×108copies·g-1,呈现出全隔>无隔>网隔的变化趋势,但全隔和无隔处理间无显著差异(图6-D);narG基因拷贝数在全隔、网隔和无隔处理间无显著差异(图6-E)。在全隔处理中,硝化微生物AOBamoA基因拷贝数分别较网隔和无隔处理显著增加59.16%和56.41%(图6-F); AOAamoA基因拷贝数呈现出无隔>全隔>网隔的变化趋势(图6-G)。
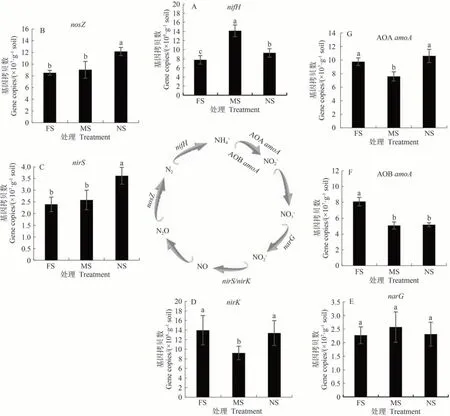
图6 不同分隔处理下魔芋根际土壤中氮循环关键功能基因qRT-PCR绝对定量分析Fig.6 Absolute quantification of nitrogen cycling-related key functional genes in rhizosphere soils of A.konjac under different separation treatments by qRT-PCR
2.5 魔芋软腐病发病情况
魔芋播种50 d 时,魔芋‖刺槐无隔和网隔处理条件下,魔芋未发病,而全隔魔芋已开始出现发病症状。魔芋播种75 和200 d 时,全隔魔芋软腐病病情指数分别是网隔处理的2.4 和2.0 倍,而无隔魔芋仍未发病(表3)。上述结果说明根系互作和物质传递在刺槐‖魔芋间作系统中发挥着推迟和控制发病程度的作用。
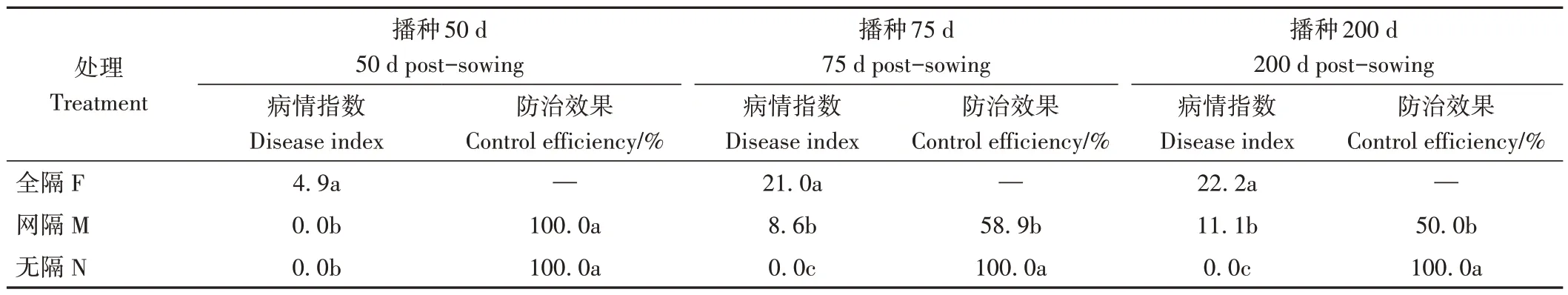
表3 不同分隔处理下魔芋软腐病发病情况及防治效果Table 3 The disease index and control efficiency of A.konjac soft rot under different separation treatments
2.6 根际细菌群落与魔芋软腐病的相关性
以图4-B 中13 个相对丰度≥1%的优势属为例,通过相关性图可视化展示样本中魔芋根际细菌多样性、属丰度以及氮循环关键功能基因拷贝数与软腐病发病程度之间的关系。由图7 可知,播种50 d 的魔芋软腐病病情指数与溶杆菌属(Lysobacter)细菌相对丰度呈显著负相关(P<0.05),与AOBamoA基因拷贝数呈极显著正相关(P<0.000 1)。播种75 和200 d 的魔芋软腐病病情指数与溶杆菌属(Lysobacter)和链霉菌属(Streptomyces)相对丰度以及nirS基因和nosZ基因拷贝数呈显著负相关,但与AOBamoA基因拷贝数呈显著正相关(P<0.05)。与不同调查时间段魔芋软腐病病情指数和其他因子的相关性趋势相比,防治效果与其他因子的相关性均表现出相反的趋势。

图7 细菌群落多样性、属丰度及氮循环关键功能基因拷贝数与魔芋软腐病发生的Pearson相关性分析Fig.7 Pearson correlation analysis between bacterial community diversity,genus abundance,copy numbers of nitrogen cyclingrelated functional genes,and the development of A.konjac soft rot
3 讨论
3.1 不同根系分隔方式对魔芋根际细菌多样性和群落组成的影响
本研究利用高通量测序技术分析与刺槐不同根系分隔方式下的魔芋根际细菌多样性。结果表明,与刺槐间作增加了魔芋根际细菌种类并丰富了其群落多样性。一方面,与全隔相比,无隔处理改变作物覆被,使根系分布更为复杂,导致根际细菌与作物根系分泌物互作更频繁[11-12],从而改变了根际细菌代谢活性,促使间作魔芋根际细菌群落多样性与单作产生差异。另一方面,豆科刺槐的固氮体系可以增加土壤氮素含量[28],这也可能是影响魔芋根际细菌群落多样性的原因。
在属水平上,戴沃斯菌属、极地所菌属、藤黄单胞菌属、链霉菌属、溶杆菌属5 类菌属丰度值较大,在不同分隔处理样品中的相对丰度≥1.0%;但未分类菌属相对丰度最高,达68.25%~77.38%(图4-B),说明各样品中仍存在大量未知细菌有待进一步鉴定并探索其功能。无隔处理下魔芋根系和根际土壤链霉菌属分布比例高于全隔处理。前人研究表明,有些链霉菌通过产生抗生素和水解酶类物质抑制魔芋土传病原菌的生长[29]。根瘤菌可在非豆科植物中以内生菌形式普遍存在[30],其中健康魔芋根表土壤和根内存在的放射型根瘤菌(Rhizobiumradiobacter)具有促生增产和抗魔芋软腐病能力[31]。本研究同样发现,与刺槐间作的魔芋根系和根际土壤中根瘤菌为较具优势的一类种群,相对丰度分别达2.94%和1.68%;溶杆菌属细菌在与刺槐间作的魔芋根际大量存在。研究表明,溶杆菌属细菌对多种植物病原真菌、卵菌、革兰氏阳性细菌及线虫均有显著的拮抗作用,是具有重要生防前景的一类细菌[32-33]。例如,溶杆菌属生防菌06-4 能在魔芋根际生态位点稳定定殖,对魔芋软腐病控制效果达58.92%[34]。Chryseolinea属在与刺槐间作的魔芋根际也占有一定比例。有研究表明,Chryseolinea属细菌在土壤氮循环过程中发挥着重要作用[35-36]。上述菌属细菌丰度的增加可能有利于间作魔芋植株的生长并增强其抗病能力。
3.2 不同根系分隔方式对魔芋根际土壤氮循环关键功能基因丰度的影响
本研究利用qRT-PCR 技术检测了7 个关键氮循环功能基因,以研究间作对参与反硝化、硝化和固氮作用微生物的影响。nifH是生物固氮的关键基因,主要编码调控固氮酶铁蛋白的合成;氨氧化古菌(ammoniaoxidizing archaea,AOA)的amoA基因编码调控氨单加氧酶,参与调控硝化过程;nirS和nosZ是调控反硝化过程的关键基因。以上调控氮循环固氮过程(nifH)、硝化过程(AOAamoA)及反硝化过程(nirS和nosZ)的关键基因在无隔处理中的拷贝数显著高于全隔单作(图6),说明间作刺槐改变了魔芋根际微生物群落结构,尤其改变了氮循环相关微生物基因拷贝数,从而促进整个氮循环过程。与前人研究结果类似,如杨亚东等[37]研究表明,大豆‖燕麦和绿豆‖燕麦间作显著提高了燕麦土壤固氮微生物nifH基因拷贝数,改变了固氮微生物的群落结构和优势类群的相对丰度。
3.3 间作刺槐的魔芋根际细菌与软腐病发生的关系
国内外研究认为,土传病害的发生与土壤微生物多样性相关[11-13,38]。一方面,土传病害的发生会降低土壤微生物多样性[29],例如患有软腐病的魔芋根系和根际土壤细菌群落结构发生改变且多样性指数较健康土壤明显降低[39]。另一方面,土壤微生物群落结构及多样性变化也影响土传病害的发生,例如微生物多样性高的辣椒根际土壤枯萎病病原菌数量少且难以大量繁殖[40]。已有研究表明,魔芋软腐病的发生及程度是病原菌与根际微生物互作的结果[41-43]。根际微生物在防控土传病害和促进植物生长方面具有重要作用[44]。本研究中,网隔和无隔处理下魔芋软腐病发病率较全隔明显降低,可能与溶杆菌属、链霉菌属、固氮和反硝化微生物比例增加有关,这些细菌种类增强了植株抵抗病原菌的能力,从而降低了魔芋软腐病的发病率。
4 结论
随着刺槐与魔芋种间根系互作强度的增强,即种间根系从完全隔离(单作)到不完全隔离(半互作)再到开放无隔(互作)变化,魔芋根系和根际土壤细菌物种丰富度和α 多样性指数依次增加。同时,间作改变了根际细菌和氮循环相关微生物群落结构,增加了一些有益细菌丰度,提高了植株对软腐病菌的抵抗能力,从而降低了魔芋软腐病的发病率。

