NF-κB信号途径在小鼠狼疮性肾炎发病中的可能作用①
封晓娟 刘淑霞 张玉军 郭惠芳 郝 军 陈 宁 唐丽娟 刘青娟 吴海江
(河北医科大学病理教研室,石家庄 050017)
NF-κB信号途径在小鼠狼疮性肾炎发病中的可能作用①
封晓娟 刘淑霞 张玉军 郭惠芳 郝 军 陈 宁 唐丽娟 刘青娟 吴海江
(河北医科大学病理教研室,石家庄 050017)
目的:探讨NF-κB信号途径在小鼠狼疮性肾炎发病中的可能作用。方法:选取16周龄的雄性BXSB小鼠(狼疮性肾炎模型组)和同周龄C57BL/6小鼠(正常对照组)作为研究对象,透射电镜和PAS染色观察肾组织的超微结构形态改变;RT-PCR技术检测小鼠全血中HMGB1mRNA的表达变化。采用ELISA方法检测血清中HMGB1蛋白浓度;免疫组织化学检测肾组织中HMGB1和PCNA蛋白的表达变化;Western blot和流式细胞术检测肾组织中RAGE、p-NF-κB和IκB蛋白的表达。结果:16周时,与正常的C57BL/6小鼠相比,BXSB小鼠血清中BUN水平及尿中微球白蛋白水平明显升高;与正常的C57BL/6小鼠相比,BXSB小鼠全血中HMGB1mRNA水平和血清中HMGB1蛋白浓度明显升高;16周时,与正常的C57BL/6小鼠相比,BXSB基底膜明显增厚,部分足突融合,内皮细胞下可见团块状电子致密物沉积;与正常的C57BL/6小鼠相比,BXSB小鼠肾组织的肾小球中可见较多的PCNA阳性表达,肾小管上皮细胞核内也可见少量的表达;BXSB小鼠肾组织中HMGB1蛋白表达升高,HMGB1蛋白尤其在细胞增生明显而肥大的肾小球呈高表达,主要位于细胞浆和细胞外;而在C57BL/6小鼠肾脏组织中以小管细胞核表达为主;与对照组相比,BXSB小鼠肾组织p-NF-κB和RAGE蛋白表达明显升高;而IκB蛋白表达明显降低;HMGB1蛋白与p-NF-κB蛋白表达呈显著正相关(r=0.833,P=0.000);p-NF-κB蛋白与 RAGE蛋白表达呈显著正相关(r=0.621,P=0.018);HMGB1蛋白与 RAGE蛋白表达呈显著正相关(r=0.848,P=0.000);p-NF-κB蛋白与 IκB蛋白表达呈显著负相关(r=-0.759,P=0.002)。结论:HMGB1在小鼠狼疮性肾炎中的致炎作用可能部分通过结合其受体RAGE,激活NF-κB信号途径,促进肾小球固有细胞的增生,从而导致增生性肾小球肾炎形成而实现的。
狼疮性肾炎;HMGB1;RAGE;NF-κB;IκB;细胞增殖
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种侵犯多系统的自身免疫性疾病,常伴肾脏受累即狼疮性肾炎(Lupusnephritis,LN)。其病理变化主要为系膜细胞增生和系膜基质增多,并伴有明显的淋巴细胞和巨噬细胞的浸润。目前研究证实,细胞因子在SLE的发病和病变进展过程中发挥着重要的作用。高迁移率族蛋白1(High mobility group protein box 1,HMGB1)是最新发现的一种新型炎性细胞因子,参与细胞核内多种生物学功能。研究发现,HMGB1是狼疮性肾炎发病过程的重要的细胞因子之一,且与患者蛋白尿的形成有关,TLR4(Toll like receptor 4,TLR4)是其受体之一,但并非是主要的受体[1],同时其作用的信号转导机制尚不清楚。因此为了探讨其在狼疮性肾炎发病过程中的信号机制,本研究以 BXSB小鼠为研究对象,观察HMGB1在其肾组织中的表达变化,并通过检测PCNA、p-NF-κB、IκB 和晚期糖基化终产物受体(Receptor for advanced glycation end products,RAGE)的表达变化,分析其与HMGB1的相关性,阐明NF-κB信号转导机制在狼疮性肾炎发病中的可能作用,为临床对狼疮性肾炎的防治提供实验理论依据。
1 材料与方法
1.1 主要试剂与仪器 兔抗小鼠Phospho-NF-κB p65(Ser276)多克隆抗体(Cell signaling);兔抗鼠HMGB1多克隆抗体(abcom);兔抗鼠RAGE(Bioreagent)、PCNA 单克隆抗体(Santa Cruz);IκB(eBioscience),β-actin(北京中杉金桥公司),HRP标记的IgG二抗(北京中杉金桥公司),免疫组织化学试剂盒(晶美生物工程有限公司),NF-κB原位杂交试剂盒(Santa Cruz);Epics-XLⅡ型流式细胞仪(美国Beckman Coulter);化学发光法西门子全自动免疫化学发光分析仪;RNAprep pure血液总RNA提取试剂盒(天根生化科技有限公司);HMGB1 ELISA试剂盒(Unionhoest公司)。
1.2 实验动物及分组 11周龄雄性BXSB小鼠16只,体重18~22克,引种自美国Jackson实验室,由北京大学医学部免疫学系繁殖饲养;另取11周龄雄性C57BL/6小鼠14只,体重18~22克,购自北京大学医学部动物中心。所有动物于清洁环境中饲以标准饲料,动物自由进食、饮水。周龄雄性BXSB小鼠为狼疮性肾炎模型组(LN组),同周龄雄性C57BL/6小鼠为正常对照组,所有动物适应性饲养一周后进入实验,实验起点为12周龄初、实验终点为16周龄末,共四周。
1.3 标本采集 所有小鼠均于实验终点眼眶取血,处死动物。肾脏皮质分别于4%多聚甲醛、2.5%戊二醛固定,另留取于液氮速冻后转至-153℃冰箱待用。
1.4 血清BUN、Ccr水平及尿微量白蛋白的测定膀胱穿刺取尿,化学发光法西门子全自动免疫化学发光分析仪检测尿微量球蛋白;内眦静脉取血,室温静止2小时,离心后取上清,用希森美康CHEMIX-180全自动生化测定仪测定BUN和Ccr水平。
1.5 ELISA方法检测血清中HMGB1的浓度 检测过程严格按照试剂盒说明书操作。采用常规双抗体夹心ELISA法检测,TMB显色,在450 nm处测定吸光度(A)值。通过绘制标准曲线求出标本中HMGB1的浓度。
1.6 RT-PCR技术检测小鼠全血中HMGB1mRNA的表达变化 内眦静脉取血,采用RNAprep pure血液总RNA提取试剂盒提取新鲜血液样品总RNA,在25 μl总体积中以O ligo(dT)15引物将2μg总反转录成cDNA,经PCR扩增合成内参18SrRNA和目的DNA。反应条件为:95℃预变性5分钟,94℃变性1分钟,不同退火温度退火时间60秒,72℃延伸60秒,循环35次,72℃再延伸8分钟(PCR引物序列及PCR反应条件详见表1)。取5μl PCR产物,经1%琼脂糖凝胶上电泳。用凝胶成像系统摄像后并读取其积分吸光度值。根据PCR产物电泳条带与内参照18S rRNA相对强度的比值来确定mRNA的相对表达水平。
1.7 常规光镜检查 肾组织经4%多聚甲醛固定后,常规脱水、包埋,切片厚2μm,分别行HE和PAS染色。
1.8 电镜观察肾组织形态学变化 肾皮质组织2.5%的戊二醛4℃固定4小时,继以2%锇酸固定2小时,然后用梯度丙酮脱水,Epon812浸透与包埋,超薄切片机进行切片,醋酸铀及柠檬酸铅电子染色,H-7500透射电镜观察、照相。
1.9 免疫组织化学检测肾组织中HMGB1及PCNA的表达变化 切片厚4μm,常规脱蜡水化,一抗为兔抗鼠PCNA单克隆抗体(1∶50稀释)、兔抗鼠HMGB1多克隆抗体(1∶200),二抗为生物素化羊抗兔IgG(1∶100稀释),以PBS代替一抗作为阴性对照,DAB显色,光镜观察阳性信号。结果判定:HMGB1阳性信号定位于细胞核、细胞浆或细胞外,为棕黄色颗粒;PCNA阳性信号均定位于细胞核呈棕黄色颗粒。
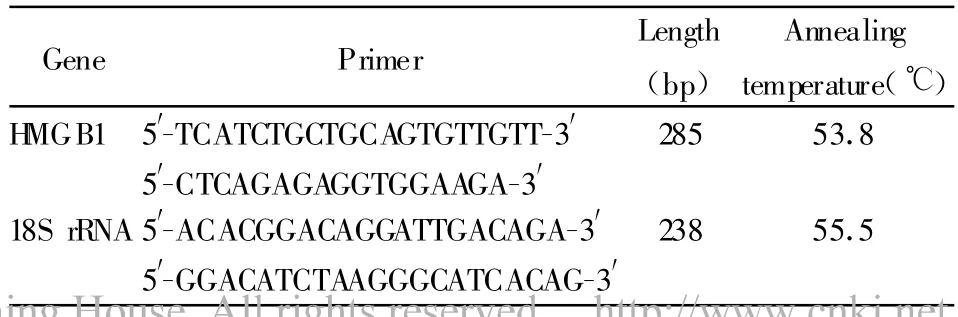
表1 PCR引物序列及PCR反应条件Tab.1 PCR p rimer
1.10 FCM 检测肾组织中HMGB1、RAGE、p-NF-κB和IκB蛋白的表达变化 将标本用网搓法制成单细胞悬液,采用间接免疫荧光标记方法,取单细胞悬液1×106ml-1,加入兔抗鼠HMGB1、RAGE、p-NF-κB 和IκB多克隆抗体0.1ml,室温孵育30分钟,PBS洗涤后加入1∶50羊抗兔FITC-IgG二抗工作液100μl,避光室温孵育30分钟,PBS洗涤后,在Epics-XLⅡ型流式细胞仪进行检测。数据和组方图输入计算机,应用Expo32 ADC软件进行免疫荧光资料分析。设PBS代替一抗和二抗的阴性对照,以及只加一抗或二抗的阳性对照和同型对照。以荧光指数(FI)表示HMGB1、p-NF-κB、RAGE 和 IκB 的相对含量,公式 :
FI=(样品蛋白表达的平均荧光强度 -对照样品平均荧光强度)/正常对照样品平均荧光强度。
1.11 Western blot检测肾组织中RAGE的表达变化取100mg肾组织,碾碎后加入1m l细胞裂解液超声粉碎,4℃15 000 r/m in离心15分钟,上清用考马斯亮蓝法进行蛋白质定量。相同量的蛋白经SDSPAGE凝胶电泳,转膜,5%脱脂奶粉37℃封闭2小时后,加入兔抗小鼠 RAGE抗体(1∶200)、actin多克隆抗体(1∶1 000),4℃过夜。TBST漂洗后滴加HRP标记的IgG二抗(1∶5 000)杂交,洗膜后ECL化学发光并曝光成像,利用图像分析系统扫描。β-actin作为内参照,结果用靶蛋白/β-actin的相对吸光度值表示。
2 结果
2.1 两组小鼠肾功能比较 16周时,BXSB小鼠血清中BUN水平为(9.60±0.83),尿微球蛋白水平为
(3.94±0.39),明显高于正常对照组(6.95±0.96;2.50±0.05)(P<0.01,P<0.01);而CCr水平相比两者无显著性差异P>0.05,表2。
2.2 不同组血清中HMGB1蛋白水平的表达变化
ELISA检测结果显示,狼疮性肾炎模型组小鼠血清HMGB1蛋白(0.570 4±0.025 6)明显高于正常对照组(0.536 5±0.001 5)(表2,P=0)。
2.3 不同组小鼠全血中HMGB1mRNA的表达 RTPCR产物经琼脂糖凝胶电泳结果显示,正常小鼠全血中几乎检测不到HMGB1mRNA的表达,而BXBS小鼠血中HMGB1mRNA相对表达量为(0.367 4±0.130 5),明显高于正常对照组(图1,P<0.05)。
2.4 两组小鼠肾组织形态学改变 16周时,与正常对照组相比,狼疮性肾炎模型组小鼠肾小球基底膜明显不规则增厚,部分足突融合,内皮细胞下可见团块状电子致密物沉积(图2和图3)。
2.5 HMGB1蛋白在不同组小鼠肾组织的表达变化
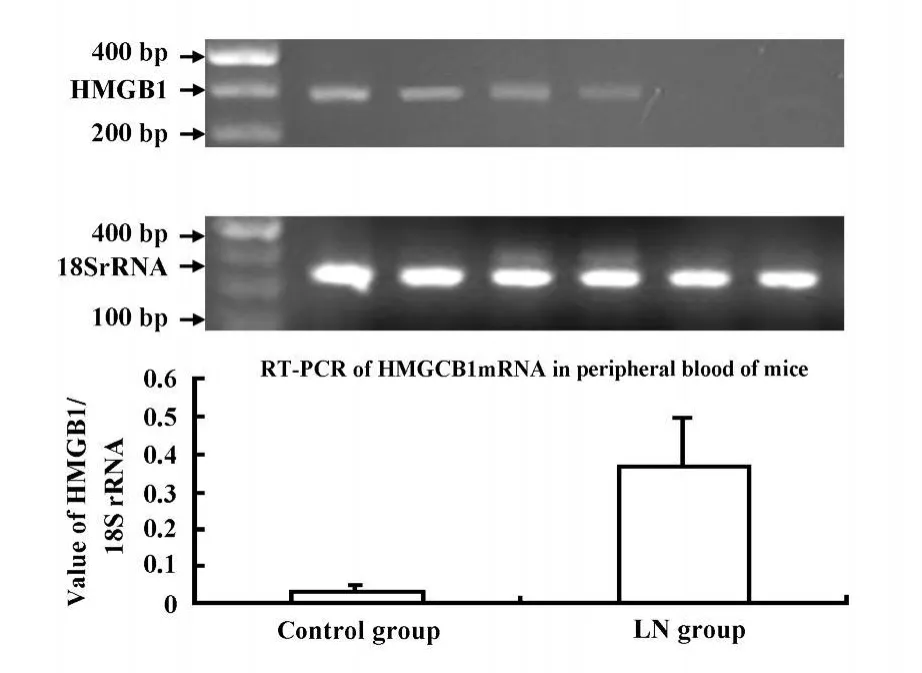
图1 HMGB1 mRNA在正常对照和狼疮性肾炎模型组全血中的表达变化Fig.1 Expression of HMGB1mRNA in blood of control and LN group by RT-PCR
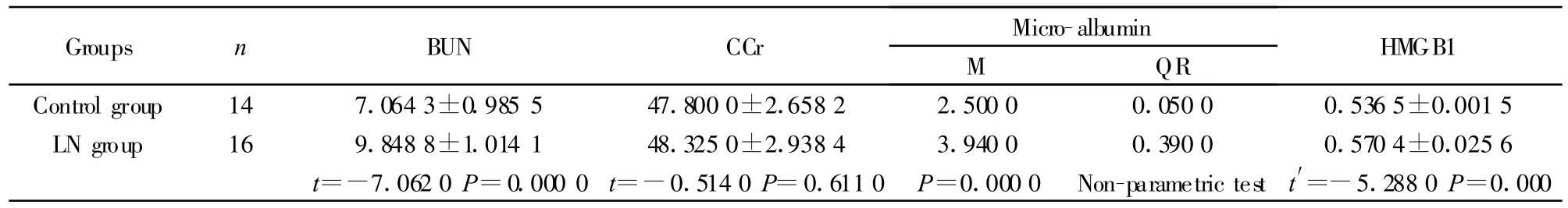
表2 不同组肾功能比较Tab.2 Rena l function change of different groups
免疫组织化学结果显示,HMGB1蛋白阳性信号定位于细胞核、细胞浆或细胞外。在正常对照组小鼠肾组织中可见HMGB1少量表达,主要定位于肾小管上皮细胞胞核,肾小球表达甚少,而在狼疮性肾炎模型组小鼠肾组织中HMGB1表达升高,肾小球和肾小管内均有表达,且主要定位于细胞浆和细胞外,尤其在细胞增生明显的肾小球中呈强阳性表达(图4)。
流式细胞术检测结果显示,与正常对照组小鼠相比,狼疮性肾炎模型组小鼠肾皮质中HMGB1蛋白表达升高,经统计学处理有显著性差异(P<0.01,表3)。
2.6 不同组肾组织中PCNA的表达变化 免疫组织化学结果显示,PCNA阳性信号主要定位于细胞核;正常对照组小鼠肾组织中未见PCNA阳性表达,而狼疮性肾炎模型组小鼠肾组织的肾小球中可见较多的阳性表达,肾小管上皮细胞核内也可见少量的表达(图5)。
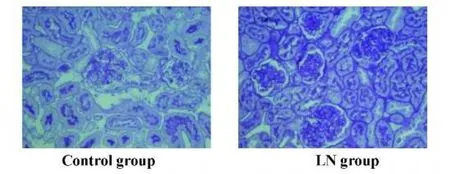
图2 PAS染色观察不同组别肾组织的形态学变化(×400)Fig.2 PASstains of renal tissue in LN group(16 weeks)andcontrol group(×400)

图3 透射电镜观察不同组肾小球基底膜的变化(20 000×)Fig.3 Transm ission electron m icroscope for change of basementmembrane in control and LN group(20 000×)
2.7 p-NF-κB 、IκB 和 RAGE 在不同组肾组织中的表达变化 流式细胞术检测结果显示,与正常对照组相比,狼疮性肾炎模型组小鼠肾皮质中RAGE和 p-NFκB蛋白表达均升高,而IκB蛋白表达降低,经统计学处理有显著性差异(P<0.05或0.01,表3)。Western b lot结果显示,狼疮性肾炎模型组小鼠肾组织中RAGE相对吸光度值为22.49±12.71,明显高于正常对照组(2.69±0.64)见图6,P<0.01。

图4 免疫组织化学检测正常对照和狼疮性肾炎模型组肾组织中HMGB1蛋白的表达变化(IHC,400×)Fig.4 Expression of HMGB1 in renal tissue of control and LN group(IHC,400×)

图5 PCNA在正常对照和狼疮性肾炎模型组肾组织中的表达变化(IHC,400×)Fig.5 Expression of PCNA in renal tissue of control and LN group(IHC,400×)
表3 流式细胞术检测正常对照组和狼疮性肾炎模型组肾组织中HMGB1、RAGE、NF-κB和IκB蛋白的表达变化(±s)Tab.3 Expression of HMGB1,RAGE,NF-κB and IκB in renal tissue of controland LN group by FCM(±s)

表3 流式细胞术检测正常对照组和狼疮性肾炎模型组肾组织中HMGB1、RAGE、NF-κB和IκB蛋白的表达变化(±s)Tab.3 Expression of HMGB1,RAGE,NF-κB and IκB in renal tissue of controland LN group by FCM(±s)
Note:t-test,1)P<0.05,2)P<0.01 vs control.
Groups n HMGB1 p-NF-κB RAGE IκB Control group 7 1.00±0.04 1.00±0.13 1.00±0.06 1.00±0.05 LN group 7 1.28±0.072) 1.21±0.151) 1.25±0.042) 0.78±0.042)
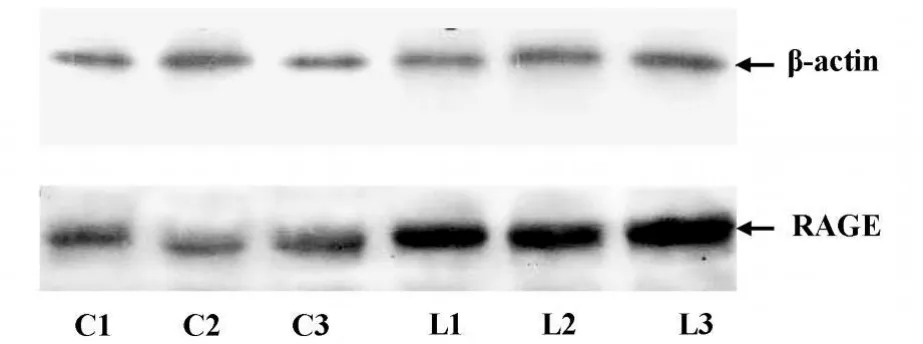
图6 RAGE在正常对照和狼疮性肾炎模型组肾组织中的表达变化Fig.6 Expression of RAGE in renal tissue of control and LN group by Western blot
2.8 相关性分析 经Pearson's相关分析,HMGB1蛋白与p-NF-κB蛋白表达呈显著正相关(r=0.833,P=0.000);p-NF-κB蛋白与RAGE蛋白表达呈显著正相关(r=0.621,P=0.018);;HMGB1蛋白与RAGE蛋白表达呈显著正相关(r=0.848,P=0.000)p-NF-κB蛋白与 IκB 蛋白表达呈显著负相关(r=-0.759,P=0.002)。
3 讨论
雄性BXSB小鼠由于携带Y染色体连锁的自身免疫增强基因(Yaa基因)而于第八周龄开始发生自发性自身免疫性疾病,类似于人类SLE,是狼疮性肾炎研究比较常用的实验动物模型,其中后期肾脏改变类似人类Ⅳ型狼疮性肾炎。本研究发现,16周时,BXSB小鼠出现了明显的狼疮性肾炎的病理表现即肾小球基底膜增厚、足突融合、内皮下电子致密物沉积,同时肾小球内细胞明显增生,同时伴有肾功能的下降。上述改变与临床狼疮性肾炎的病理变化很相似。
作为一个新型细胞因子,HMGB1在急慢性炎症性疾病中的作用得到越来越多的重视。已往的研究己经证实,HMGB1参与了多种自身免疫性疾病的发生和发展[2,3]。我们的前期实验结果显示,HMGB1是狼疮性肾炎发病中的一个重要细胞因子,且与蛋白尿的形成有关[1]。本研究显示,BXSB小鼠外周血中HMGBmRNA及血清中HMGB1蛋白水平均明显高于正常对照组,提示狼疮性肾炎发病过程中外周血单个核细胞能够合成和分泌HMGB1,导致血清中HMGB1水平升高,从而引起肾脏损害。
我们采用免疫组织化学的方法检测了HMGB1蛋白在肾组织中的定位和表达强度,结果显示,C57BL/6小鼠肾组织中,HMGB1只表达在肾小管上皮细胞核内,不表达于胞浆和细胞外,说明在正常肾组织中,HMGB1是一种典型的DNA结合蛋白,承担着“DNA伴侣”作用,在DNA修复、重组、细胞分化中起着重要作用[4];而在BXSB小鼠肾组织中HMGB1蛋白表达升高,主要定位肾小球和肾小管的细胞浆或细胞外,且在细胞增生明显的肾小球中呈强阳性表达,表明在狼疮性肾炎发病过程中伴有肾组织中HMGB1的表达升高,而且HMGB1表达的移位与其发挥细胞因子功能进而促进炎症反应密不可分。但是肾小球中高表达的HMGB1是外周血单个核细胞合成释放的还是浸润在肾组织中的淋巴细胞、巨噬细胞合成释放的抑或是肾小球系膜细胞合成转位形成的,目前的实验结果尚不能确定,需进一步实验证实。
HMGB1最重要的受体之一是晚期糖基化终产物受体(Receptor for advanced glycation end products,RAGE)。RAGE是个多配体受体,属于免疫球蛋白超家族,是一个能扩大和加剧免疫反应的跨膜蛋白[5]。HMGB1与RAGE之间的结合力强,在部分未成熟的或者恶性程度高的肿瘤中,HMGB1和RAGE两者共表达,且和肿瘤的转移和预后密切相关[6-8]。RAGE在肾脏疾病中也具有重要作用,Yamamoto等将人RAGE基因转导进入动物,使动物强制性表达RAGE,与对照组相比,转基因动物出现了肾脏增大、肾小球肥大、蛋白尿增加等损害[9]。人类IV型狼疮性肾炎的肾小球系脏层上皮细胞中也表达RAGE[10]。RAGE能在单核巨噬细胞、血管内皮细胞、肾小球系膜细胞、血管平滑肌细胞等细胞表面表达,通过与其配体结合,趋化单核巨噬细胞,导致血管内皮的损伤,血管炎的形成,并诱导系膜细胞产生多种基质成分使得肾小球发生纤维化[11]。本研究结果显示,在狼疮性肾炎肾组织中RAGE蛋白表达明显高于正常对照组,且与HMGB1蛋白表达升高具有一致性。因此推断,HMGB1在小鼠狼疮性肾炎中的致炎作用可能是通过结合RAGE后激发下游反应而实现的。
细胞因子与受体蛋白结合后需要一系列信号转导分子将信号传入细胞内。HMGB1与RAGE结合后能激活NF-κB、MAPK、纤溶酶原激活物抑制剂、Cdc42和Rac等信号传导途径,传递炎症信息,激发炎症反应[12]。本研究采用磷酸化NF-κB抗体检测肾组织中NF-κB蛋白表达,结果显示,狼疮性肾炎模型组小鼠肾组织中p-NF-κB蛋白表达显著高于正常对照组,而IκB低于正常对照组,提示在小鼠狼疮性肾炎的发病过程中,下调IκB的表达使NF-κB的解离增加,促进NF-κB的核转位,增加促炎介质的基因转录、表达与释放,从而促进炎症的级联反应;同时还发现,RAGE和NF-κB蛋白表达高度正相关,因此推断,细胞因子HMGB1与其受体蛋白RAGE结合后,触发一系列级联过程,使得NF-κB激活和异位,从而引起肾小球细胞的增生。
综上所述,细胞因子HMGB1参与了狼疮性肾炎的发病过程,其机制可能是通过与其受体RAGE结合,激活IκB/NF-κB信号途径,从而介导肾小球细胞的增生及狼疮性肾炎的发生。
1 刘淑霞,郝 军,郭惠芳etal.TLR4介导高迁移率族蛋白致系统性红斑狼疮肾损害的作用机制研究[J].中华微生物学和免疫学杂志,2008;28(12):1079-1083.
2 Ek M,Popovic K,Harris H Eetal.Increased extracellular levelsof the novel proinflammatory cytokine highmobility group box chromosomal protein 1 inm inor salivary glands of patients with Sjögren's syndrome[J].Arthritis Rheum,2006;54(7):2289-2294.
3 Barkauskaite V,Ek M,Popovic Ketal.Translocation of the novel cytokine HMGB1 to the cytoplasm and extracellular space coincideswith the peak of clinicalactivity in experimentally UV-induced lesionsof cutaneous lupuserythematosus[J].Lupus,2007;16(10):794-802.
4 Bonaldi T,LangstG,Strohner Retal.TheDNA chaperoneHMGB1 facilitates ACF/CHRAC-dependent nucleosome sliding[J].EMBO J,2002;21:6865-6873.
5 Schm idt AM,Yan SD,Yan SFetal.Themultiligand receptor RAGE as a progression factor amplifying immune and inflammatory responses[J].J Clin Invest,2001;108(7):949-955.
6 IshiguroH,NakaigawaN,MiyoshiYetal.Receptor foradvancedglycation end products(RAGE)and its ligand,amphoterin areoverexpressed and associated with prostate cancer development[J].Prostate,2005;64(1):92-100.
7 Sasahira T,Akama Y,Fujii Ketal.Expression of receptor for advanced glycation end products and HMGB1/amphoterin in colorectal adenomas[J].Virchows Arch,2005;446(4):411-415.
8 Huttunen H J,Fages C,Kujia-Panula Jetal..Receptor for advanced glycation end products-binding C00H-terminalmotif ofamphoterin inhibits invasivem igration and metastasis[J].Cancer Res,2002;62(16):4805-4811.
9 Yamamoto Y,Kato I,DoiTetal.Development and prevention ofadvanced diabeticnephropathy in RAGE-over expressing mice[J].JClin Invest,2001;108(2):261-268.
10 TanjiN,MarkowitzGS,Fu Cetal.Expression of advanced glycation end products and their cellular receptor RAGE in diabetic nephropathy and nondiabetic renal disease[J].JAm Soc Nephrol,2000;11(9):1656-1666.
11 Harashim A,Yamamoto Y,Yamamoto H.AGE-RAGE system in diabetic microangiopathy[J].Nippon Rinnsho,2005;63(Su16):62-66.
12 Kokkola R,Andersson A,Mullins Getal.RAGE is themajor receptor for the proinflammatory activity of HMGB1 in rodent macrophages[J].Scand JImmunol,2005;61(1):1-9.
[收稿2009-09-02]
(编辑 许四平)
Effect of NF-κB signal pathway in murine lupus nephritis
FENGXiao-Juan,LIUShu-Xia,ZHANGYu-Jun,GUOHui-Fang,HAOJun,CHENNing,TANGLi-Juan,LIUQing-Juan,WUHai-Jiang.DepartmentofPathology,HebeiMedicalUniversity,Shijiazhuang050017,China
Objective:To investigate the expression andmechanism of NF-κB signal pathway inmurine lupus nephritis.Methods:The BXSBmice aswell as C57BL/6 of 16weekswereused.Transmission electronmicroscope and PASwereused to detect the pathological change of renal tissue.RT-PCR and ELISAwere used to detect the expression of HMGB1mRNA and p rotein.The expression of HMGB1,p-NF-κB,RAGE,IκB and PCNA p roteinwas detected by immunohistochemical stain,FCM and Westernb lot.Results:The level of BUN in serum and Micro-albumin in urine of BXSBmicewas higher than that in C57BL/6mice.The expression ofHMGB1mRNA and HMGB1 protein level in peripheral blood increased significantly in BXSBgroup.Compared with those in controlgroup,electronmicroscopy and PAS revealed the thickness of glomerularbasementmembrane(GBM),fusion of footprocesses partly of epithelial delland subepithelial electron-dense deposits in the renal tissue of BXSBAmice.Compared with thatof controlgroup,expression of PCNAwas higher in glomeruli of BXSBmouse.HMGB1 proteinoverexpression localized in cytoplasm and extracellularmilieu,especially in proliferativeglomeruliin BXSB group,while the HMGB1 protein primarily confined to the nuclear of tubule in control group.In BXSB group,the expression of p-NF-κB and RAGE increased,while the expression of IκB decreased.Therewere positive correlationbetween the expressionof HMGB1,RAGE and p-NF-κB protein(r=0.833,0.621,0.848,P<0.01),while the expression of p-NF-κB protein negatively correlated with thatof IκB.Conclusion:HMGB1 could activate NF-κB through combiningwith its receptor-RAGE,induce the form of proliferative glomerulonephritis by promoting the proliferation of inherent cell of glomeruli,whichmay play an important role in themurine lupusnephritis.
Lupus nephritise;HMGB1;RAGE;NF-κB;IκB;Cell proliferation
R363 R593
A
1000-484X(2010)02-0169-05
①本文为河北省自然科学基金(C2007000828)及河北省卫生厅课题(08055)
封晓娟(1985年-),女,在读硕士,主要从事肾脏病理学研究,E-mail:fengxiaojuan1985@163.com;
及指导教师:刘淑霞(1976年-),女,医学博士,副教授,硕士生导师,主要从事肾脏病理学研究,E-mail:susanliu1976@163.com。

