κ-卡拉胶硫酸多糖的免疫调节活性初步研究
(烟台大学 海洋学院,山东 烟台 264005)
多糖分子修饰的方法主要有硫酸化、羧乙基化、羧甲基化以及双基团衍生化等[1]。其中,多糖的硫酸化修饰由于具有独特的作用而成为研究的热点。硫酸化多糖的抗病毒作用在艾滋病治疗上得到证实[2]。硫酸化修饰后的茯苓多糖(pachymaran)能溶于水,并增强了机体的免疫功能,具备抗肿瘤、抗病毒等活性多糖的硫酸化为多糖带来了新的活性和功能[3]。
κ-卡拉胶(KC)具有优良的热可逆凝胶化、抗蛋白凝结、亲水无毒等独特性能,在食品、化工和包装等方面应用广泛[4]。特别是近年来在医药和生物工程领域的应用,更引起了人们的研究兴趣。近来研究发现卡拉胶本身就具有特殊的医药疗效,它对许多重要病毒病原(如疱疹病毒、HIV、粘液病毒、棒状病毒等) 具有广谱抑制活性,还对免疫系统具有持续性作用,它是有效的抗胃蛋白酶活、抗溃疡、抗凝血、抗栓物质[5]。而硫酸基对卡拉胶的生物活性具有关键作用。Carlucci等[6]的研究表明,如将多糖上的硫酸根除去,则卡拉胶抑制疱疹病毒复制的作用随之消失。Yamada等[7]发现硫酸化修饰的κ-卡拉胶的抗HIV活性较κ-卡拉胶原糖增加。本实验室从角叉菜(Chondrus Ocellatus)中采用水提醇沉法提取角叉菜卡拉胶,对其进行分级处理得到κ-卡拉胶(KC),采用氯磺酸-吡啶法对κ-卡拉胶进行硫酸化修饰。并对角叉菜卡拉胶及其硫酸化衍生物对细胞的免疫活性进行初步比较研究,探讨硫酸化修饰对κ-卡拉胶生物活性的影响,以期通过分子修饰技术提高角叉菜卡拉胶的生物功效。
1 材料与方法
1.1 κ-卡拉胶的制备
干燥角叉菜粉碎后,经热水浸提(80℃)、离心、KCl分级、浓缩、乙醇沉析、复溶、透析、沉析、洗涤、真空干燥等工艺得到角叉菜多糖κ-卡拉胶,经液相检测测定的κ-卡拉胶的分子质量为 1 771 721 u,硫酸化修饰的卡拉胶的分子质量为1 737 953 u。
1.2 试剂和仪器
RPMI1640培养液:美国 HyClone公司(批号:AMC15824),加10%小牛血清、双抗、HEPES;小牛血清:美国HyClone公司;MTT(噻唑蓝),Sigma公司产品;DMSO:AMRESCO分装;氯磺酸、吡啶、甲酰胺、刀豆蛋白等均为分析纯或生化试剂;昆明种小鼠(BALB / c),雄性,体质量32 g,购自山东省实验动物中心。
ELX-800酶联免疫检测仪:美国 Bio-Tek Instruments INC.;LabTeach UV-1100型紫外分析仪:美国莱伯泰科公司;Shimadzu IR-400型红外光谱仪:日本岛津株式会社。
2 实验方法
2.1 角叉菜κ-卡拉胶的硫酸化修饰
采用氯磺酸- 吡啶法[8]对角叉菜κ-卡拉胶进行硫酸化修饰。在带有搅拌装置和冷凝装置的三颈烧瓶中加入预冷的无水吡啶,并将烧瓶置于冰盐浴中搅拌,再将氯磺酸于40 min内逐滴加入。滴加完毕后撤去冰盐浴,室温下加入1.0 g角叉菜κ-卡拉胶与30 mL甲酰胺悬液,60℃下搅拌2 h,将三颈烧瓶置于100 mL冰水中结束反应,用1 mol/L NaOH中和至pH 7.5。加入3倍体积的无水乙醇,静置、离心,洗涤3次,将沉淀自来水透析3 d,对蒸馏水透析1 d。真空冷冻干燥得到角叉菜κ-卡拉胶硫酸化衍生物。
2.2 κ-卡拉胶的硫酸基含量测定
用氯化钡-明胶法[9]测定硫酸化前后κ-卡拉胶的硫酸基含量。
2.3 紫外光谱分析
将多糖样品配成 0.1 %水溶液,在 LabTeach UV-1100型紫外分析仪上对200~500 nm 区间进行扫描。
2.4 硫酸化κ-卡拉胶的免疫活性研究
2.4.1 SKC对正常小鼠脾淋巴细胞增殖活性的影响
小鼠脱颈处死,无菌取脾,将脾放入已消毒的平皿中,用 RPMI-1640培养液反复冲脾,碾磨获取脾细胞悬液,裂解红细胞,离心洗涤,最后用含有10%胎牛血清的完全培养液制成细胞密度为 2×106个/mL的脾细胞悬液,备用。用完全培养液配制 50 mg/L ConA(刀豆蛋白)溶液备用。实验组每孔加入不同浓度的卡拉胶,使其最终质量浓度分别为25、50、100、200、400 mg/L,于 96孔培养板中,每孔加入100 μL 细胞悬液,再加 100 μL 培养液(空白对照)、10 mg/L ConA(阳性对照)及含有不同浓度的以培养基配制的样品溶液,振荡混匀后,置于37℃、5%CO2培养箱中培养 72 h。终止培养前 4 h,每孔加入MTT(5 g/L)20 μL,混匀后继续培养4 h。培养结束后,小心吸弃上清液,每孔加入150 μL二甲基亚砜,振荡10 min使紫色结晶完全溶解,以调零复孔调零(以培养液调零),在酶标仪上测各孔的吸光值(测定波长570 nm,参比波长630 nm)
淋巴细胞增殖率(%)=多糖刺激孔吸光度值/空白对照孔吸光度值×100
2.4.2 SKC对小鼠单核-巨噬细胞RAW264.7增殖作用的影响
取处于对数生长期的小鼠单核-巨噬细胞RAW264.7,胰酶消化收集细胞,用含 10%胎牛血清的培养液调整细胞密度为5×105个/mL,加入96孔板,100 μL/孔,贴壁 2 h 后,换新鲜培养液 100 μL,再加100 μL 培养液(空白对照)、LPS(脂多糖)阳性对照(终浓度为 2 mg/L)、及含有不同浓度的样品溶液,于37℃、5%的CO2条件下培养24 h。
吸弃上层培养液,补充新鲜的培养液100 μL/孔,同时加入5 g/L的MTT 20μL/孔,同样条件下继续培养4 h后,轻轻吸弃上清,加入150 μL DMSO震荡10 min,充分混匀,置室温 10 min后,用酶标仪在570 nm处测定吸光值。吸光度越大,表明免疫活性越高。
2.4.3 SKC对小鼠腹腔巨噬细胞产生NO的影响
采用亚硝酸盐法测定[10],取处于对数生长期的RAW264.7细胞,调整细胞密度为2.5×105个/mL。96孔板每孔接种 100 μL,每个样品设置 6个重复孔。37°C,5%CO2培养条件下,培养24 h。按照需要的浓度加入100 μL样品,脂多糖溶液(阳性对照,其终质量浓度为4 mg/L),空白对照。继续培养48 h后,从每个孔取 50μL 培养上清液到一个新的 96孔板中,测540 nm处的吸光度,每个浓度6 个复孔,重复3次实验。
2.5 统计方法
用SPSS11.5 统计软件中的One Way ANOVA进行组间数据的比较,用t检验进行两组数据之间的比较。
3 实验结果
3.1 κ-卡拉胶硫酸化修饰后硫酸基含量
本实验采用较温和的条件,即氯磺酸与吡啶质量比 1 :3,反应温度 60℃,时间 1.5 h, 对角叉菜λ-卡拉胶进行硫酸化修饰,采用氯化钡-明胶法将样品数据代入硫酸基标准曲线回归方程(见图1),可得硫酸化修饰前后样品的硫酸基质量分数分别为 21.64%±1.36%,32.58%±0.92%;紫外扫描结果显示在200~400 nm无吸收(图2),说明样品不含蛋白质和核酸。
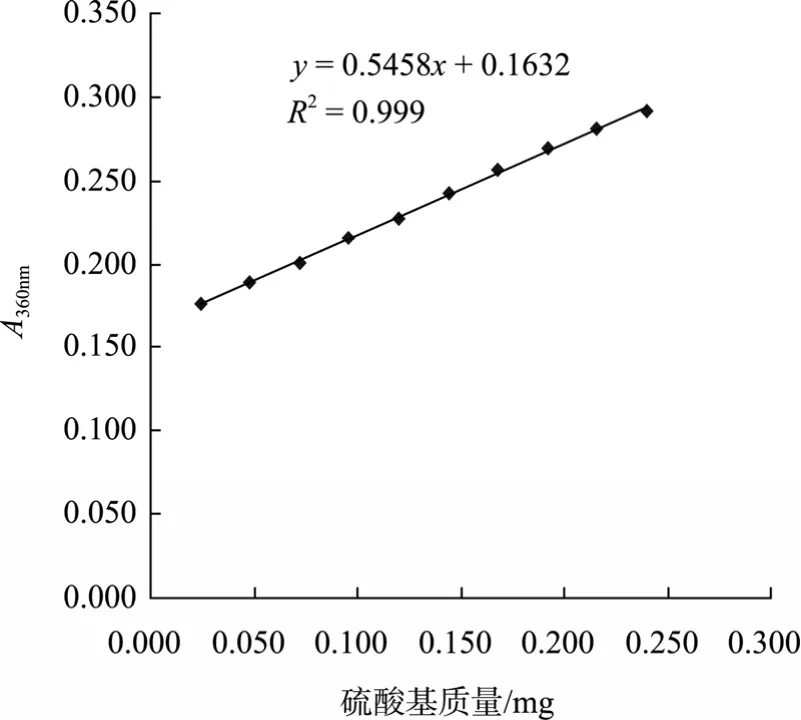
图1 硫酸基含量标准曲线Fig.1 The standard curve of O-SO3-

图2 KC和SKC紫外光图谱Fig.2 Ultraviolet spectra of KC and SKC
3.2 对正常小鼠脾淋巴细胞增殖活性的影响
由图3可见25~400 mg/ L的KC和SKC均能刺激小鼠 T淋巴细胞增殖反应,均有促增殖作用,其中SKC对小鼠脾淋巴细胞促增殖作用更强。与阳性对照 ConA(10 mg/ L)诱导的 T淋巴细胞增殖相比,KC在25~100 mg/ L浓度范围内,对淋巴细胞的促增殖作用不如阳性对照,而 SKC对淋巴细胞增殖的促进作用则优于阳性对照组。在实验浓度范围100~400 mg/ L内,SKC对T淋巴细胞促增殖作用均优于KC (P<0.01),并且本实验浓度范围内SKC显示出小鼠淋巴细胞促增殖作用的剂量依赖关系。实验结果提示硫酸化卡拉胶对小鼠免疫系统中的细胞免疫存在较佳的促进作用,效果要优于卡拉胶。

图3 KC和SKC对淋巴细胞的增殖作用Fig.3 Effects of KC and SKC on the proliferation of mouse peritoneal macrophage
3.3 对小鼠单核-巨噬细胞RAW264.7增殖的影响
由图4可见,与对照组比较,KC及SKC低剂量(25 mg/ L)组未能明显提高单核-巨噬细胞RAW264.7细胞的增殖活性,在质量浓度大于(100 mg/L)两者均能促进单核-巨噬细胞 RAW264.7增殖(P<0.05),而且在100~400 mg/ L范围内SKC的作用均要显著强于KC (P<0.01)。质量浓度在50~400 mg/L之间时,SKC可显著的促进小鼠巨噬细胞 RAW264.7增殖,其作用的强弱随浓度变化,随着浓度的提高,促进作用不断增强,表明SKC对巨噬细胞RAW264.7增殖活性呈现明显的剂量依赖性。SKC的增殖效果较显著,在高浓度时甚至优于阳性药LPS。

图4 KC和SKC对巨噬细胞的增殖作用Fig.4 Effects of KC and SKC on the proliferation of mouse peritoneal macrophage
3.4 对小鼠腹腔巨噬细胞产生NO的影响
将吸光度代入标准曲线方程y= 0.007x+ 0.1269,R2= 0.9972,求得NO的含量,NO含量测定结果表明,与空白对照相比,KC和SKC的高低剂量组均能提高巨噬细胞产生NO量(P< 0.05),其中SKC促进巨噬细胞产生NO的活性较KC更强(P<0.01),并呈一定的剂量依赖性。如图5所示,KC样品在25~400 mg/L的浓度范围内,促使巨噬细胞产生NO低于LPS阳性对照组;而SKC质量浓度大于100 mg/L时,其效果就优于LPS阳性对照组。

图5 KC 和SKC对小鼠腹腔巨噬细胞NO合成的诱导作用Fig.5 Nitric oxide production by murine peritoneal macrophages induced by KC and SKC
4 讨论
本研究发现,κ-卡拉胶经硫酸化修饰后,对代表细胞免疫的淋巴 T细胞和作为机体免疫系统中重要的免疫细胞的巨噬细胞的增殖作用比κ-卡拉胶原糖得到了增强,另外,SKC在诱导巨噬细胞NO的生成方面比KC也有所增加,说明SKC能很好地介导激活的巨噬细胞,具有潜在的抗肿瘤活性和免疫调节作用。这些活性的增加,可能是因为多糖的生物活性与其结构和理化性质紧密相关,而κ-卡拉胶在硫酸酯化后,所带硫酸基团的空间位阻和静电排斥效应改变了κ-卡拉胶原来的空间结构,增加了糖链的屈伸度,提高了水溶性,从而引起生物活性的改变。
SKC除了对肿瘤细胞具有直接的细胞毒作用外,还能通过调节机体免疫功能发挥抗肿瘤作用,克服了化疗药物在抗肿瘤的同时对机体免疫功能的影响,具有一定的开发前景。
[1]张难.多糖的分子修饰及其在功能性食品中的应用[J].食品研究与开发,2007,28(8):159-161.
[2]吴立根,毛文君.衍生化多糖的生物活性研究进展[J].海洋科学,2002,26(5):23-25.
[3]胡亚芹,竺美.卡拉胶及其结构研究进展[J].海洋湖沼通报,2005,1:93-95.
[4]王长云,管华诗.多糖抗病毒作用研究进展Ⅲ.卡拉胶及其抗病毒作用[J].生物工程进展,2000,20(3):29-42.
[5]苏子峰,戴志明,杨建发.多糖免疫机制研究进展[J].云南农业大学学报,2006,21(2):205-209.
[6]Carlucci M J,Pujol C A,Ciancia M,et al.Antiherpetic and anticoagulant properties of carrageenans from the red seaweed Gigartina skottsbergii and their cyclized derivatives:correlation between structure and biological activity[J].Int J Biol Macromol,1997,20:97-105.
[7]Yamada T,Ogamo A,Saito T,et al.Preparation and anti-HIV activity of low-molecular-weight carrageenans and their sulfated derivatives[J].Carbohydr Polym,1997,32:51-55.
[8]Liu Y H,He K Z,Yang M,et al.Antiviral activity against HSV22 of sulfated polysaccharide from cyathula of ficinalis kuan in vitro[J].Chin J Appl Enoiron Biol,2004,10:46-50.
[9]Kawai Y.Modified methods to determine sulfate in polysaccharide[J].AnalChem,1969,32:314-321.
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2003.117-120.

