单环刺螠硫醌氧化还原酶相互作用蛋白质的筛选
谭 志,马玉彬,邵明瑜,张志峰
(1.中国海洋大学 海洋生物遗传育种教育部重点实验室,山东 青岛 266003; 2.青岛农业大学 继续教育学院,山东 青岛 266109)
硫化物对于多数生物的毒害作用表现在:它可以抑制线粒体电子传递链细胞色素氧化酶的活性[1],从而阻止有氧呼吸的进行,进而导致生物体的死亡。近年来,人们发现一些沿岸底栖生物具有耐受和代谢硫化物的能力,并推测一种类似于细菌硫醌氧化还原酶(Sulfide:quinone oxidoreductase,SQR)的蛋白参与这一过程[2],有毒的硫化物可在其催化下被氧化形成硫代硫酸盐或亚硫酸盐等低毒或无毒的产物,此氧化过程中产生的电子通过泛醌进入氧化呼吸链,最终参与ATP的合成,提供有机体能量[3,4]。SQR的功能及作用原理最早在原核生物中被阐述,对于真核生物,Vande Weghe等[5]于1999年首次在粟酒裂殖酵母(Schizosaccharomyces pombe)中得到该酶的基因序列并对其蛋白定位和酶特性进行了研究。2008年 Ursula Theissen等[6]首次在多细胞真核生物沙中利用酿酒酵母(Saccharomycescerevisiae)表达系统获得了具有活性的 SQR,并进一步对其酶活性及保持酶活性所必需的几个保守的氨基酸进行了研究,然而有关与SQR相互作用的上下游分子的研究,目前尚未见报道。
单环刺 (Urechis unicinctus),俗称海肠子,隶属于 虫动物门(Echiuroidea),刺 属(Urechis),为东亚地区沿海泥沙岸潮间带下区及潮下带浅水区中生存的底栖生物[7]。对于单环刺 硫代谢相关领域的研究,目前已在组织细胞学特性[8]、体腔液中血红素的组成[9]以及呼吸代谢酶活性[10]等方面有了报道。本研究使用本实验室已体外原核表达并获得的具有活性的带有六聚组氨酸标签的单环刺 6His-SQR,采用His-pulldown技术和毛细管液相色谱-离子肼质谱技术,筛选和初步定性了与单环刺 SQR相互作用的蛋白质,为深入探讨单环刺 硫化物代谢机制提供研究资料。
1 材料与方法
1.1 材料
单环刺 购自青岛市四方路海产品市场;Escherichia coliBL21(DE3)菌株、pET-28a载体均由本实验室保存; Ni2+-NTA His-Bind Resins购自Novagen公司; 辅酶Q2购自Sigma公司; 色谱级乙腈(acetonitrile)、甲酸购自美国 Fisher公司; 测序级胰蛋白酶(Trypsin)购自美国Roche公司; 其余试剂均为国产分析纯以上。
1.2 方法
1.2.1 单环刺 6His-SQR的诱导表达及纯化
含单环刺sqr全长cDNA的阳性菌株在含卡纳霉素(30 mg/L)的 LB培养基中加入诱导剂异丙基硫代-β-D-半乳糖苷(Isopropyl-β-D-thiogalactopyr,IPTG)至终浓度1 mmol/L,37 ℃,诱导表达5 h后,4 ℃,2 655g离心10 min收集菌体,用20 mL PBS重悬,在冰浴中超声破碎,直到溶液变澄清。于4 ℃、15 294g离心10 min,收集沉淀即得包涵体形式的6His- SQR。
取包涵体溶于变性液(8 mol/L 尿素,10 mmol/L Tris-HCl(pH 8.0),0.1 mol/L 磷酸钠,1 mmol/Lβ-巯基乙醇)中,4 ℃溶解过夜,离心收集上清。透析去除β-巯基乙醇,用Ni2+-NTA纯化6His-SQR蛋白,收集洗脱液。SDS-PAGE分析鉴定洗脱液蛋白组分。Brandford法检测蛋白含量后,-20 ℃保存备用。
1.2.2 单环刺 6His-SQR复性及酶活测定
4℃下,将蛋白洗脱液滴加至复性缓冲液(20 mmol/L Tris-HCl(pH 8.0),5 mmol/L 还原型谷胱甘肽(Reduced glutathione,GSH),0.5 mmol/L 氧化型谷胱甘肽(Oxidized glutathione,GSSG),0.4 mol/LL-精氨酸,1 mmol/L 苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF),蛋白浓度50 mg/L)中,静置24 h使之充分复性。然后15 294g离心20 min,上清液中可溶蛋白组分即为复性成功的蛋白。Brandford法检测可溶组分的蛋白含量。
室温下,0.3 mL反应液中依次加入 0.02 mol/L Tris(pH 8.0),100 µmol/L 辅酶 Q2,0.5 µg SQR,400µmol/L硫化物(使用液氮新鲜处理的水配制)。硫化物加入后开始计时,记录3 min内辅酶 Q2在OD285nm的降低值[5,6]。SQR 比活值(µmol/(min·mg))=∆OD285×A/(B×C×D)。公式中A为反应液总体积0.3 mL,B为1 µmol 辅酶Q2的摩尔消光系数0.00885,C为SQR量0.5 µg,D为反应时间3 min。酶活测定重复3次。
1.2.3 透析法浓缩复性后的单环刺 6His-SQR蛋白
将稀释复性后的蛋白液放入透析袋内,将聚乙二醇8 000(Polyethylene Glycol 8000,PEG8000)均匀撒在透析袋外,4℃放置。待PEG完全吸水变为黄色时,再次在透析袋外均匀洒上 PEG,直至 6His-SQR浓缩至浓度为1 g/L。采用1.2.2的方法检测浓缩后蛋白的酶活性。
1.2.4 His-pulldown实验
根据预实验结果,取复性蛋白(1 g/L)与 Ni2+-NTA 树脂,于 4℃下缓慢旋转结合 1 h,将结合有SQR的树脂 4℃放置备用; 解剖取单环刺 体壁组织,用细胞裂解液(50 mmol/L Tris,0.15 mol/L NaCl,0.1%(m/v)SDS,0.75%(v/v)NP-40,1 mmol/L EGTA,0.5%(m/v) 脱氧胆酸钠,100 mg/L PMSF)冰上匀浆,4 ℃ 12 000g离心10 min得上清蛋白液,Branford法测定蛋白浓度后,储存于冰箱中备用。取单环刺 体壁组织细胞裂解液与结合有单环刺 6His-SQR的Ni2+-NTA树脂,于4℃下缓慢旋转结合1 h,收集过柱流出液,用 Bindbuffer,WashbufferⅠ,Ⅱ,Elution buffer依次洗脱树脂,并分别收集过柱流出液,所得流出液进行12% SDS-PAGE分析。
1.2.5 质谱分析
将上述分离的蛋白质条带从凝胶上切割下来,置于1.5 mL Eppendorf管中,用脱色液(50%(v/v)乙腈和 25 mmol/L NH3HCO3溶液,按照1:1混合)在涡旋混合器上震荡约30 min(37℃),倒掉脱色液,然后重复上述操作直至蓝色完全褪净。经乙腈脱水后,置于真空干燥机内干燥至胶粒跳起(约 20 min),50µL 0.1g/L的胰蛋白酶液4℃放置15 min吸胀胶块后,吸出多余胰酶,加入50 µL 25 mmol/ L的NH4HCO3溶液保湿,37℃酶解18 h。离心收集酶解后的上清液,加入10 µL 50%乙腈和2.5%(v/v)三氟乙酸(trifluoroacetic acid,TFA)的混合液30℃放置1 h后萃取上清液,重复 1次,收集合并酶解液; 将合并得到的酶解液体冷冻干燥后,采用毛细管液相色谱-离子肼质谱仪(Thermo Finnigan,San Jose,CA,USA)进行质谱分析[11,12]。用Bioworks software和SEQUEST软件采集质谱数据并进行数据分析。
2 结果
2.1 单环刺 6His-SQR体外表达蛋白的纯化
体外重组的 pET28a-SQR/BL21(DE3)菌,在 1.0 mmol/L IPTG诱导5 h后获得表达产物,经Ni2+-NTA柱纯化后,得到目的蛋白,分子质量约为 50 ku,与预期的SQR蛋白大小一致(图1)。
2.2 His-pulldown实验
通过稀释法复性单环刺 6His-SQR蛋白,并按照 1.2.2的方法测得该酶的比活值为 5.04 µmol/(min·mg)。通过预实验确定了使1mLNi2+-NTA树脂饱和结合单环刺 6His-SQR的蛋白量为3mg。图2中泳道2和3分别为单环刺 6His-SQR与Ni2+-NTA树脂结合前后的电泳结果,显示Ni2+-NTA树脂上已成功结合6His-SQR蛋白; 通过Bindbuffer平衡树脂后,使用 pH顺次降低的 washbuffer将结合在Ni2+-NTA树脂上的非特异性蛋白质洗脱下来,最后使用Elution buffer将特异性结合在Ni2+-NTA树脂上的SQR及与SQR结合的蛋白(条带A和B)一起洗脱下来(图2泳道9),条带A和B为单环刺 组织细胞裂解液中可能存在的两个与 SQR结合的蛋白质,它们的分子质量约为60 ku和40 ku(图2)。

图1 单环刺 6His-SQR重组蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of the U.unicinctus SQR recombinant protein
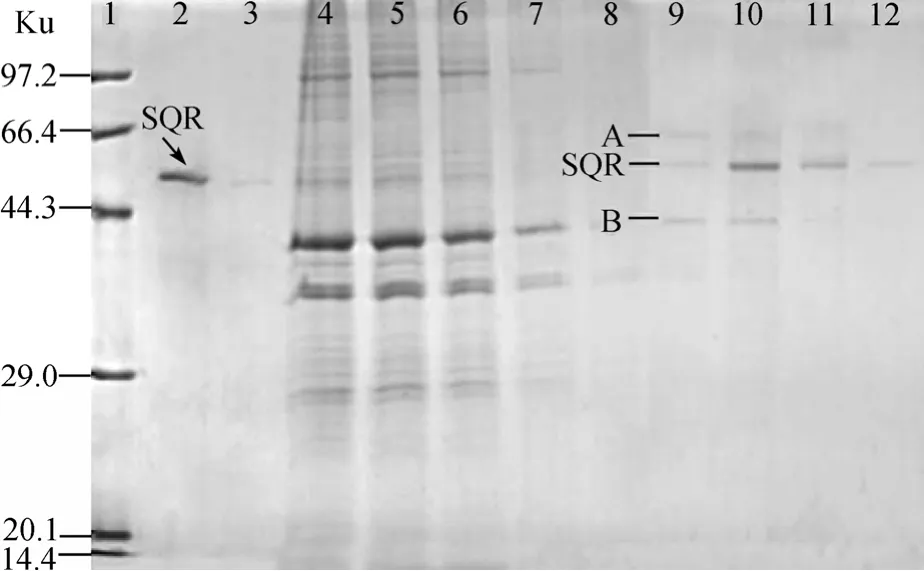
图2 单环刺 SQR His-pulldown分析Fig.2 SDS-PAGE analysis of the U.unicinctus SQR His-pulldown result
2.3 质谱分析
His-pulldown实验所得的两个蛋白条带,经质谱分析,初步确定其为:细胞色素 P450和腺苷三磷酸结合盒转运蛋白(表1)。

表1 与6His-SQR重组蛋白相互作用蛋白的毛细管液相色谱-离子肼质谱分析Tab.1 Ion-trap Mass spectrometer analysis of proteins interacting with the recombinant 6His-SQR protein
3 讨论
生物体的大部分生命活动发生在蛋白质水平,虽然有一些蛋白质可以以单体的形式发挥作用,但大部分蛋白质都是和伴侣分子一起作用或是与其他蛋白质形成复合物来发挥作用的。因此,研究蛋白质相互作用是更好地理解生物的各种生命活动的重要手段之一。本实验选择适宜大分子量蛋白质的六聚组氨酸作为标签,构建了单环刺 SQR六聚组氨酸蛋白,并以此为饵蛋白,采用His-pulldown技术,从单环刺 体壁组织液中钓取了两个与该蛋白相互作用的蛋白质。为了消除假阳性对实验结果的干扰,我们确定了Ni2+-NTA树脂与单环刺 6His-SQR结合的饱和度,从而有效地避免了实验的假阳性问题。
相对于整个蛋白质表面而言,蛋白质间相互作用位点上含有大量的输水氨基酸残基,因此有人认为两个蛋白质的结合可能来自于输水性表面区域的包埋。通常,接触面中的 Leu、Ile、Val、Phe、Tyr和Met含量丰富[13,14]。本研究通过对pulldown钓取的两个蛋白质的质谱分析,初步定性它们为细胞色素P450和腺苷三磷酸结合盒转运蛋白。已知细胞色素P450主要定位在内质网膜和线粒体膜上[15],并且根据该蛋白的三维结构分析[16],其分子表面露出的氨基酸残基含有Phe和Leu等疏水性氨基酸残基,据此推测细胞色素P450可能与 SQR表面的疏水性氨基酸残基通过疏水键相互结合。再有,细胞色素P450在真核生物中具有(1)单加氧酶活性:使烷基碳羟化和芳香环环氧化、烷氧基的去烷基等; (2)氧化酶活性:使芳香环羟基化、苯二酚氧化成醌等; (3)还原酶活性:使偶氮化物还原性裂解为两分子胺、使硝基还原为氨基、使醌还原成半醌、使卤代烃脱卤素等[17]。由此推测二者的相互作用可能在硫化物的氧化半反应中起到电子传递的作用。腺苷三磷酸结合盒转运蛋白超家族是一组跨膜蛋白,具有 ATP结合区域的单向底物转运泵,以主动转运的方式完成多种分子的跨膜转运,该蛋白的核心结构包括核苷酸结合域和跨膜结构域,这种跨膜结构域是高度疏水的[18,19],因而推测该蛋白可能通过该结构域与 SQR形成疏水性相互作用,据此推测该蛋白在硫化物解毒的过程中可能具有将酶反应过程中产生的代谢物质转运到线粒体外的作用。上述推测需要进一步的研究加以证明。
致谢:感谢中国科学院实验海洋生物学重点实验室的肖鹏老师在质谱实验中给予的帮助。
[1]Nicholls P.The effect of sulfide on cytochrome aa3.Isosteric and allosteric shifts of the reduced a-peak[J].Biochim Biophys Acta,1975,396:24-35.
[2]Völkel S,Grieshaber M K.Sulphide oxidation and oxidative phosphorylation in the mitochondria of the lugwormArenicola marina[J].J Exp Biol,1997,200:83-92.
[3]Arieli B,Padan E,Shahak Y.Sulfide-induced sulfide-quinone reductase activity in thylakoids ofOscillatoria limnetica[J].J Biol Chem,1991,266:104-111.
[4]Schüetz M C,Klughammer C G,et al.Sulfide-quinone reductase activity in membranes of the chemotrophic bacteriumParacoccus denitrificansGB17[J].Arch Microbiol,1998,170:353-360.
[5]Vande Weghe J G,Ow D W.A fission yeast gene for mitochondrial sulfide oxidation[J].J Biol Chem,1999,274:13 250-13 257.
[6]Theisse U,Martin W.Sulfide:quinone oxidoreductase(SQR) from the lugwormArenicola marinashows cyanide-and thioredoxin-dependent activity[J].FEBS J,2008,275:1 131-1 139.
[7]李凤鲁,王玮,周红.黄渤海 虫动物( 虫动物门)的研究[J].青岛海洋大学学报,1994,24(2):203-210.
[8]Zhang Z F,Shao M Y,Kang K H,et al.Studies on the tolerating mechanism for sulfide inUrechis unicinctus(Echiura:Urechidae)—cytological observation onUrechis unicinctusin different hydrogen sulfide environment [J].Chin J Oceanol Limnol,2003,21(1):86-90.
[9]Ma Z J,Bao Z M,Zhang Z F,et al.The changes of three components in coelomic fluid ofUrechis unicinctusexposed to different concentrations of sulfide [J].Chin J Oceanol Limnol,2005,23(1):104-109.
[10]张志峰,王思锋,霍继革,等.单环刺 对硫化物暴露的呼吸代谢适应[J].中国海洋大学学报,2006,36(4):639-644.
[11]齐小城,章弘扬,梁琼麟,等.液质联用技术及其在代谢组学研究中的应用[J].中成药 2009,31(1):106-112.
[12]Greenbaum D,Baruch A,Hayrapetian L,et al.Chemical approaches for functionally probing the proteome[J].Mol Cell Proteomic,2002,1(60):60-68.
[13]李永勤,王胜军,李志杰,等.预测蛋白质相互作用位点的计算方法研究(一)[J].中国医学物理学杂志,2006,5(23):345-350.
[14]Lijnzaad P,Argos P.Hydrophobic patches on protein subunit interfaces:characteristics and prediction[J].Proteins,1997,28:333-343
[15]赵博,王中伟.细胞色素 P450的研究进展 [J].山东农业大学学报(自然科学版),2004,35(1):142-144.
[16]Dai R,Pincus M R,Friedman F K.Molecular modeling of Cytochrome P450 2B1:Mode of membrane insertion substrate specificity[J].Journal of Protein Chemistry,1998,17(2):121-129.
[17]王夔.生命科学中的微量元素[M].第二版.北京:中国计量出版社,1996.279-284.
[18]王华丙,张振义,包锐,等.ABC转运蛋白的结构与转运机制[J].生命的化学,2007,27(3):208-210.
[19]Elie D,Bouige P.The ABC of ABCs:a phylogenetic and functional classi fi cation of ABC systems in living organisms [J].Res Microbiol,2001,152:211-229.

