光照强度对孔石莼生长和藻体化学组成的影响
王巧晗,董双林,田相利,王 芳,董云伟,张 凯
(中国海洋大学 教育部海水养殖重点实验室,山东 青岛 266003)
光是植物赖以生存的能量来源。光照强度对植物的生长、光合作用和物质代谢均有调控作用[1]。在对高等植物的研究中发现,适当的光照强度能够促进植物细胞的分裂、组织器官的分化、花芽的增加和果实的成熟[2]。在水生植物光生态的研究中发现,光照强度是造成单细胞藻类种群变动和生化组成变化的主要因素[3],并能调节单细胞藻类在水层中的垂直移动[4]。单细胞藻类经历光照条件短期恶化后恢复正常光照,其生长和生化组成会出现超补偿生长现象[5,6]。同时,光照强度也能改变潮间带海藻的形态[7,8],调节大型海藻在潮间带的分布位置[9],是海藻幼体发育和生活史完成的关键环境因子之一[10]。
海洋植物不仅能够将水中的陆源无机物(主要是N、P)转化为有机物、贮存能量,并且,藻类能够为生态系统中消费者和分解者提供适宜的环境,并对海洋生物修复作用具有积极意义[11]。孔石莼(Ulva pertusa)是我国分布较广的一种绿藻,在适宜的季节通常能够成为潮间带的优势种海藻。在孔石莼营养动力学和克生生物学的研究中发现,这种绿藻不仅可以快速地吸收水体中的营养盐,而且可以有效地抑制有害单细胞藻类的发生[12~16],提高养殖产品的产量、存活率和饵料系数[17]。
光对孔石莼生理生态学影响的研究,仅见于光照强度与孔石莼光合作用速率之间的关系[18],光照强度对孔石莼生物量积累的调节、以及不同光照强度对孔石莼藻体化学组成的影响尚未见系统的研究。作者通过对较大光照强度范围内潮间带无性繁殖系孔石莼生长和藻体化学组成的研究,以期为潮间带海藻对多变光照条件的适应机制提供基础数据,并为无性系孔石莼的利用提供理论依据。
1 材料和方法
1.1 材料
孔石莼(U.pertusa)由日本东北大学的Akira Taniguchi 教授提供。
1.2 实验前预培养条件
实验前将孔石莼培养于无菌环境中[19],培养温度为 20 ℃,盐度为 30.0,光暗周期为 12 h:12 h(L:D),光照强度为10 000 lx。
实验用海水经过脱脂棉和三层筛绢过滤后煮沸。海水的 pH 值和盐度分别调节至 8.3~8.5和30.0±0.1。
1.3 实验设计和培养条件
用面积为1.42 mm2的打孔器选取健康、靠近叶片边缘、分生速度快的由同一片藻培养获得的圆形叶片。为减少叶片损伤对实验的影响,实验前将叶片在20 ℃、200 µmol/(m2·s)下暂养 24 h 以上随机选入各处理组。实验中温度为20℃,光暗比L:D=12:12,用f/2营养液培养,每天全量更换培养液。实验共有8个处理,即 2 500、5 000、7 500、10 000、125 000、15 000、17 500、20 000 lx,每处理6重复,每重复置藻3片。
1.4 生长的测定
各处理持续培养12 d,每3天称量一次生物量,计算相对生长率(RSG),并测定藻叶片最终生物量,计算干湿比。相对生长率的计算公式如下:RSG=[ln(Wt/W0)t]×100%,其中W0为初始藻的鲜生物量(g),Wt为实验结束时藻的鲜质量(g),t为实验持续的时间(d)。
1.5 生化组成的测定
在实验的最后一天测定藻的叶绿素 a(Chl-a)和叶绿素 b(Chl-b)、游离脯氨酸(Pro)、蛋白质(P)和可溶性糖(C)的含量,并计算蛋白质/可溶性糖(P/C)的含量。叶绿素a采用丙酮萃取法[20]; 蛋白质采用考马斯亮蓝法测定,以牛血清白蛋白作为标准[21]; 可溶性糖采用蒽酮法测定,以蔗糖作为标准[22]; 游离脯氨酸采用茚三酮显色法,以 L-脯氨酸作为标准[23]。以上指标均以鲜物质测定。
1.6 化学成分的测定
于实验结束时对藻体干物质N、C、H元素含量,采用元素分析仪测定。
1.7 数据处理和统计学分析
实验数据用 SPSS11.0软件经单因素方差分析,结果差异显著后进行多重比较(Duncan)。以P<0.05作为显著标准。为了取得方差齐性和近于正态分布,百分数和比率经过反正弦转换后进行方差分析。
2 结果
2.1 光照强度对孔石莼生长的影响
从图1可见,在实验初始阶段(3 d),孔石莼的相对生长率具有随着光照强度的增加而增加的趋势,但在实验的第6天,光强超过17 500 lx时孔石莼的相对生长率却明显下降,直至实验结束时,其相对生长率一直维持在相对较低的水平。
光照强度高于17 500 lx时,实验超过6天后,藻体叶片的局部产生了色素变淡或色素缺失的现象,之后开始溃烂,并产生大小不等的溃斑。

图1 不同光照强度下孔石莼的相对生长率Fig.1 The relative growth rates (RSG) of U. pertusa at different light intensity
2.2 光照强度对孔石莼生化组成的影响
不同光照强度对孔石莼生化组成的影响见表 1。光照强度对孔石莼叶绿素a(Chl-a)、叶绿素b(Chl-b)、蛋白质(P)、可溶性糖(C)以及游离脯氨酸(Pro)的含量都有显著的影响(P<0.05)。叶绿素a和叶绿素b的含量都有随着光照强度的增加而减小的趋势。蛋白质含量在不同光照强度下变化不明显(P>0.05),但也有随着光强增加而减小的趋势。可溶性糖的含量在12 500 lx以上时随着光照强度的增加而逐渐增高。游离脯氨酸的含量在12 500 lx以下随着光照强度的增加而减少,但当光照强度大于17 500 lx时,其含量显著增高。

表1 不同光照强度下孔石莼的生化组成Tab.1 Effects of different light intensity on the proximate biochemical composition of U. pertusa
2.3 光照强度对孔石莼化学组成的影响
光照强度对孔石莼化学组成的影响见图2、图3和图4。从图中可见光照强度在2 500~15 000 lx范围内,随着光照强度的升高,藻体的 N元素含量有所升高,但光强达到17 500 lx后,随着光强的增加,N元素含量反而降低; C元素的含量在2 500~15 000 lx范围内变化不明显,但当光照强度达到17 500 lx后,C元素的含量明显升高; H元素的含量在 2 500~20 000 lx范围内,具有随着光照强度增加而增加的趋势。

图2 光照强度对孔石莼N元素含量的影响Fig.2 Effects of different light intensity on nitrogen of U.pertusa

图3 光照强度对孔石莼C元素含量的影响Fig.3 Effects of different light intensity on carbon of U.pertusa
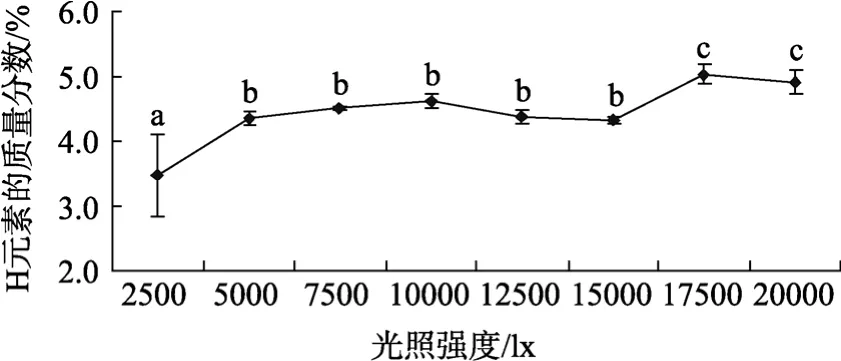
图4 光照强度对孔石莼H元素含量的影响Fig.4 Effects of different light intensity on hydrogen of U.pertusa
3 讨论
本实验结果表明,光照强度对孔石莼的生长具有显著影响(图1)。孔石莼能够在2 500~15 000 lx光强范围内生长,在10 000~15 000 lx范围内孔石莼的相对生长率显著高于其余各处理。
总的来看,孔石莼能够适应的光照强度范围比较广,这可能与其所处的生态环境密切相关。潮间带的光照强度变化剧烈而复杂,因此生活在潮间带的海藻,在经历光照大幅度变化过程中,对光的适应性也变得更强,其生理生态学特征也向更利于适应光照强度多变的方向发展。但是过低或过高的光照强度能够抑制孔石莼的生长,甚至破坏其光系统、产生细胞防御物质。本实验中,光照强度低于5 000 lx时,孔石莼的相对生长率明显降低。在较低光照强度范围内随着光照强度的降低藻体叶绿素的含量反而增加,这种现象在其他海藻中也普遍存在,各学者将叶绿素增加的原因归于海藻对低光强的适应,即在较低光照强度下,海藻通过补偿性的增加光合色素来弥补光照不足而引起的光能利用率低和生长缓慢等问题[24],同时有的学者认为这种反应受到了光敏色素的诱导[25]。当光照强度过强,超过17 500 lx时,孔石莼的生长同样受到阻碍,并且在实验进行到第6天时,17 500 lx和20000 lx处理组藻体开始溃烂,产生了大小不等的溃斑,光强越强则溃烂情况越严重,且这两个处理的植物防御物质游离脯氨酸的含量明显增加(P<0.05),看来,过高的光照强度对藻体产生了一定的伤害,对藻体产生了光抑制。
光照与水生植物生长和生化组成的关系一直受到很多学者的重视。对单细胞藻类的研究中发现:在一定的光照强度范围内,单胞藻具有随着光强的提高而碳水化合物含量增加、蛋白质含量下降的趋势[24,27]。本研究发现,光强在15 000 lx以下时孔石莼蛋白质的含量也有随着光强而减小的趋势,但是可溶性糖含量的变化趋势却不明显。
大型海藻组织中的氮库主要由无机氮库、蛋白质氮库和非蛋白质类可溶性氮库(叶绿素等)组成[28]。本文中氮元素含量的变化趋势与可溶性蛋白质和叶绿素含量的变化趋势恰好相反,因此推断氮元素含量的变化与可溶性蛋白质和叶绿素含量变化的关系不大,可能主要来自于无机氮库的变化。在光照强度为15 000 lx以下时,孔石莼体内氮元素的含量有随着光照强度的增加而增加的趋势,当光强超过15 000 lx时,氮元素的含量逐渐降低,这种趋势同孔石莼的生物量积累的趋势也比较吻合,从而进一步证明了适宜的光照条件更有利于孔石莼对无机氮的吸收。同时,光照强度对孔石莼无机氮库的影响,仍然需要不同光照强度下孔石莼营养吸收动力学的研究来提供更为直接的理论依据。
[1]Korbee N,Figueroa F,Aguilera J.Effect of light quality on the accumulation of photosynthetic pigments,proteins and mycosporine-like amino acids in the red algaPorphyra leucosticte(Bangiales,Phodophyta) [J].Journal of Photochemistry and Photobiology B:Bilolgy,2005,80:71-78.
[2]Küster A,Schaible F,Schubert H.Light acclimation of photosynthesis in three charophyte species[J].Aquatic Botany,2004,79:111-124.
[3]庄树宏,Sven H.光强和光质对底栖藻类群落影响Ⅱ.群落和种群的动态和适应模式[J].生态学报,2001,21:2057-2066.
[4]Duarte P.A mechanistic model of the effects of light and temperature on algal primary productivity[J].Ecological Modelling,1995,82:151-160.
[5]刘宁宁,段舜山.蛋白核小球藻在光胁迫下的超补偿现象[J].生态科学,2002,21:053-054.
[6]郭羽丰,段舜山,李爱芬,等.四裂藻在光限制胁迫下的超补偿生长响应[J].生态科学,23:5-8.
[7]Davison I R,Pearson G A.Stress tolerance in intertidal seaweeds[J].Journal of Phycology,1996,32:197-211.
[8]Darley W M.Algae Biology:a physiological approach(basic microbiology Volume 9) [M].Oxford London Edinburgh,Boston Melbourne:Blackwell Scientific Publications,1982.92-98.
[9]Breeman A M,Gerbaud A.Ecology and distribution of the subtidal red algaAcrosymphyton purpuriferum(J.AG.) Sjöst.(Rhodophyceae,Cryptonemiales) [J].Aquatic Botany,11:143-146.
[10]王伟,林均民,金德祥.藻类的光控发育[J].植物学通报,1998,15:31-39.
[11]Hanisak M D.The nitrogen relationships of marine macroalgae [A].Carpenter E J,Capone D G.Nitrogen in the Marine Environment [C].Cambridge:AcademicPress Inc.,1983.
[12]Liu Jingwen,Dong Shuanglin.Comparative studies on utilizing nitrogen capacity between two macroalgaeGracilaria tenuistipitataVar.Liui(Rhodophyta) andUlva pertusa(Chlorophyta):Ⅰ.Nitrogen storage under nitrogen enrichment and starvation[J]. Journal of Environmental Sciences,2001,13:318-322.
[13]Liu Jingwen,Dong Shuanglin.Comparative studies on utilizing nitrogen capacity between two macroalgaeGracilaria tenuistipitataVar.Liui(Rhodophyta) andUlva pertusa(Chlorophyta):Ⅱ.Feedback control of intracellular nitrogen pools on nitrogen uptake[J].Journal of Environmental Sciences,2001,13:323-327.
[14]Liu Jingwen,Dong Shuanglin,Liu Xiaoyun,Ma Shen.Response of macroalgaeGracilaria tenuistipitatavar.liui(Rhodophyta) to iron stress[J].Journal of Applied Phycology,2000,12:605-612.
[15]Jin Qiu,Dong Shuanglin.Comparative studies on the allelopathic effects of two different strains ofUlva pertusaonHeterosigma akashiwoandAlexandrium tamarense[J].Journal of Experimental Marine Biol-ogy and Ecology,2003,293:41-55.
[16]Jin Qiu,Dong Shuanglin,Wang Changyun.Allelopathic growth inhibition ofProrocentrum micans(Dinophyta) byUlva pertusaandUlva linza(Chlorophyta)in laboratory cultures[J].European Journal of Phycology,2005,40:31-37.
[17]王吉桥,靳翠丽,张欣,等.不同密度的石莼与中国对虾的混养实验[J].水产学报,2001,25:32-37.
[18]刘长发,张泽宇,雷衍之.盐度、光照和营养盐对孔石莼光合作用的影响[J].生态学报,2001,21:795-798.
[19]Guillard R R L,Ryther J H.Studies on marine plankton diatoms:Ⅰ.Cyclotella nana(Hustedt) andDetonula confervaceae(Cleve) [J].Canadian Journal of Microbiology,1962,8:229-239.
[20]Jeffrey S W,Humphrey G F.New spectrophotometric equations for determining chlorophylls a,b,c1 and c2 in higher plants,algae,and natural phytoplankton[J].Biochem Physiol Pflanz BPP,1975,167:191-194.
[21]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principles of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[22]Yemm E W,Willis A J.The estimation of carbohydrates in plant extracts by anthrone[J].Biochemical Journal,1954,57:508-514.
[23]Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil,1973,39:205-207.
[24]刘静雯,董双林.光照和温度对细基江蓠繁枝变型的生长及生化组成的影响[J].青岛海洋大学学报,2001,31:332-338.
[25]Lopez-Figueroa F,Niell F X.Red-light and blue-light photoreceptors controlling chlorophyllasynthesis in the red algaPorphyra umbilicalis andin the green algaUlva rigida[J].Physiol Plant,1989,76:391-397.
[26]Harrison W C,Platt T,Lewis M R.F-ratio and its relationship to ambient nitrate concentration in coastal waters[J].Journal of Plankton Research,1987,9:235-248.
[27]李文权,黄贤芒.4种海洋单胞藻生化组成的环境因子效应研究[J].海洋学报,1999,21:59-65.
[28]McGlathery K J.Changes in intracellular nitrogen pools and feedback controls on nitrogen uptake inChaetomorpha linum[J].Journal of Phycology,1996,31:393-401.

