基因组步移技术扩增嗜水气单胞菌J-1株脂酶基因全长及原核表达*
巢 伟,刘永杰,陆承平
(南京农业大学 农业部动物疫病诊断与免疫重点实验室,江苏南京 210095)
基因组步移技术扩增嗜水气单胞菌J-1株脂酶基因全长及原核表达*
巢 伟,刘永杰,陆承平
(南京农业大学 农业部动物疫病诊断与免疫重点实验室,江苏南京 210095)
根据已发表的引物序列合成一对引物,以嗜水气单胞菌J-1株基因组为模板扩增脂酶基因,得到一个保守的383 bp基因片段。进一步应用基因组步移技术扩增其两侧未知序列,分别以DraⅠ,EcoRⅤ,PvuⅡ,ScaⅠ,StuⅠ,SmaⅠ6个内切酶酶切的基因组构建6个不同的基因组步移文库,再以基因组步移文库为模板,设计引物向已获得的保守片段两侧进行PCR扩增,将扩增到的两侧序列与保守片段拼接后得到一个3 476 bp的片段,通过DNA Star软件分析,找到一个2 415 bp的开放阅读框,经Blast软件分析,其与嗜水气单胞菌ATCC 7966脂酶、嗜水气单胞菌AH-3磷脂酶A1、嗜水气单胞菌H3脂酶、嗜水气单胞菌Mcc-2脂酶、嗜水气单胞菌JMP636磷脂酶C的序列同源性分别为97%、97%、88%、83%和82%。将DNA序列翻译成氨基酸序列后,发现其包含一个多肽序列(VHFLGHSLGA),这个序列在脂酶中高度保守。
嗜水气单胞菌;基因组步移;脂酶
嗜水气单胞菌(Aeromonas hydrophila,Ah)是淡水鱼暴发性败血症的主要病原[1-2],该菌能够引致淡水鱼的败血症和人的腹泻等[3]。嗜水气单胞菌能分泌一系列胞外酶,这些酶对该细菌的生态适应,生存及致病性起着十分关键的作用[4]。脂酶是嗜水气单胞菌胞外酶的一种,有资料表明脂酶有可能通过与人白细胞相互作用,或通过脂肪分解产生的脂肪酸影响免疫系统功能从而构成毒力因子[5]。本试验以嗜水气单胞菌我国分离鱼源株Ah J-1株为模版,应用基因组步移技术扩增脂酶基因全长,为进一步研究脂酶的功能奠定基础。
1 材料与方法
1.1 材料
嗜水气单胞菌(Aeromonas hydrophila,Ah)J-1株为陈怀青等从江苏某养殖场患细菌性败血症的病鱼中分离鉴定,由南京农业大学动物医学院微生物实验室保存。
DNA Fragment Purification Kit Ver.2.0,核酸内切酶DraⅠ,EcoRⅤ,PvuⅡ,ScaⅠ,StuⅠ,SmaI,LATaq酶,T4 DNA Ligase,Agarose Gel DNA Purification Kit Ver.2.0,pMD 18-T Vector均为宝生物工程(大连)有限公司产品。蛋白纯化试剂盒HisTrapTMHP为GE Healthcare公司产品。
1.2 方法
1.2.1 细菌基因组提取 取1 L过夜培养的Ah J-1株菌液7 000 r/min离心,参照文献[6]提取Ah J-1株基因组。
1.2.2 脂酶基因保守片段的扩增 参照文献[7]提供的引物序列扩增嗜水气单胞菌J-1株脂酶基因保守片段,引物序列如下:LipF:5′-ATCTTCTCCGACTGGT TCGG 3′;LipR:5′-CCGTGCCAGGACTGGGTCT T-3′。
引物合成在上海英骏生物技术有限公司完成。
PCR循环参数如下:94℃5 min;94℃25 s,55℃25 s,72℃30 s,30个循环;72℃10 min。
1.2.3 基因组步移技术扩增Ah J-1株脂酶基因
1.2.3.1 接头合成 walking adapter primer 1(W AP-1)(5′-GTAATACGACTCACTATAGGGCACGCGTGG TGGC-3′)和互补链 walking adapter primer 4(W AP-4)(5′-p-GCCACCACG-NH2-3′)由宝生物工程(大连)有限公司合成,并由该公司退火形成双链(即A-dapter)。
1.2.3.2 构建基因组步移文库 采用100 UDraⅠ,EcoRⅤ,PvuⅡ,ScaⅠ,StuⅠ,SmaⅠ分别酶切10 μg Ah J-1 株基因组 DNA,酶切时间 18 h,酶切体系100 μL。酶切后的基因组DNA采用宝生物工程(大连)有限公司DNA Fragment Purification Kit Ver 2.0分别回收。然后将酶切后的基因组DNA与接头连接,连接体系如下[8-9]:Adapter终浓度5 μ mol/L;酶切后的 Ah J-1 株基因组 DNA 0.5 μg,T4 DNA ligase 1 μL,10 × T4 buffer 2.5 μL,ddH2 O补至 25 μL,16 ℃连接过夜,然后90℃加热10 min灭活,-20℃保存。构建好6个不同的基因组步移文库,将它们分别命名为:DraⅠ文库,EcoRⅤ文库,PvuⅡ文库,ScaⅠ文库,StuⅠ文库,SmaⅠ文库。使用时,稀释4倍,取1 μL作PCR模板。1.2.3.3 基因组步移引物
正向基因组步移的引物
(walkerprimer1)WP-1:5′-GTAATACGACTCACTATAGGGC-3′;
(walker primer2)WP-2:5′-ACTATAGGGCACGCGTGGT-3′;
(specific primer 1)SP-1:5′-TGCCT TACT TCCTCGCCTCG-3′;
(specific inner primer 2)iSP-2:5′-GGGACAAGGCCAAGACCC-3′。
反向基因组步移的引物:
(walkerprimer1)WP-1:5′-GTAATACGACTCACTATAGGGC-3′;
(walker primer2)WP-2:5′-ACTATAGGGCACGCGTGGT-3′;
(reverse specific primer 1)rSP-1:5′-CCGTGCCAGGACTGGGTCT T-3′;
(reverse specific inner primer 2)riSP-2:5′-ATCCAGGGTCGGGCTCT T-3′。
引物合成在上海英骏生物技术有限公司完成。
1.2.3.4 正向基因组步移 以WP-1和SP-1为引物,6个构建好的基因组步移文库分别作为模板进行第一轮PCR扩增,循环参数为:94℃2 min;94℃25 s,72℃4 min,7个循环;94℃25 s,67℃4 min,32个循环;67℃10 min。扩增后PCR产物进行琼脂糖凝胶电泳。扩增出条带的PCR产物稀释10倍,取1 μL作为模板进行第二轮套式 PCR验证。套式PCR的引物为WP-2和iSP-2,PCR循环参数为:94℃5 min;94℃25 s,55℃25 s,72℃3 min,30个循环;72℃10 min。扩增后PCR产物进行琼脂糖凝胶电泳。
1.2.3.5 反向基因组步移 以WP-1和rSP-1为引物,6个构建好的基因组步移文库分别作为模板进行第一轮PCR扩增,循环参数同正向基因组步移的第一轮扩增参数。扩增后PCR产物进行琼脂糖凝胶电泳,扩增出条带的 PCR产物稀释10倍,取1 μL作为模板进行第二轮套式 PCR验证。套式PCR的引物为WP-2和riSP-2,PCR循环参数为:94℃5 min;94℃25 s,55℃25 s,72℃1 min,30个循环;72℃10 min。扩增后PCR产物进行琼脂糖凝胶电泳。
1.2.4 测序 将基因组步移扩增出的DNA片段与T载体连接,转化到E.coliTop10中,送上海英骏生物技术有限公司测序。
1.2.5 脂酶基因表达和表达产物纯化
1.2.5.1 脂酶基因原核表达载体的构建 以基因组步移获得的序列为模版,设计一对引物扩增脂酶基因全长,引物如下:
P1:5′-GATGAATTCATGAAAAGGAAGCTAATT-3′;EcoRⅠ
P2:5′-TTACTCGAGGACTGGCTTACTGCTTGAG-3′;XhoⅠ
PCR循环参数为:94℃5 min;94℃25 s,55℃25 s,72℃3 min,30个循环;72℃10 min。扩增后PCR产物进行琼脂糖凝胶电泳,并切胶回收。然后,用EcoRⅠ,XhoⅠ双酶切PCR产物,回收酶切后的PCR产物。
用质粒提取试剂盒提取质粒pET-32a(+),EcoRⅠ,XhoⅠ双酶切pET-32a(+),酶切产物进行琼脂糖凝胶电泳,并切胶回收。
用T4连接酶连接双酶切后的PCR产物和pET-32a(+),转化到E.coliTop10中,挑取单克隆培养,PCR检测阳性克隆。再提取阳性克隆的重组质粒pET-32a-Lip转化到E.coliBL21中,PCR检测阳性克隆,并提取阳性克隆中重组质粒送上海英骏生物技术有限公司测序。
1.2.5.2 融合蛋白诱导表达 将含重组质粒pET-32a-Lip的E.coliBL21接种于含Amp的LB培养基中,37℃震荡培养至OD600值约0.5时,诱导前取出1.5 mL菌液,然后加入终浓度为1 mmol/L的IPTG诱导表达,分别于诱导后1 h,3 h,5 h各取1.5 mL菌液。将这四个时间点取出的菌液12 000 r/min离心1 min,全菌进行SDS-PAGE检测,同时设含pET-32a(+)空载体的E.coliBL21诱导5 h后的全菌做对照。
1.2.5.3 融合蛋白纯化 将含重组质粒pET-32a-Lip的E.coliBL21接种于2 L含Amp的LB液体培养基中,37℃震荡培养至OD600值约0.5时加入终浓度为1 mmol/L的IPTG诱导表达4 h,4℃,8 000 r/min离心 15 min,弃去上清,沉淀用PBS重悬,400 Hz,超声 5 s,间隔10 s,超声 80次,在4 ℃以8 000 r/min离心分别收集沉淀和上清,沉淀用Binding buffer溶解,沉淀和上清分别取样进行SDS-PAGE分析。
使用蛋白纯化试剂盒HisT rapTMHP纯化[10-11]融合蛋白,融合蛋白活性检测参照文献[12]中的方法略有改动,取10 μL纯化融合蛋白滴在三丁酸甘油酯平板上,37℃温箱放置过夜后观察三丁酸甘油酯是否被分解,同时设含 pET-32a(+)空载体的E.coliBL21超声裂解后的上清作为对照。
2 结果
2.1 脂酶基因保守片段扩增
以Ah J-1株基因组为模板,LipF和LipR为引物进行PCR,得到一个383 bp的片段(图1)。测序后,经Blast比对,它与嗜水气单胞菌AH-3磷脂酶A1、嗜水气单胞菌ATCC 51108脂酶、嗜水气单胞菌H3脂酶基因同源性分别为97%、90%、88%。

图1 脂酶基因保守片段扩增Fig.1 PCR amplification of a conserved fragment in lipase gene
2.2 正向基因组步移
正向基因组步移的结果(图2),以PvuⅡ、SmaⅠ这两个文库为模板,在第一轮和第二轮都扩增出条带。从图中可以看出,PvuⅡ文库做模板时,扩增效果最好,所以取以其为模板时,第二轮扩增出的条带进行测序。
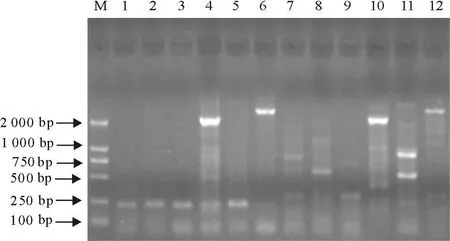
图2 正向基因组步移扩增结果电泳图Fig.2 PCR amplification products in forward genome walking
2.3 反向基因组步移
反向基因组步移的结果,第一轮(图3),第二轮扩增(图4),以PvuⅡ文库,SmaⅠ文库分别做为模板时,都扩增出条带,但前一个文库扩增条带较大,所以取其第二轮扩增出的条带测序。
2.4 序列分析
正向与反向基因组步移各得到一个片段,经测序后,大小分别为2 374 bp和1 079 bp。将这两个片段与 383 bp的保守片段拼接起来,得到一个3 476 bp(GenBank ACCESSION:EF522105)的片段,通过DNA Star软件分析,找到一个 2 415 bp的开放阅读框。Blast软件分析,该开放阅读框与嗜水气单胞菌ATCC 7966脂酶、嗜水气单胞菌AH-3磷脂酶A1、嗜水气单胞菌 H3脂酶、嗜水气单胞菌Mcc-2脂酶、嗜水气单胞菌JMP636磷脂酶C的序列同源性分别为97%、97%、88%、83%和 82%。在起始密码子ATG上游7个碱基处有一个公认的SD序列—AAGAGA。该开放阅读框编码一个804氨基酸的蛋白,预测分子质量为82.5 ku。通过对这个蛋白的氨基酸序列分析发现,它含有一个氨基酸序列-VHFLGHSLGA,这个序列在脂酶中高度保守,与脂酶底物结合相关[12]。第1~17位氨基酸是一个公认的脂蛋白信号肽序列,并且第17位和18位氨基酸之间是一个公认的脂蛋白信号肽酶切位点[13]。另外一个公认的信号肽酶切位点位于第48位和49位氨基酸之间[12]。
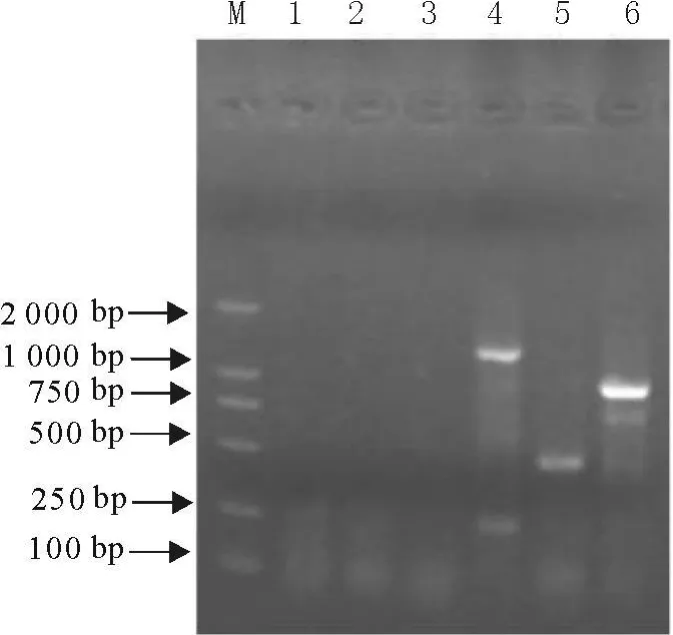
图3 反向基因组步移扩增结果电泳图(第1轮PCR扩增)Fig.3 PCR amplification products in reverse genome walking(first PCR products)

图4 反向基因组步移扩增结果电泳图(第2轮PCR扩增)Fig.4 PCR amplification products in reverse genome walking(second PCR products)
2.5 脂酶基因全长扩增
以Ah J-1株基因组为模板,P1和P2为引物进行PCR扩增出脂酶基因全长(图5),大小与预期的2 440 bp相符。
2.6 重组质粒PCR鉴定
以E.coliBL21阳性克隆中重组质粒为模板,P1和P2为引物进行PCR扩增(图6),扩增片段与2 440 bp的插入片段大小相符。

图5 脂酶基因全长扩增Fig.5 PCR amplification of the complete lipase gene
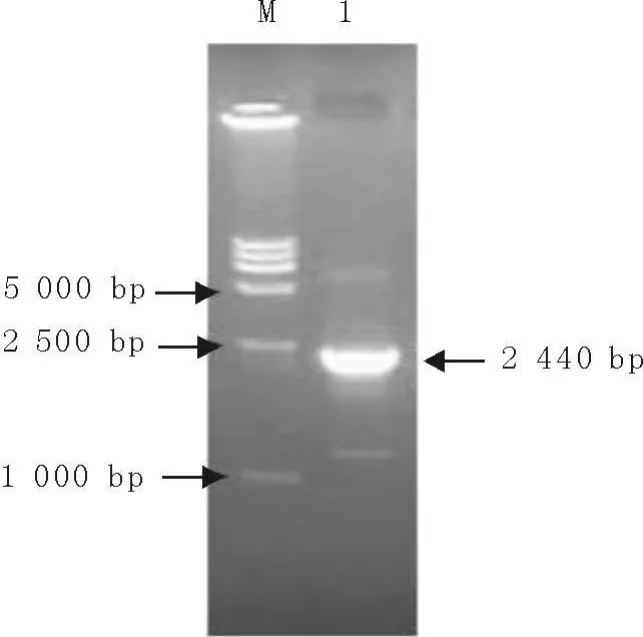
图6 重组质粒PCR鉴定Fig.6 Identification of the recombinant plasmid by PCR
2.7 重组质粒测序
重组质粒测序结果经DNA Star软件分析表明插入序列完全正确。
2.8 融合蛋白诱导表达及纯化
诱导前和诱导后1、3、5 h的全菌SDS-PAGE结果表明,诱导后3 h蛋白表达量达到最大(图7)。融合蛋白经蛋白纯化试剂盒HisT rapTMHP纯化后在分子质量约82.5 ku处得到单一条带(图8)。经检测,纯化融合蛋白可以分解三丁酸甘油酯,而作为对照,含pET-32a(+)空载体的E.coliBL21超声裂解后上清不能分解。

图7 SDS-PAGE检测诱导表达产物Fig.7 SDS-PAGE analysis of expression products

图8 纯化融合蛋白SDS-PAGE分析Fig.8 SDS-PAGE analysis of the purified fusion protein
3 讨论
国外有学者对嗜水气单胞菌不同分离株脂酶基因进行克隆、表达和分析,尽管分子大小不同,但大多都能分解酯类和三酰基甘油类,如对硝基苯丁酸盐和三丁酸甘油酯。并且发现嗜水气单胞菌AH-3磷脂酶C具有细胞毒性,磷脂酶C缺失株比野毒株毒性减弱,说明它是一个重要的毒力因子[13]。我国的鱼源代表株Ah J-1株,与国外分离株相比,可以确定其脂酶[14-15]能分解三丁酸甘油酯,但脂酶的其他理化特性是否相似,脂酶与细菌的营养摄取,致病机制,生态适应有何关系,尚不得而知。下一步重点将对脂酶特性和功能进行研究。
要获取基因组上已知序列两侧的未知序列,通过探针筛选DNA文库是实验室常用的方法。但这一方法费时费力,而近年来出现的基因组步移技术简单、可靠,是一种建立在PCR基础上的获取侧翼序列的有效方法[16]。国外很多学者应用该技术获得了一些重要的未知序列。如Leung K Y等[17]应用基因组步移在嗜水气单胞菌PPD134/91上扩增出一个23 kb毒力相关片段,而国内研究较少。本研究应用基因组步移技术,成功获得了Ah J-1株脂酶基因全序列。为减少PCR的非特异性扩增,本文基因组步移技术采用了两个特殊的设计。首先,接头是一个部分双股的DNA短序列,且短链的3′端被氨基封闭。WP-1是与接头互补的引物,而在酶切片段的两端都有接头,那么必然会有非特异性PCR扩增。但是接头上的特殊设计避免了这一缺点,WP-1是与接头上缺失的那部分单链互补的,在第一轮PCR的第一个循环时,由于短链的3′端被氨基封闭,阻止了DNA聚合酶的延伸,所以WP-1并没有结合位点。然而根据已知序列设计的引物SP-1可以扩增出一条单链,当这条单链延伸到接头位置时,就产生了WP-1的结合位点。因此,酶切片段中没有SP-1的结合位点,PCR扩增就不能进行。其次,套式PCR验证。当SP-1发生非特异性结合时,必然扩增出错误的序列,通过在接头和已知序列上设计套式引物进行PCR扩增验证,这样就可以保证得到正确的结果。
[1]Suarez G,Sierra J C,Sha J,et al.Molecular characterization of a functional type VI secretion system from a clinical isolate of aeromonas hydrophila[J].Microb Pathog,2008,44(4):344-361.
[2]Canals R,Jiménez N,Vilches S,et al.Role of Gne and GalE in the virulence ofAeromonas hydrophilaserotype O34[J].Antimicrob Agents Chemother,2008,52(4):1559-1563.
[3]陆承平.致病性嗜水气单胞菌及其所致鱼病综述[J].水产学报,1992,16(3):282-288.
[4]Pemberton J M,Kidd S P.Secreted enzymes of aeromonas[J].FEMS Microbiol letters,1997,152:1-10.
[5]Eftimiadi C,Buzzi E,Tonetti M,et al.Short-chain fatty acids produced by anaerobic bacteria alter the phy siological responses of human neutrophils to chemotactic peptides[J].J Infect,1987,14:43-53.
[6]Rishi A S,Nelson N D,Goyal A.Genome walking of large fragments:an improved method[J].J Biotechnol,2004,111:9-15.
[7]Khajanchi B K,Fadl A A,Borchardt M A,et al.Distribution of virulence factors and molecular fingerprinting of aeromonas species isolated from water and clinical samples:suggestive evidence of water-to-human transmission[J].Appl Environ Microbiol,2010,12:1-24.
[8]王春连,赵开军,章 琦,等.利用基因组文库加速 Xa23基因定位的染色体步移[J].中国水稻科学,2006,20(4):355-360.
[9]梁成真,张 锐,郭三堆.染色体步移技术研究进展[J].生物技术通报,2009(10):75-82.
[10]刘 馨,孙茂盛.轮状病毒VP4基因的原核表达、蛋白纯化及动物免疫试验[J].动物医学进展,2006,27(12):88-90.
[11]兰立新,肖怀秋.微生物脂肪酶生物学特性及分离纯化研究进展[J].生物技术通报,2009,26(5):1-5.
[12]Chuang Y C.Molecular analysis and expression of the extracellular lipase ofAeromonas hy drophilaMCC-2[J].Microbiology,1997,143:803-812.
[13]Merino S,Aguilar A.Cloning,sequencing,and role in virulence of two phospholipases(A1 and C)from mesophilic aeromonas sp.serog roup O:34[J].Infect Immun,1999,67:4008-4013.
[14]杨国宇,王艳玲.脂肪组织甘油三酯酶研究进展[J].动物医学进展,2007,28(7):60-62.
[15]汪小锋,王 俊,杨江科,等.微生物发酵生产脂肪酶的研究进展[J].生物技术通报,2008(4):47-53.
[16]刘 博,苏 乔,汤敏谦,等.应用于染色体步移的PCR扩增技术的研究进展[J].遗传,2006,28(5):587-595.
[17]Yu H B,Leung K Y.Identification and characterization of putative virulence genes and gene clusters in aeromonas hydrophila PPD134/91[J].Appl Environ Microbiol,2005,71:4469-4477.
Amplification of Complete Lipase Gene ofAeromonas hydrophilaJ-1 by Genome Walking Technique and Prokaryotic Expression
CHAO Wei,LIU Yong-jie,LU Cheng-ping
(K ey Laboratory of Animal Disease Diagnosis and Immunology of Ministry of Agriculture,Nanj ing Agriculture University,Nanjing,Jiangsu,210095,China)
A 383 bp gene fragment within the conserved region of lipase gene fromAeromonas hydrophilaJ-1 was obtained by PCR using primers reported.Subsequently,genome walking technique was applied to amplify unknown DNA sequences flanking the 383 bp conserved fragment.Genome walking libraries were constructed using six restriction enzymes(DraⅠ,EcoRⅤ,PvuⅡ,ScaⅠ,StuⅠ,SmaⅠ)and then used as templates to amplify the unknow n flanking sequences.By linking the flanking sequences with the 383 bp fragment,we got a long fragment up to 3 476 bp.Sequencing analysis revealed a 2415 bp open reading frame.Furthermore,BLAST analysis showed the 2 415 bp ORF had 97%,97%,88%,83%and 82%homologies to the DNA sequences ofA.hydrophilaATCC 7966 lipase,A.hydrophilaAH-3 phospholipase A1,A.hydrophilaH3 lipase,A.hydrophilaMcc-2 lipase,A.hydrophilaJMP636 phospholipase C,respectively.The deduced 805 amino acid sequence contained a highly conserved sequence of VHFLGHSLGA.
Aeromonas hydrophila;genome walking;lipase
S852.6
A
1007-5038(2010)09-0001-06
2010-03-07
巢 伟(1982-),男,湖南岳阳人,硕士,主要从事动物疫苗研发工作。

