青霉素酶特异性抗血清间接ELISA方法的建立*
严 兵,彭开松,薛秀恒,涂 健,王 强,何东旭,祁克宗
(安徽农业大学动物科技学院,安徽合肥 230036)
青霉素酶特异性抗血清间接ELISA方法的建立*
严 兵,彭开松,薛秀恒,涂 健,王 强,何东旭,祁克宗*
(安徽农业大学动物科技学院,安徽合肥 230036)
以青霉素酶为抗原,免疫健康獭兔,自行制备青霉素酶特异性抗血清(PcAb),并建立间接酶联免疫吸附试验(ELISA)的测定方法,优化试验条件,测定制备的青霉素酶特异性抗血清效价。结果表面抗原最佳包被浓度为10 μg/mL,酶标二抗最佳稀释度为1∶2 000,阳性血清最佳稀释度为1∶2 000,抗原最佳包被条件为4℃过夜,血清最佳反应时间为37℃1 h,酶标二抗反应最佳时间为37℃1 h,与底物作用的最佳时间为20 min。
青霉素酶;抗血清;间接ELISA
*通讯作者
β-内酰胺酶(β-lactamase)是一类由细菌产生的能够降解β-内酰胺类抗生素,使其抗菌作用减弱或消失的酶,是由多种酶组成的酶家族,俗称抗生素分解剂,又名解抗剂或金玉兰酶制剂[1-2]。至今发现的β-内酰胺酶的数量已超过190多种,主要为青霉素酶和头孢菌素酶[3]。
青霉素作为β-内酰胺类药物是治疗奶牛乳腺炎的首选药物,是牛奶中最常见的残留抗生素。国内大多数乳品企业出于经济利益的驱动,利用青霉素酶能选择性分解牛奶中残留的青霉素类抗生素的特性,人为的添加青霉素酶而达到降低牛奶中青霉素类抗生素的含量,生产人造“无抗奶”,但是由于该制剂的安全风险未知,为国家禁止使用的食品添加剂,目前国际和国内均不允许该酶在牛奶中作为添加剂使用[4]。另一方面,β-内酰胺酶的滥用也助长了牛奶生产中β-内酰胺类抗生素的滥用,加速了耐药菌的传播,严重威胁人体健康和中国奶业的长期发展[5-7]。因此,本研究建立的青霉素酶特异性抗血清间接ELISA检测方法,对于我国奶制品安全监测及保障我国奶业健康发展意义非常重大。
1 材料与方法
1.1 材料
1.1.1 实验动物 12只3月龄左右健康獭兔。
1.1.2 试剂 青霉素酶为日本东京仁成工业株式会社生产;HRP-山羊抗兔IgG二抗为上海市生工生物工程公司产品;TMB购自上海生工生物工程技术服务有限公司;其他包被液、抗体稀释液、底物液、终止液、封闭液均由安徽农业大学动物科技学院动物病理实验室自制。
1.1.3 仪器 318MC型酶标仪为上海市三科仪器公司产品;SZ-1型快速混匀器为江苏省金坛市金城国胜实验仪器厂产品;96孔ELISA酶标板为浙江省台州市爱思进公司产品;SZ-1型快速混匀器为江苏省金坛市金城国胜实验仪器厂产品。
1.2 方法
1.2.1 青霉素酶特异性抗血清的制备
1.2.1.1制备青霉素酶佐剂苗 免疫前将10 mL弗氏完全佐剂和10 mL青霉素酶分别吸入两个10 mL注射器内,然后插入三通管内,交替推动针管、混匀,反复搅拌,直至形成黏稠的乳剂,滴于水上完全不扩散为止。
1.2.1.2 免疫动物 选择12只、3月龄左右、健康、雄性、体重(2.0±0.5)kg的獭兔,随机分为A、B、C 3组,每组4只。试验前进行健康观察和预饲养2周,免疫之前心脏采血,作为阴性血清对照。用上述制备的青霉素酶佐剂苗进行背部皮下多点免疫,首免用青霉素酶弗氏完全佐剂苗,加强免疫用青霉素酶弗氏不完全佐剂苗,每两周免疫1次,每次免疫前心脏采血,离心分离血清。试验动物具体免疫程序见表1。
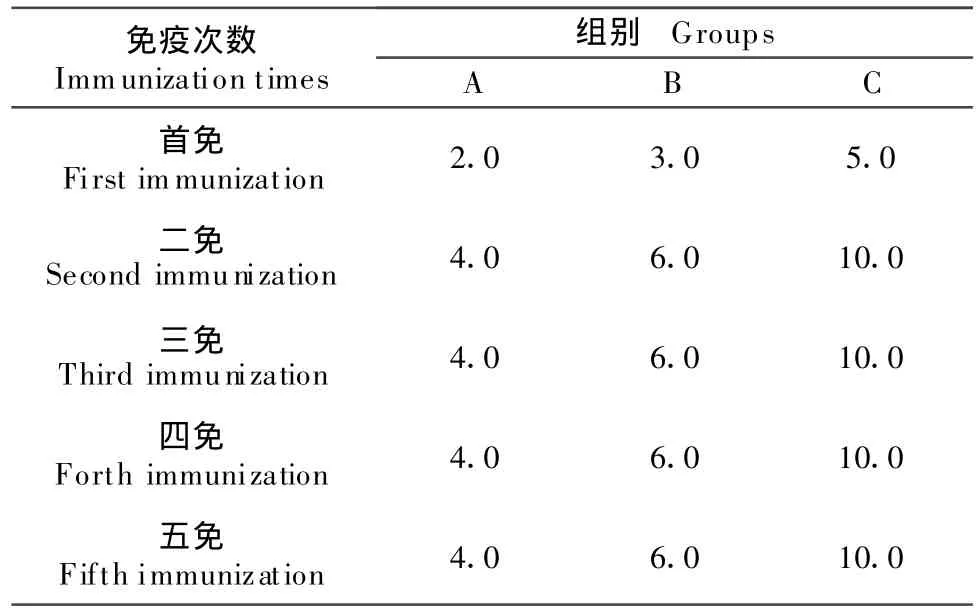
表1 试验动物免疫程序Table 1 The immune procedures of experimental animals
1.2.2 青霉素酶特异性抗血清间接ELISA方法
1.2.2.1 抗原最适包被浓度和酶标二抗最适工作浓度的确定及间接ELISA法基本操作步骤 包被:用制备的抗原包被液(Na2CO31.5 g,NaHCO3 2.9 g,用水定容至1 000 mL,调节pH9.6)将青霉素酶按 40、20、10、5.0、2.5、1.25 μg/mL 6 个梯度倍比稀释,每孔加100 μL包被 96孔酶标板,4 ℃过夜;弃去孔内液体,用制备的洗涤液(NaCl 8.0 g,KH2PO40.2 g,Na2HPO4◦12H2O 2.9 g,KCl 0.2 g,Tween-20 0.5 mL,用水定容至1 000 mL,调节pH 至 7.4)洗涤 3次,3 min/次~5 min/次,甩液,用吸水纸拍干;封闭 :用 200 μL 的 20 mL/L 牛血清白蛋白于37℃封闭3 h;弃去孔内液体,用洗涤液洗涤3次,3 min/次~5 min/次,甩液,用吸水纸拍干;加阳性血清:青霉素酶特异性抗血清用制备的抗体稀释液(NaCl 8.0 g,KH2PO40.2 g,Na2HPO4◦12H2O 2.9 g,KCl 0.2 g,用水定容至 1 000 mL,调节pH 至 7.4)作 2 000倍稀释,每孔加 100 μL,37℃孵育1 h,弃去孔内液体,用洗涤液洗3次,3 min/次~5 min/次,甩液,用吸水纸拍干;加酶标二抗:HRP-山羊抗兔IgG二抗用抗体稀释液作1∶500、1∶1 000、1∶1 500、1∶2 000、1∶2 500、1∶3 000五个梯度稀释,每孔加 100 μL,37 ℃孵育1 h,弃去孔内液体,用洗涤液洗 3次,3 min/次~5 min/次,甩液,用吸水纸拍干;加底物溶液:每孔加100 μL制备的 TMB显色液,置 37℃暗盒孵育20 min;加终止液 :用 100 μL 2 mol H2SO4中止反应,318MC型酶标仪检测492 nm处的OD值(OD492nm)。同时设置阴性对照。
1.2.2.2 抗血清最适稀释度的测定 分别将阳性血清、阴性血清用抗体稀释液作 1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000共 5个倍比稀释。318MC型酶标仪测定OD492nm值,计算P/N值。
1.2.2.3 抗原最佳包被条件的测定 按抗原包被条件分别为37℃1 h,37℃2 h 37℃4 h,4℃过夜,四种方式包被青霉素酶。318MC型酶标仪测定
OD492nm值,计算P/N 值。
1.2.2.4 阳性血清最佳反应时间的测定 按血清反应时间分别为0.5、1.0、1.5、2.0 h四种方式反应。测定OD492nm值,计算P/N值。
1.2.2.5 酶标二抗最佳反应时间的测定 按酶标二抗反应时间分别为 0.5、1.0、1.5、2.0 h四种方式反应。测定OD492nm值,计算P/N值。
1.2.2.6 底物溶液最佳显色时间的测定 按底物溶液反应时间分别为 10、15、20、25 min四种方式反应。测定OD492nm值,计算P/N值。
2 结果
2.1 ELISA方阵试验及抗原最佳包被量的结果
抗原最佳包被量结果见表2。由表2可知,P/N≥2时,且OD492nm值接近1时,抗原最佳包被量为每孔加1.0 μg,即10 μg/mL。最佳酶标二抗工作浓度1∶2 000。
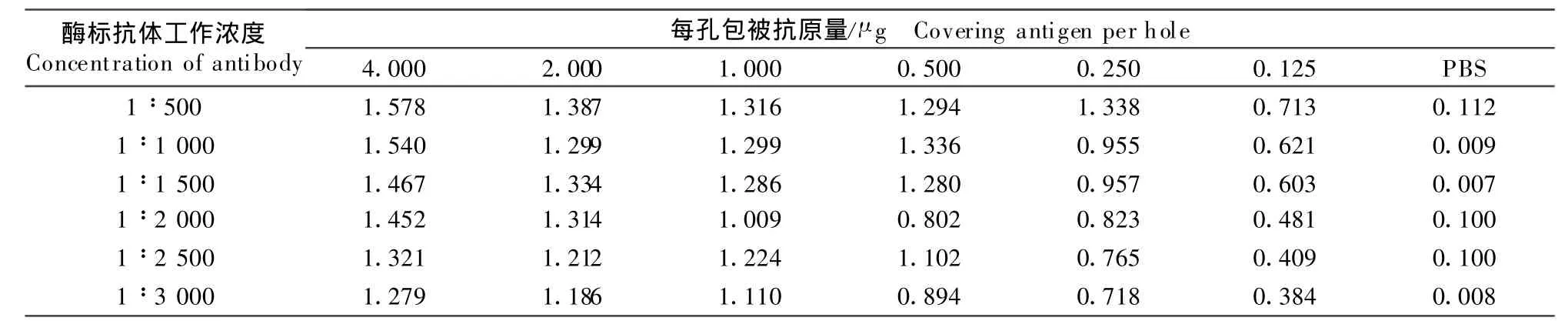
表2 方阵滴点结果Table 2 The results of founder titration
2.2 血清最佳稀释度的选择
血清最佳稀释度的结果见表3。由表3可知,P/N≥2时,且OD492nm值接近1时,血清的最佳稀释度为1∶2 000。
2.3 抗原最佳包被条件的选择
抗原最佳包被条件见表4。由表4可知,P/N≥2时,且OD492nm值接近1时,抗原最佳包被条件为4℃过夜。
2.4 血清最佳反应时间的选择
血清最佳反应时间的结果见表5。由表5可知,P/N≥2时,且OD492nm值接近1时,血清最佳反应时间为37℃1.0 h。
2.5 酶标二抗最佳反应时间的选择
酶标二抗最佳反应时间的结果见表6。由表6可知,P/N≥2时,且OD492nm值接近1时,酶标二抗最佳反应时间为37℃1.0 h。
2.6 底物溶液最佳显色时间的选择
底物最佳显色时间的结果见表7。由表7可知,P/N≥2时,且OD492nm值接近1时,底物最佳显色时间为25℃作用20 min。
2.7 抗血清效价检测
抗血清效价检测的结果见表8。由表8可知,三免、四免和五免的P/N值都大于2,可以判定为阳性血清。
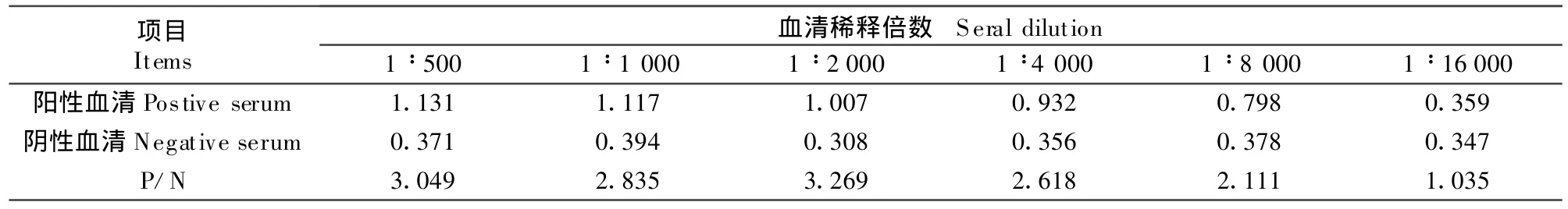
表3 血清最佳稀释度的选择Table 3 T he optimazation of seral dilutions

表4 抗原最佳包被条件的选择Table 4 T he optimazation of covering antigen
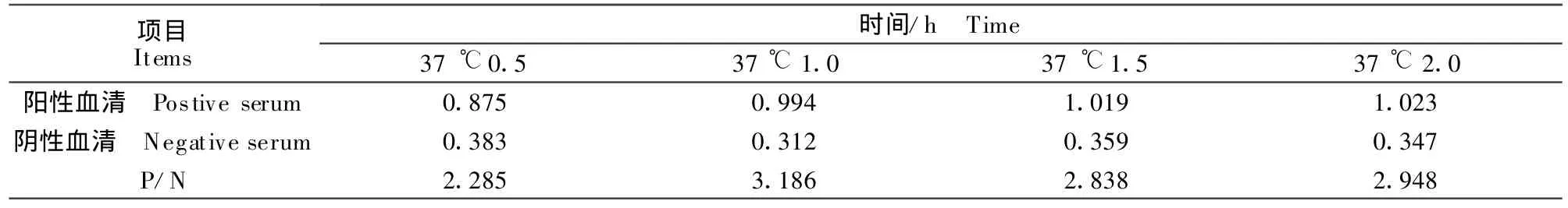
表5 血清最佳反应时间的选择Table 5 The optimazation of seral reaction time

表6 酶标二抗最佳反应时间的选择Table 6 The optimazation of 2nd antibody
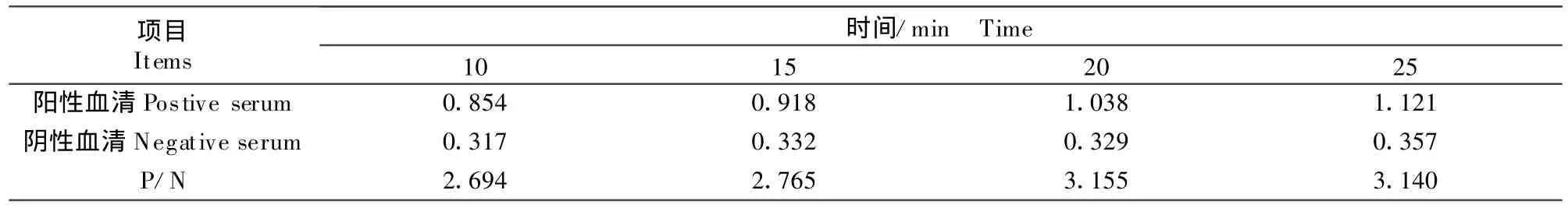
表7 底物溶液最佳显色时间的选择Table 7 The optimazation of the coloring time to substrate

表8 抗血清效价检测结果Table8 T he detection result of seral titer
3 讨论
青霉素酶是催化水解青霉素β-内酰环产生青霉噻唑酸的一类β-内酰胺酶。在各种微生物中分布广泛,特别在细菌中更为广泛,但不同菌种的青霉素酶的活性相差较大。青霉素酶的分子质量为28 ku~31 ku,由蜡样芽孢杆菌Bacillus cereus5/B与B.cereus569分别得到分子质量为35 200 ku与31 500 ku的青霉素酶结晶,从巨大芽孢杆菌B.megaterium提取出α、β、γ青霉素酶结晶,随后从不同细菌又分离出多种青霉素酶。该酶在pH(4~9.5)范围内稳定,中性条件下,50℃时仍能保持酶活性。在临床上,细菌由于产生青霉素酶而导致出现耐药性是最常见的机制。
检测青霉素酶的可行方法主要有微生物培养法和碘量法[8]。微生物培养法:利用克拉维酸、舒巴坦的特异性抑制青霉素酶的特点做细菌培养,通过测量抑菌圈得出结果。碘量法:利用β-内酰胺类抗生素的水解产物青霉噻唑酸与淀粉竞争游离碘,通过观察颜色可得出结果。碘量法虽然经典、快速,但其试剂配制较复杂,淀粉试剂易失效,必须现配现用[9]。微生物法具有敏感、简单的特点,但缺点是时间长,需过夜培养,同时当接种菌量少、血平板硬度大和药物扩散速度慢等因素时,都会使此法的阳性率偏低[10]。
本试验选择青霉素酶为抗原,免疫健康试验獭兔,制备青霉素酶特异性抗血清,建立了间接ELISA法进行青霉素酶的检测方法。此方法采用抗原与抗体的特异性将待测物与酶连接,然后通过酶与底物产生颜色反应来进行定性或定量[11]。通过对抗原最佳包被量、最佳酶标二抗工作浓度、血清最佳稀释度、抗原最佳包被条件、血清最佳反应时间、酶标二抗最佳反应时间和底物溶液最佳显色时间条件的优化,在此优化条件下建立的ELISA法灵敏性高,可以在微克水平上进行定量,具有高度的特异性,同时具有操作简单的特点。ELISA法高度的灵敏性和特异性是微生物培养法和碘量法无法比拟的[12-13]。
[1]张克春,缪德年.科学对待牛奶中β-内酰胺酶[J].上海畜牧兽医通讯,2005,38(2):399-400.
[2]林 毅,陈风义,刘 琳,等.蜡状芽孢杆菌产青霉素酶的研究进展[J].河北工业科技,2008,25(2):125-128.
[3]陈民钧,王 辉.迎接β-内酰胺酶的挑战[J].中华内科杂志,1999,38(2):511-513.
[4]崔生辉,李景云,马 越,等.生鲜牛乳抗生素分解剂的鉴定与检测[J].中国食品卫生杂志,2007,19(2):113-116.
[5]马 涛,徐文方.β-内酰胺酶与细菌耐药性的研究进展[J].国外医药,2000,21(4):199-201.
[6]陆东林,丁维华.强化奶源管理,确保乳品安全[J].新疆畜牧业,2008,2(5):14-15.
[7]窦 红,申宏丹,高春平,等.食品中总抗生素快速检测试剂盒性能的评价[J].2009,30(7):55-59.
[8]胡功政,张春辉.β-内酰胺酶的分类与检测[J].中国兽医杂志,2003,37(12):42-46.
[9]张坚磊,刘国琳,帅 真.应用碘试纸条法快速检测β-内酰胺酶[J].陕西医学检验,1999,14(1):63-64.
[10]赵旺胜,吴桂荣,刘家喜,等.四种检测β-内酰胺酶方法的实验比较[J].南京医科大学学报:中文版,1999,17(6):648–649.
[11]李宗妍,曹立民,林 洪,等.水产品中恩诺沙星残留酶联免疫检测体系的简化研究[J].食品工业科技,2009,13(4):326-329.
[12]申宏丹,窦 红,高春平,等.直接竞争酶联免疫检测莱克多巴胺研究[J].动物医学进展,2009,30(8):58-63.
[13]赫桂英,杨光友,古小彬.Dot-ELISA检测兔疥螨抗体方法的建立[J].动物医学进展,2009,30(4):8-13.
Establisment of Indirect ELISA for Special Serum of TEM
YAN Bing,PENG Kai-song,XUE Xiu-heng,T U Jian,WANG Qiang,HE Dong-xu,QI Ke-zong
(College of Animal Science,Anhui Agricultural University,Hefei,Anhui,230036;China)
To develop indirect ELISA for special serum of TEM,special sera of TEM were chosen and used to optimize the experiment conditions and evaluate the method.The results showed that the optimal prmordial covering concentration was 10 μg/mL,the optimal dilution of enzyme-labeled 2nd antibody was 1 ∶2 000,the optimal dilution of serum examined was 1∶2 000,the optimal prmordial covering condition was 4℃and one night,the optimal reaction time was 37℃and one hour,the optimal reaction time of enzyme-labeled 2nd antibody was 37℃and one hour,the optimal reaction time of substrate was twenty minutes.
TEM;anti-serum;indirect ELISA
S859.796
A
1007-5038(2010)09-0047-04
2010-03-19
“十一◦五国家科技支撑计划“课题”农药与兽药残留确证检测技术研究”分课题(2006BAK02A08-4)
严 兵(1983-),男,安徽青阳人,硕士研究生,主要从事动物源性食品安全与控制研究。

