保护剂对冷干和贮存过程中乳杆菌存活率的影响
潘 艳 何胜江
随着我国畜牧业的迅猛发展,饲料的需求量日益加大。青贮饲料由于其适口性好、消化率高,以及可以缓解青绿饲料的地区与季节的不平衡等原因,已成为家畜常用的粗饲料。在实际生产中,往往因有害微生物的大量生长使青贮饲料的营养损失严重。为了减少青贮饲料在青贮过程中的腐烂及营养成分损失,应促进乳酸菌的增殖,迅速降低青贮过程的pH值,抑制其它有害微生物的生长,以达到改善青贮饲料品质、提高动物生产性能的目的。使用青贮添加剂是改善青贮饲料发酵品质的重要手段。乳酸菌添加剂作为一种微生物青贮添加剂,具有其它青贮添加剂不可比拟的优点,受到了人们极大的关注。
在国外,乳酸菌添加剂在20世纪60年代就已有研究,且取得了一定的成果。但我国起步比较晚,在畜牧业中的应用甚少。因此,乳酸菌添加剂的开发研究及应用前景广泛。
19世纪初就提出的真空冷冻干燥原理,直到1890年才被首次运用于干燥生物器官和组织。在之后的数十年中,真空冷冻干燥技术的应用一般都只是在实验室中,二次大战后才得以应用于不同的行业中。真空冷冻干燥技术,它适宜于热敏性及易氧化物质的干燥,被干燥的物料能保持原有的形态,复水后易恢复原有的特性。利用该技术制备的乳酸菌干燥品具有便于贮藏、携带方便、复水性好等许多优点。但是,要制备出单位重量含活菌数高、复水后活力强的高效浓缩型乳酸菌发酵剂的粉状制品,必须降低冷冻干燥过程对乳酸菌细胞膜的损伤作用。Woolford等(1984)在实验室条件下检测了21株乳酸菌,发现了三株基本符合理想的青贮添加剂条件的乳酸菌菌株,分别为坚强链球菌(Streptococcus durans)、嗜酸乳杆菌(Lactobacillus acidophilus)和植物乳杆菌(Lactobacillus plantarum)。因此,本试验选择植物乳杆菌作为菌种材料,通过研究添加不同冷冻干燥保护剂和不同保存温度、保存时间对乳酸菌冷冻保存活菌量的影响,以筛选出效果较好的植物乳杆菌冷冻干燥保护剂和保存的温度,为乳酸菌青贮添加剂的开发提供一定的依据。
1 材料与方法
1.1 材料
1.1.1 乳酸菌菌种
植物乳杆菌(Lactobacillus plantarum),由南京农业大学动物科技学院草业研究室提供。
1.1.2 细胞悬浮基质
细胞悬浮基质为20%的脱脂奶粉溶液 [脱脂奶粉(由内蒙古伊利实业集团股份有限公司制造)溶于无菌蒸馏水,121℃高温灭菌15 min。灭菌后于37℃培养24 h,检查是否灭菌彻底,检验无菌后置于4℃冰箱中备用]。
1.1.3 复水溶液
复水溶液为20%的乳糖溶液(称取乳糖溶于无菌蒸馏水,121℃高温灭菌15 min,置于4℃冰箱中备用)。
1.1.4 培养基
活化培养基(MRS液体培养基):蛋白胨10 g/l、牛肉膏 10 g/l、酵母膏 5 g/l、柠檬酸三铵 2 g/l、葡萄糖 20 g/l、乙酸钠 2 g/l、Tween-801 ml/l、K2HPO42 g/l、MgSO4·7H2O 0.58 g/l、MnSO4·4H2O 0.25 g/l,pH 值6.2,用于乳酸菌活化、扩大培养。
计数培养基(MRS固体培养基):蛋白胨10 g/l、牛肉膏 10 g/l、酵母膏 5 g/l、柠檬酸三铵 2 g/l、葡萄糖 20 g/l、乙酸钠 2 g/l、Tween-801 ml/l、K2HPO42 g/l、MgSO4·7H2O 0.58 g/l、MnSO4·4H2O 0.25 g/l,pH 值6.2,加1%的琼脂,用于乳酸菌计数。
1.1.5 保护剂
10%海藻糖、20%蔗糖、5%谷氨酸钠、10%乳糖、55%山梨醇。
1.2 仪器与设备
感量电子分析天平(上海分析仪器厂生产)、CH801型超净工作台(天津医疗净化设备厂生产)、GO1-280型压力蒸汽灭菌锅(成都医疗器械厂生产)、CS101-A型电热鼓风干燥箱(重庆试剂设备厂生产)、冷冻离心机(Beckman coulter公司生产)、真空冷冻干燥机(KINETICS公司生产),其它为实验室常用设备。
1.3 研究方法
1.3.1 植物乳杆菌粉剂制备和保存工艺路线
植物乳杆菌经过数代活化液体培养基培养→扩大液体培养基培养→离心收集菌体细胞、制备植物乳杆菌悬浮液→加冷冻干燥保护剂→分装、冷冻干燥→检验→保存、检验。
1.3.2 乳酸菌悬浮液的制备
良好保存的植物乳杆菌菌种经过数代活化后扩大培养至静止期或成熟期,用冷冻离心机离心收集菌体细胞,制备悬浮液,收藏备用。
1.3.3 冷冻干燥
往经高温灭菌过的培养皿(d=9 cm)中加入20%的脱脂奶粉溶液、保护剂和乳酸菌悬浮液各5 ml后,在-20℃下预冷冻12 h,然后在充分预冷的冷冻干燥机里干燥7 h左右,直至样品温度接近室温。
1.3.4 储存试验
冷冻干燥后的乳酸菌粉立即取样测定活菌量,其余的分别保存于4和25℃的恒温培养箱中,定期取样测定活菌量。
1.3.5 活菌数测定
采用稀释平板活菌计数法,即在无菌操作条件下,将充分搅匀的检样吸取1 ml,加入无菌蒸馏水中,制成1:10的均匀稀释液;再依次进行10倍递增稀释,至适当稀释度。吸取1 ml置于灭菌培养皿中,然后倒入约15 ml水至50℃左右的计数培养基,摇匀。凝固后置于37℃,培养48 h,计平板上的菌落数。
1.3.6 存活率的测定
精确称取待测菌粉0.02 g,加入40 ml 20%的乳糖溶液室温下复水30 min,再进行活菌数测定。

2 结果与分析
2.1 保护剂对冷冻干燥过程乳酸菌存活率的影响
植物乳杆菌菌种经过数代活化,再扩大培养至静止期或成熟期后离心收集菌体细胞,按1:1:1的比例取菌体细胞悬浮液、悬浮基质和保护剂各5 ml加入灭菌的培养皿中,混匀,在-20℃下预冷冻12 h,然后在充分预冷的冷冻干燥机里干燥7 h左右得到的植物乳杆菌菌粉的存活率结果见表1。

表1 保护剂对植物乳杆菌冷冻干燥存活率的影响(%)
由表1可以看出,加入保护剂均能显著提高乳酸菌的存活率,保护剂对乳酸菌的保护作用大小顺序为:海藻糖>蔗糖>谷氨酸钠>乳糖>山梨醇。海藻糖、谷氨酸钠、山梨醇、乳糖和蔗糖与空白对照间比较有极显著差异(P<0.01),海藻糖与蔗糖、谷氨酸钠、乳糖、山梨醇间均有极显著差异(P<0.01),蔗糖与谷氨酸钠、乳糖、山梨醇间有显著差异(P<0.05),谷氨酸钠与乳糖、山梨醇间有显著差异(P<0.05),而山梨醇和乳糖处理间差异不显著(P>0.05),其中,海藻糖的保护作用最显著,存活率达78.90%,比空白提高了38.53个百分点,植物乳杆菌的存活率几乎增加一倍。
2.2 保护剂对乳酸菌冷冻干燥菌粉贮存过程存活率的影响
青贮添加剂有一定的寿命,本试验对添加了不同保护剂制得的植物乳杆菌粉在4℃和25℃条件下进行贮存,表2和表3为不同保存期的植物乳杆菌存活率方差分析结果。
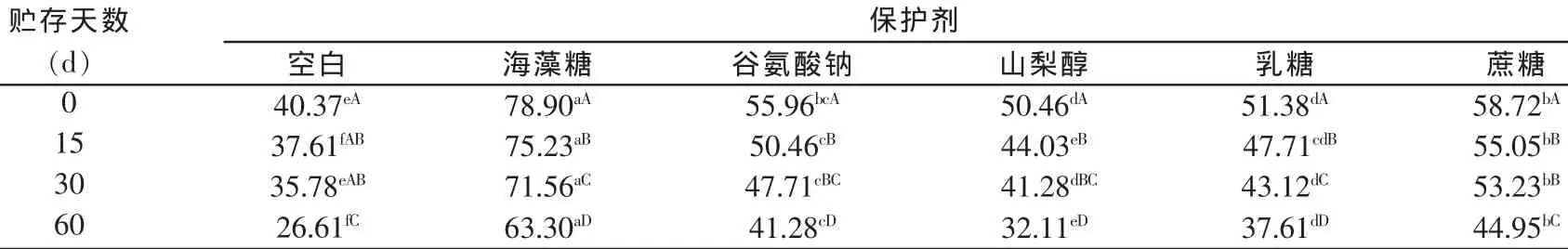
表2 不同保护剂对植物乳杆菌在4℃下贮存存活率的影响(%)

表3 不同保护剂对植物乳杆菌在25℃下贮存存活率的影响(%)
由表2可知,在贮存温度为4℃时,随着贮存天数的增加,各处理的植物乳杆菌存活率均不断减低。其中,空白对照组在4℃保存30 d以内的植物乳杆菌存活率变化不显著,30 d后乳酸菌死亡速度加快。海藻糖对冷冻干燥植物乳杆菌的保护作用相对最强,但在15、30、60 d 存活率下降速度快,差异极显著(P<0.01)。谷氨酸钠在保存15 d和30 d时乳酸菌存活率差异不显著(P>0.05),而后开始加速死亡。山梨醇处理的植物乳杆菌存活率变化趋势大致与谷氨酸钠相同。乳糖处理在整个保存过程中存活率变化极显著(P<0.01)。蔗糖处理15 d与30 d时变化不显著(P>0.05)。
贮存温度为4℃时,同一贮存时间上,15 d时除了谷氨酸钠和乳糖差异不显著(P>0.05)外,其他处理间存活率差异都较显著。30 d时山梨醇与乳糖处理差异不显著(P>0.05),其他处理差异均极为显著(P<0.01)。60 d时,空白及各处理间差异极显著(P<0.01)。
由表3可知,在贮存温度为25℃时,随着贮存天数的增加,各处理的植物乳杆菌存活率均不断降低,空白对照组在25℃下保存,植物乳杆菌存活率随保存时间增加显著降低,15、30、60 d 间均有显著差异(P<0.05);海藻糖对冷冻干燥植物乳杆菌的保护作用相对最强,但在15、30、60 d存活率下降速度快,差异极显著(P<0.01);谷氨酸钠、山梨醇、乳糖、蔗糖处理的植物乳杆菌存活率变化趋势大致与海藻糖相同,在不同时间测定的植物乳杆菌存活率均有显著差异(P<0.05)。
25℃保存的结果分析表明,在15 d和30 d时空白对照处理及保护剂处理组间差异极显著(P<0.01)。60 d时,除谷氨酸钠和蔗糖处理间差异不显著(P>0.05),空白对照和其他保护剂处理组间差异极显著(P<0.01)。
由表2和表3中结果比较可以看出,在4℃下保存植物乳杆菌的存活率变化较25℃下缓慢,其中,海藻糖对降低乳杆菌死亡率的效果相对较好。
3 讨论
3.1 保护剂在植物乳杆菌冷冻干燥过程中的保护作用
对海藻糖、谷氨酸钠、山梨醇、蔗糖和乳糖5种保护剂及空白对照组的植物乳杆菌冷冻干燥保护效果的比较研究结果表明,5种保护剂对植物乳杆菌均有明显的保护作用,其中海藻糖的作用最明显,达78.90%,比空白提高了38.53个百分点,活菌率几乎增加了1倍,其次是蔗糖、谷氨酸钠、山梨醇和乳糖的效果相当。
微生物的真空冷冻干燥分3个步骤进行。首先是预冻过程,预冻的速度与温度根据微生物的种类而定。在这个过程中微生物体内的游离水冻结为小冰晶,冰晶体对微生物的细胞有机械损伤作用。研究结果表明,预冻增大了细胞膜的通透性,破坏了细胞膜的结构,其破坏程度与细胞膜内非饱和脂肪酸/饱和脂肪酸的值有关。其次是升华过程,将预冻好的微生物置于高真空度的环境中,冰晶吸热而直接变成水蒸气从微生物体内逸出。升华过程是由内向外逐渐推移的,冰晶升华后在微生物体内留下许多微孔隙。再次是解析过程,这一过程使得残留在微生物体内的结合态水解析出来,进一步降低微生物体内水分的含量。
但是冷冻干燥对菌细胞有很大伤害,为了提高微生物真空冷冻干燥后细胞存活率和稳定性,常在冷冻时加入保护剂。保护剂的保护作用与它们的化学结构有着密切的关系,如低分子糖和低分子醇,它们具有多个羟基,这些羟基可以与细胞表面的自由基联结起来,使细胞表面形成一层保护层,避免其直接暴露于外界。保护剂表面的羟基还可以与细胞表面的蛋白质形成氢键以取代水,增强细胞蛋白质的稳定性。另外这些保护剂可以作为支持物和受体在复水过程中为干物质提供一定的骨架结构,在冷冻干燥过程中包围在活细胞外,起到保护活细胞的作用。在适宜的冷冻干燥保护基质中冻干的菌体形态变化不大,菌表面呈脑回皱褶。
近年来研究发现,海藻糖(Trehalose)也是一种很好的活性物质保护剂,它是由两个吡喃环葡萄糖分子经α,α-1,1键联结而成的非还原性双糖,有较大的水化体积,能竞争更多的蛋白质水化层中的水,使蛋白质结构更为紧密,不易受到外界不利环境的影响,研究表明,海藻糖具有稳定细胞膜和蛋白质结构、抗逆保鲜的作用,能在高温、干燥失水等恶劣条件下在细胞表面形成特殊的保护膜,有效地保护生物分子结构不被破坏,降低干燥过程对细胞膜、脂质体等的伤害作用。
海藻糖对生物分子的保护作用,提出了种种假说,其中一种称为“水替代”假说,该假说的依据是生物大分子物质周围均包围着一层水膜,对维持大分子的结构和功能是必不可少的,当生物大分子失去维持其结构和功能特性的水膜时,海藻糖能在失水部位以氢键形式连接,形成一保护膜以代替失去的结构水膜。
3.2 保护剂在植物乳杆菌粉剂贮存过程中的保护作用
添加了不同保护剂制得的植物乳杆菌粉在4℃和25℃条件下进行贮存表明:随着温度的升高,植物乳杆菌的死亡率增加,即在4℃条件下贮存的植物乳杆菌存活率高于25℃条件下的存活率;随着保存时间的延长植物乳杆菌的死亡速度加快,海藻糖的作用优于其他保护剂。
乳酸菌经过干燥处理,但由于粉剂中仍然含有一定量的水分,在保藏过程中,残留的水容易与蛋白质分子形成氢键,使细胞中蛋白质的稳定性降低而容易变性,从而导致细胞的活力降低甚至死亡。从试验结果可以看出,加入分子中含多羟基的保护剂后,细胞的存活率有所提高,这是因为保护剂的羟基可与细胞表面的蛋白质形成氢键以取代水,增强了细胞蛋白质的稳定性。
4 结论
4.1 对海藻糖、谷氨酸钠、山梨醇、蔗糖和乳糖5种保护剂的冷冻保护效果的比较研究表明,5种保护剂对植物乳杆菌均有明显的保护作用,其中海藻糖的作用最明显。
4.2 添加了不同保护剂制得的植物乳杆菌粉在4℃和25℃条件下进行贮存表明:4℃条件下贮存的植物乳杆菌存活率高于25℃条件下的存活率;随着保存时间的延长植物乳杆菌的死亡速度加快,海藻糖的作用优于其他保护剂。
[1]郑裕国,薛亚平,金利群,等.生物加工过程与设备[M].北京:化学工业出版社,2004:478-484.
[2]乔发东,南庆贤,兰风英.浓缩乳酸菌发酵剂冷冻干燥介质的选择[J].中国乳品工业,1998,26(4):13-15.
[3]Woolford MK,Sawczyc MK.An Investigation into the effect of culture of lactic acid bacteria on fermentation in silage[J].Grass and Forage Science,1984,39:139-148.
[4]Brookes RM,Buckle AE.Lactic Acid Bacteria,Volume 1:The Lactic Acid Bacteria in Health and Disease.Ed.Wood BJB.Elsevier Science Publishers Ltd,1992.
[5]赵瑞香,李元瑞,罗磊.嗜酸乳杆菌生产特性的研究[J].西北农林科技大学学报(自然科学版),2002(3):85-88.
[6]刘云鹤.高效乳酸菌增殖培养基的筛选[J].淮海工学院学报,2003,12(4):59-62.
[7]顾金刚.微生物菌种资源收集、整理、保藏技术规程[M].北京:中国农业出版社,2003:103.
[8]张兰威,鄂志强,万海峰,等.乳酸菌增菌培养基的筛选及干燥保护剂的选择[J].中国乳品工业,2000,28(2):7-10.
[9]沈萍,范秀蓉,李广武.微生物学试验[M].北京:高等教育出版社,1999.
[10]曹永梅,张灏,许时婴,等.保护剂在冷冻干燥双歧杆菌中的作用[J].食品与发酵工业,2002,26(2):40-44.
[11]李华,骆艳娥,刘延琳.真空冷冻干燥微生物的研究进展[J].微生物学通报,2002,29(3):79-82.
[12]姚祖华,李亦德.生态制品的冻干及保护剂的应用[J].中国微生态学杂志,1997,9(6):48-49.
[13]Coutinbo C,Bemardes E,Felix D,et al.Joumal of Biotechnology,1988(7):23-32.
[14]吕加平,骆承痒.乳酸菌发酵剂冷干保护剂筛选及应用的研究[J].东北农业大学学报,1998,29(4):371-379.
[15]戴秀玉,沈义国.海藻糖对乳酸菌的抗逆保护作用[J].微生物学通报,2001,28(2):46~50.
[16]张英华,霍贵成,郭鸰.乳酸菌冷冻干燥保护剂的筛选及加速储存稳定性试验[J].中国乳品工业,2007,35(2):8-10.

