盐酸多奈哌齐对侧脑室注射 Aβ25-35大鼠海马脑源性神经营养因子表达的影响
王亮亮,王 哲,高旭红,李黎黎,马中子,孟宪峰
脑源性神经营养因子 (brain-derivedneurotrophicfactor,BDNF)是神经营养因子家族的一个重要成员,广泛分布于中枢神经系统,具有重要的神经保护作用并对学习记忆功能有重要的作用[1-2]。同时,研究还发现阿尔茨海默病 (Alzheimer disease,AD)患者海马、皮质、基底前脑神经元中 BDNF和它的受体 (tyrosinekinaseB,trkB)表达明显下降,提示BDNF可能与 AD呈一定的相关性[3-5]。因此探讨 BDNF在 AD患者脑内表达下降的原因,并寻找有效药物以抑制细胞内下调BDNF表达的信号通路或增加细胞内 BDNF表达成为治疗 AD的措施之一。盐酸多奈哌齐 (donepezil,DN)作为一种乙酰胆碱酯酶抑制剂广泛用于 AD的治疗,近几年的研究发现除以上的机制外,其对 AD神经元还有保护作用,使神经元免于丢失[6]。但其是否能通过影响 AD患者脑内 BDNF的表达而发挥神经保护作用的研究还较少,故本研究通过向大鼠侧脑室注射微量 Aβ25-35建立 AD动物模型[7],然后予以 DN治疗,通过免疫组化及免疫印迹方法观察大鼠海马区 BDNF的表达变化,以期探讨 DN对 AD脑内神经元保护的作用机制。
1 材料与方法
1.1 实验动物及分组 相同环境下饲养的清洁级雄性 Wistar大鼠 24只 (中国医科大学实验动物部,许可证号:SYXK[辽]2003-0013),3月龄,体质量 (200±20)g,采用数字表法将大鼠随机分为对照组、模型组和干预组。
1.2 手术及给药方式 采用大鼠侧脑室内定点注射方法:用0.9%氯化钠溶液将 Aβ25-35制备成质量浓度为 2μg/μl的Aβ25-35溶液,37℃孵育 1周,形成聚合状态的 Aβ25-35[8]。模型组大鼠经水合氯醛 (30mg/kg)麻醉后,备皮,置于脑立体定位仪上,固定头部。常规消毒皮肤,沿颅顶中线剪开皮肤,暴露头骨及前囟,参照 George等[9]介绍的方法选定侧脑室注射位点。于前囟后 0.8mm,矢状缝旁 1.5mm处,用牙科钻钻开颅骨,微量加样器吸取 Aβ25-35溶液 7.5μl,垂直进针,达蛛网膜下 3.0mm处,缓慢注射,5min内完成,留针 5min后取出。对照组给予同等剂量的 0.9%氯化钠溶液。清洁创面后缝合皮下组织和皮肤,对合好切口,强力碘消毒,待大鼠清醒后放回笼中常规饲养。干预组造模后腹腔注射 DN 1.5mg·kg-1·d-1,连用 4周;对照组、模型组给予等量0.9%氯化钠溶液进行腹腔注射。
1.3 免疫印迹法检测 BDNF的表达 大鼠颈椎脱臼处死,断头,剥离并取出双侧海马结构,剪碎后加入 10倍于其体积的4℃预冷的脑组织裂解液 (每毫升含 PMSF6μl,现用现加),静置 30min后匀浆离心 (4℃,13000r/min,30min),取上清液。采用 Bradford法测定蛋白浓度,按体积比加上样缓冲液,100℃煮 5min,等量上样后进行 SDS-PAGE电泳,5%浓缩胶中 (80V,0.01A),12%分离胶中 (120V,0.02 A),然后半干转印到聚偏氟乙烯 (PVDF)膜上 (50V,2 h),5%脱脂奶粉室温封闭 2h,分别加兔抗大鼠 BDNF(1∶800),抗 GAPDH抗体 (1∶1000)4℃孵育过夜,浓缩型辣根过氧化物酶标记羊抗兔二抗 (1∶1000)37℃孵育 2h。入 MF-ChemiBIS3.2(DNRBio-ImagingSystem)成像仪。成像后以 Scionimage软件 (ScionCorporation)测量目的条带的光密度值,并将各条带的光密度值以相应 GAPDH条带的光密度值进行校正。
1.4 统计学方法 计量资料以 (x±s)表示,应用 SPSS 11.5软件单因素方差分析进行组间比较。P<0.05为差异有统计学意义。
2 结果
3组大鼠海马脑神经元中 BDNF的免疫印迹结果如图 1所示,在相对分子量为13kD处有一清晰的 BDNF条带,Western blotting成像后以 Scionimage软件 (ScionCorporation)测量目的条带的光密度值,并将各条带的光密度值以相应 GAPDH条带的光密度值进行校正。光密度值比值统计分析结果显示,3组大鼠 BDNF表达水平间差异有统计学意义 (F=10.834,P=0.001),模型组 BDNF的表达水平弱于对照组,差异有统计学意义 (P=0.000),而干预组 BDNF表达水平较模型组上调,与模型组比较差异有统计学意义 (P=0.019,见表 1)。
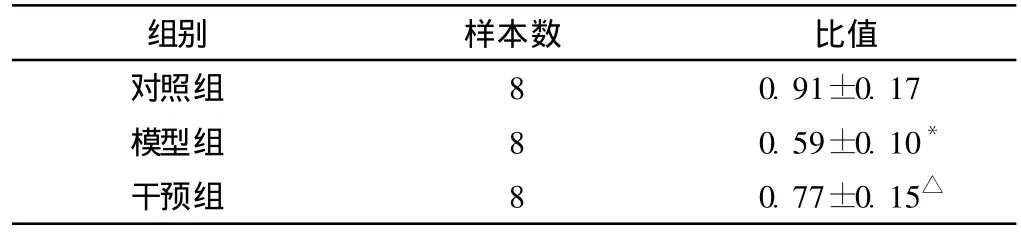
表 1 3组大鼠海马 BDNF表达水平 (x±s)Table1 TheexpressionlevelsofBDNFweredigitizedbyusingScionimage softwareandstandardizedbyGAPDH
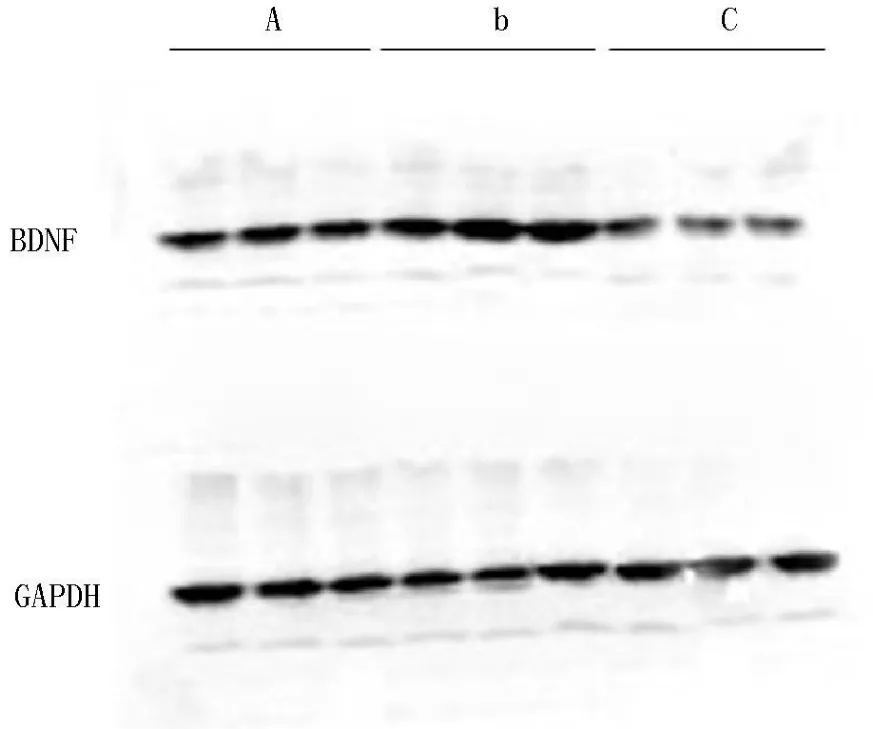
图 1 大鼠海马 BDNF的表达 (免疫印迹法)Figure1 TheexpressionofBDNFwasdeterminedbywesternblottinganalysis
3 讨论
本研究通过免疫组化和免疫印迹的方法发现大鼠侧脑室注射 Aβ25-35后能诱导 BDNF水平的下降,与 Christensen等[10-11]的研究结果相似,提示可能在 AD时产生的 Aβ能诱导BDNF水平的下降,从而加重了 AD神经元的损伤,使其记忆认知功能发生障碍。因此抑制 AD患者脑内 BDNF水平的下降可能对 AD有一定的改善作用。一些研究表明 Aβ25-35同时能降低 BDNF功能的发挥,如 Tong等[12]的研究表明较低剂量的 Aβ就能降低 BDNF的功能,具体机制为主要抑制了 BDNF发挥作用的两条通路:有丝分裂蛋白激活酶 (ras-mitogenactivated protein kinase,MAPK)信号通路中的细胞外信号激酶 (extracellular signal-regulated kinase1/2,ERK1/2)信号通路和磷脂酰肌醇 3磷酸酶 (phosphatidylinositol3-kinase,PI-3-K/AKT)信号通路。故在 AD情况下,BDNF功能的下降可能也加重了学习认知障碍及神经损伤,其可能也是我们将来的一个研究方向。
本研究通过免疫组化及免疫印迹法显示 DN能增加 AD模型大鼠脑内 BDNF的表达。一些研究显示其对正常大鼠大脑内BDNF的影响较小[13]。故推测作用机制可能与其能抑制 Aβ的作用有关。与国外的一些结果类似,如 Leyhe等[14]的研究表明口服 DN组患者与服安慰剂者相比血清中 BDNF水平显著增加,推测 DN通过增加 AD患者 BDNF的表达而发挥神经保护作用。Kotani等[15]的研究显示 DN可增加 DG区磷酸化 cAMP反应元件结合蛋白 (Phosphorylation cAMPresponse elementbinding protein,pCREB)的阳性细胞数,故推测其可能激活cAMP反应元件而上调 BDNF的表达。其对其他调节元件的作用仍不清楚。另外其能否通过增加胆碱量而增加 BDNF的研究结果也很不一致,仍有待进一步研究。
1 Barde YA,Edger D,Thoenen H.Purification of a new neurotrophic factor from mammalian brain[J].EMBO J,1982,1(5):549.
2 Jing S,Tapley P,Barbacid M.Nerve growth factor mediates signal transduction through trk homodimer receptors[J].Neuron,1992,9(5):1067
3 Michalski B,Fahnestock M.Pro-brain-deprived neurotrophic factor is decreased in parietal cortex in Alzheimer′s disease[J].Brain Res Mol Brain Res,2003,111(1-2):148-154.
4 Mufson EJ,Counts SE,Fahnestock M,et al.Cholinotrophic molecular substrates of mild cognitive impairment in the elderly[J].Curr Alzheimer Res,2007,4(4):340-350.
5 Garzon D,Yu G,Fahnestock M.A new brain-derived neurotrophic
factor transcript and decrease in brain-derived neurotrophic factor transcripts1,2 and 3 in Alzheimer′s disease parietal cortex[J].Neurochem,2002,82(5):1058-1064.
6 Kimura M,Komatsu H,Ogura H,et al.Comparison of donepezil and memantine for protective effect against amyloid-beta(1-42)toxicity in rat septal neurons[J].Neurosci Lett,2005,391(1-2):17-21.
7 Stepanov II,Kuznetsova NN,Klement′ev BI,et al.Effects of Intracerebroventricular Administration of Beta-Amyloid on the Dynamics of Learning in Purebred and Mongrel Rats[J].Neurosci Behav Physiol,2007,37(6):583-590.
8 Nakagawa Y,Yuzuriha T,Iwaki T.Active clearance of human amyloid beta 1-42 peptide aggregates from the rat ventricular system[J].Neuropathology,2004,24(3):194-200.
9 George P,Charles W.The rat brain in stereotaxic coordinates[M].6th Edition.Sydney:Academic Press,1982.
10 Christensen R,Marcussen AB,Wörtwein G,et al.Aβ (1-42)injection causes memory impairment,lowered cortical and serum BDNF levels,and decreased hippocampal 5-HT2A levels[J].Exp Neurol,2008,210(1):164-171.
11 Garzon DJ,Fahnestock M.Oligomeric amyloid decreases basal levels of brain-derived neurotrophic factor(BDNF)mRNA via specific downregulation of BDNF transcripts IV and V in differentiated human neuroblastoma cells[J].Neurosci,2007,27(10):2628-2635.
12 Tong L,Balazs R,Thornton PL,et al.Beta-amyloid peptide at sublethal concentrations downregulates brain-derived neurotrophic factor functions in cultured cortical neurons[J].Neurosci,2004,24(30):6799-6809.
13 王子玫,孙启祥,夏宗勤,等 .异菝葜皂甙元及多奈哌齐对大鼠脑神经营养因子和胆碱乙酰转移酶的影响 [J].中华老年医学杂志,2007,26(4):289-292.
14 Leyhe T,Stransky E,Eschweiler GW,et al.Increase of BDNF serum concentration during donepezil treatment of patients with early Alzheimer′s disease[J].Eur Arch Psychiatry Clin Neurosci,2008,258(2):124-128.
15 Kotani S,Yamauchi T,Teramoto T,et al.Pharmacological evidence of cholinergic involvement in adult hippocampal neurogenesis in rats[J].Neuroscience,2006,142(2):505-514.

