瘦素抑制H2O2诱导的大鼠心肌细胞凋亡
潘 喆, 李晓博, 孙爱丽, 庄向华, 姜冬青, 刘元涛△, 姜兆顺
(1山东大学第二医院内分泌科,山东 济南 250033;2济南军区总医院内分泌科,山东 济南 250031)
瘦素是肥胖基因(ob)的产物,主要由白色脂肪组织合成,其主要功能是通过与下丘脑的瘦素受体结合,影响神经肽Y等多种神经内分泌激素的分泌,导致摄食减少、耗能增加[1]。除了脑组织外,目前研究表明,肝脏、骨骼肌、心肌、肾脏等外周组织也存在瘦素受体[2,3],提示瘦素可通过中枢及外周双重作用调节机体的各种功能。心脏是瘦素的重要靶器官之一。研究发现,瘦素信号缺陷可导致心肌细胞凋亡增加,并且与慢性心衰的发生有密切关系,但确切机制尚不清楚[4]。自由基损伤是各种因素导致心肌损伤的共同机制之一,本文将通过体外心肌细胞培养,观察瘦素对H2O2诱导的细胞凋亡的影响并初步探讨其作用机制。
材料和方法
1 材料
Caspase-3单克隆抗体(识别全长及裂解的大片段)、磷酸化胞外信号调控激酶ERK1/2单克隆抗体(phos-extracellular signal-regulated kinase,p-ERK)(Cell Signaling Technology)。ERK1/2抗体(Pan-ERK)、辣根过氧化物酶标记Ⅱ抗(Santa Cruz),DMEM细胞培养液(Gibco),细胞培养皿(BD),TUNEL 试剂盒(Roche),瘦素(Calbiochem),PD98059(Cell Signaling Technology),DAPI封片剂(Vector Laboratories),其它材料来自Sigma。
2 方法
2.1 细胞培养 大鼠心室肌细胞H9c2细胞,培养于含10% 胎牛血清的DMEM培养液中,培养温度为37℃、饱和湿度和5%CO2。实验前,细胞于6孔板内培养至亚融合状态,然后无血清培养4 h。为诱导凋亡,细胞分为:对照组、H2O2处理组、H2O2+瘦素组。H2O2终浓度400 μmol/L,处理时间为6 h。瘦素浓度为6 nmol/L(此浓度参考相关文献,在生理浓度范围内)预处理1 h并维持到 H2O2处理结束。PD98059抑制实验,细胞分为:对照组、H2O2处理组、PD98059+H2O2组、PD98059+H2O2+瘦素组。细胞应用瘦素前,先用50 μmol/L PD98059预处理15 min。
2.2 细胞凋亡检测 采用TUNEL试剂盒检测。细胞经PBS冲洗,4℃条件下用4%甲醛固定15 min。PBS冲洗后,加2%Triton(溶于0.1%枸橼酸钠),孵育5 min。TUNEL溶液室温染色1 h,PBS冲洗后直接用含DAPI的封片剂封片。置于荧光显微镜下观察并计算凋亡细胞阳性率。
2.3 Caspase-3、ERK1/2蛋白表达及活性测定采用Western blotting方法。细胞经处理后,用PBS冲洗2遍,冰上裂解(裂解液:20 mmol/L Tris-HCl,0.1 mmol/L Na3VO4,25 mmol/L/L NaF,25 mmol/L β-glycerophosphate,2 mmol/L EDTA,2 mmol/L EGTA,1 mmol/L DTT,1 mmol/L PMSF,2 mg/L aprotinin,2 mg/L leupeptin,pH 7.5)。4℃条件下离心15 min(14000 r/min),取上清并测定蛋白浓度(Bradford法)。取20 μg蛋白上样、跑胶(12%SDS)并转移到硝酸纤维素膜上,1%脱脂奶粉封闭1 h。Caspase-3、p-ERK、Pan-ERK1/2按1∶1000浓度杂交2 h。PBS充分洗膜后,1∶2000稀释的辣根过氧化物酶标记Ⅱ抗室温杂交1 h。PBS洗膜,ECL显色。Western blotting结果定量分析用 NIH ImageJ 1.42软件进行。
3 统计学处理
结 果
1 瘦素对H2O2诱导的H9c2细胞凋亡的影响
瘦素预处理组细胞凋亡率(36.0% ±3.6%)较H2O2单纯处理组(56.0% ±3.6%)显著降低(P<0.05),见图 1。
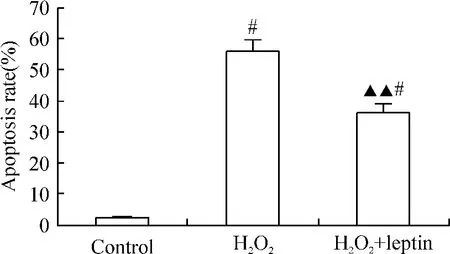
Figure 1.The effect of leptin on H2O2-induced apoptosis in H9c2 cells..n=3.▲▲P<0.01 vs H2O2group;#P <0.05 vs control.图1 瘦素对H2O2诱导的H9c2细胞凋亡的影响的TUNEL染色分析
2 瘦素对caspase-3活性的影响
H2O2处理6 h,caspase-3活性明显增加(蛋白裂解增加)。瘦素预处理1 h显著抑制H2O2诱导的caspase-3激活,见图2。以 cleaved caspase-3与T-caspase-3灰度比值作为casepase-3激活的指标进行定量分析。结果显示:H2O2处理组caspase-3活性显著高于对照组(P<0.01);瘦素预处理组caspase-3活性较单纯H2O2处理组显著降低(P<0.01),见图3。

Figure 2.Effects of leptin on caspase-3 activation.图2 瘦素对caspase-3活性的影响

Figure 3.Quantitative analysis of the effect of leptin on caspase-3 activation..n=3.#P<0.05,##P<0.01 vs control;▲▲P <0.01 vs H2O2+leptin group.图3 瘦素对caspase-3活性影响的定量分析
3 瘦素对ERK1/2活性的影响
H2O2处理15 min,可明显抑制 ERK1(上带)及ERK2(下带)的活性(磷酸化);瘦素预处理1 h,明显增加ERK1/2的基础活性并部分阻断H2O2诱导的ERK1/2活性下降,两者对ERK1/2蛋白表达无明显作用,见图4。以p-ERK1/2与 Pan-ERK1/2灰度比值作为ERK激活的指标进行定量分析。结果显示:瘦素处理组ERK活性显著高于对照组(P<0.05);而H2O2处理组ERK活性较对照组显著降低(P<0.01);瘦素预处理组ERK活性较单纯H2O2处理组ERK活性显著升高(P<0.05),见图5。
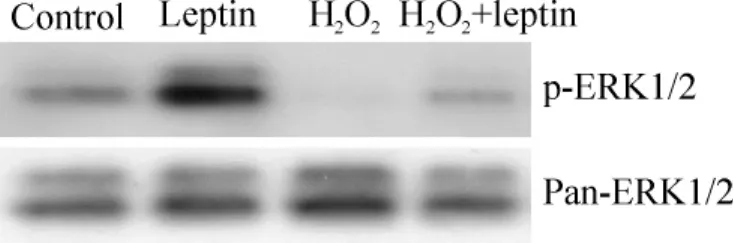
Figure 4.Effects of leptin on ERK1/2 activation.图4 瘦素对ERK1/2活性的影响

Figure 5.Quantitative analysis of the effect of leptin on ERK activation..n=3.#P<0.05,##P<0.01 vs control;▲P<0.05 vs H2O2group.图5 瘦素对caspase-3活性影响的定量分析
4 MEK抑制剂PD98059对瘦素保护作用的影响
PD98059+H2O2组细胞凋亡较单纯H2O2处理组增加(57.2% ±3.2%vs 65.4% ±3.5%),但差异无显著(P>0.05);PD98059+H2O2+瘦素组与PD98059+H2O2组比较,细胞凋亡率差异无显著(60.8% ±4.0%vs 65.4% ±3.5%,P>0.05),见图6。
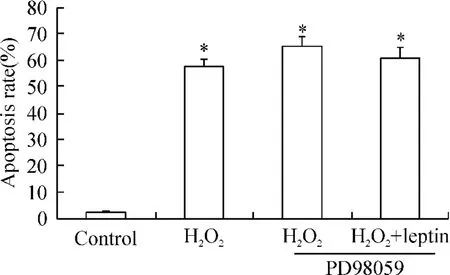
Figure 6.Effect of MEK inhibitor PD98059 on the cytoprotective function of leptin..n=3.*P<0.05 vs control.图6 MEK抑制剂PD98059对瘦素保护作用的影响
讨 论
作为肥胖基因(ob)的产物,瘦素的主要功能是通过与下丘脑的瘦素受体结合,控制进食并增加热量消耗来调节动物体重[1]。近来发现,除了脑组织外,许多外周组织表达瘦素受体,其中心脏是瘦素作用的重要外周靶器官之一[5]。
体内实验发现,无论是缺乏瘦素的ob/ob小鼠还是瘦素受体存在缺陷的 db/db小鼠,两者心肌细胞凋亡较正常小鼠明显增加,而给予ob/ob小鼠补充外源性瘦素则明显降低细胞凋亡率[4],提示瘦素对维持心肌细胞正常生存具有重要作用。在上述研究中,学者还发现ob/ob及db/db小鼠心肌细胞脂肪含量明显增加,提示瘦素防止正常心肌细胞凋亡的机制是通过调节脂肪代谢、防止脂类物质的毒性作用而间接实现的。
自由基是各种诱因导致心肌细胞凋亡的共同机制之一。本文发现,应用 400 μmol/L H2O2处理H9c2细胞6 h,约56%细胞出现凋亡;而应用生理剂量的瘦素预处理1 h,可使凋亡细胞比例显著降低。本研究结果提示瘦素不但通过改善脂代谢防止心肌细胞凋亡的发生,而且还可能对凋亡信号具有直接抑制作用。为了探讨瘦素的对H2O2诱导的心肌细胞凋亡的保护机制,本研究观察了其对细胞外信号调节激酶ERK活性的影响。ERK是丝裂素活化蛋白激酶(mitogen-activated protein kinase)MAPKs的一个亚家族。在哺乳动物体内含有5种ERK,分别是ERK 1-5,最常见的ERK1/2的蛋白苏氨酸及相邻的酪氨酸残基均在一个双重特异性模序中分别由MEK1/2直接磷酸化[6,7]。有研究表明 ERK 对心肌缺血-再灌注导致的细胞损伤具有保护作用[8]。
已知,瘦素与其受体结合可激活ERK,这在多种细胞中已得到证实[2]。本研究发现,H2O2对 ERK活性的抑制作用,这可能是其造成细胞凋亡的机制之一;而瘦素不但直接激活ERK1/2,而且部分降低了H2O2对ERK活性的抑制,提示瘦素对H2O2诱导心肌细胞凋亡的保护作用可能与激活MAPK信号途径有关。为了进一步证实以上结论,本研究观察了ERK激酶MEK抑制剂PD98059对瘦素作用的影响,结果显示瘦素的保护作用可被PD98059所阻断。关于MAPK抑制凋亡的机制,目前还不完全清楚。有研究认为这可能与抑制促凋亡蛋白Bad的功能有关[9,10],详细机制有待进一步探讨。
总之,本研究证实瘦素对自由基造成的心肌细胞凋亡具有抑制作用,其机制可能与激活MAPK信号途径有关,但详细机制尚有待于进一步阐明。值得注意的是,与本文所观察的瘦素的对心肌细胞的直接效应不同,有研究发现瘦素可增加交感神经兴奋性、诱导内皮自由基产生、促进血栓形成等机制,对心肌细胞具有间接的损伤作用[11]。如何有效利用瘦素的心肌保护作用,同时降低其对心肌的间接损害是未来临床工作亟待解决的重要课题。
[1]Ahima RS,Flier JS.Leptin[J].Annu Rev Physiol,2000,62(1):413-417.
[2]Sweeney G.Leptin signaling[J].Cell Signal,2002,14(8):655-663.
[3]陈三妹,王蓉蓉,牛三强,等.糖尿病非酒精性脂肪肝病大鼠肝组织胰岛素受体、瘦素受体 mRNA的表达[J].中国病理生理杂志,2009,25(7):1370 -1375.
[4]Barouch LA,Gao D,Chen L,et al.Cardiac myocyte apoptosis is associated with increased DNA damage and decreased survival in murine models of obesity[J].Circ Res,2006,98(1):119 -124.
[5]Matsui H,Motooka M,Koike H,et al.Ischemia/reperfusion in rat heart induces leptin and leptin receptor gene expression[J].Life Sci,2007,80(7):672 - 680.
[6]Widmann C,Gibson S,Jarpe MB,et al.Mitogen-acti-vated protein kinase:conservation of a three-kinase module from yeast to human[J].Physiol Rev,1999,79(1):143-180
[7]Pearson G,Robinson F,Gibson TB,et al.Mitogen - activated protein(MAP)kinase pathways:regulation and physiologic functions[J].Endocr Rev,2001,22(2):153-183.
[8]Lips DJ,Bueno OF,Wilkins BJ,et al.MEK1 - ERK2 signaling pathway protects myocardium from ischemic injury in vivo[J].Circulation,2004,109(16):1938 -1941.
[9]Bonni A,Brunet A,West AE,et al.Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and - independent mechanisms[J].Science,1999,286(5443):1358 -1362.
[10]Baines CP,Zhang J,Wang GW,et al.Mitochondrial PKC epsilon and MAPK form signaling modules in the murine heart:enhanced mitochondrial PKC epsilon-MAPK interactions and differential MAPK activation in PKC epsilon - induced cardioprotection[J].Circ Res,2002,90(4):390 -397.
[11]Sweeney G.Cardiovascular effects of leptin[J].Nat Rev Cardiol,2010,7(1):22-29.

