鸭副粘病毒人工感染鸭的病理组织学研究
张训海,王 珏,李升和,龚 争,王 旋,钟登科,胡元庆,张 伟
(家禽疫病防控监测安徽省重点实验室,安徽凤阳233100)
副粘病毒科新增的禽腮腺炎病毒属的代表种新城疫病毒(Newcastle disease virus,NDV)是广泛引起禽类严重致死性传染病-新城疫(ND)的病原[1],在血清型上属禽副粘病毒(Avian paramyxovirus,APMV)血清1型(APMV-1)。NDV在世界上曾引起多次大流行,给养禽业造成巨大损失,至今仍是严重危害养禽业的主要疫病之一。OIE和我国将其与高致病性禽流感一样,均列为I类或A类疫病。
早期研究发现,水禽对副粘病毒NDV具有较强的抵抗力,仅表现为健康带毒,即使强毒感染也不致病[2],极少有自然感染引发大批发病与死亡的报道[3]。但自上世纪末以来,在我国水禽饲养密集和水陆禽混养的地区,先后发现了可引起鹅、鸭高致病性感染与致死的NDV新致病型-鹅副粘病毒病[4-5]和鸭副粘病毒病[6]的流行,并引起了严重的经济损失。尤其是鸭副粘病毒病,除发现之初时的区域性普遍流行外,其后却未见像鹅副粘病毒病那样扩大蔓延与持续流行,而近年仅表现为零星散发的现象。
本研究以本实验室曾首次报道的鸭副粘病毒WF00D株[6]进行家鸭的人工感染,在临诊和肉眼病理学检查的基础上,采集部分组织病料进一步进行显微和亚显微病理组织学检查,旨在为鸭副粘病毒病流行规律的探究及致病机理的深入研究提供依据。
1 材料和方法
1.1 实验材料 鸭副粘病毒(WF00D株)为本室分离鉴定的保存株[6](第4代,HA:28;MDT为48.9 h;ICPI为1.80;IVPI为2.45)。1日龄健康建湖麻鸭购自安徽凤阳县某孵化场。饲料采用大北农4%鸭料精配制的全价日粮。
1.2 人工感染 取隔离饲养至20日龄的健康建湖麻鸭120只,随机均分为对照组和试验组,并分别置于25℃隔离的环境中。试验组鸭按0.5 mL/羽剂量皮下注射1∶5稀释的SPF鸡胚接种复壮的鸭副粘病毒;对照组仅皮下注射0.5 mL/羽灭菌生理盐水。然后按常规进行消毒、饲养与观察,并于接种后的第4 d、8 d、12 d、16 d和第20 d时,每组取鸭4羽迫杀,剖检观察其大体病变。
1.3 组织病理学标本制备与观察 立即解剖取心脏、腺胃、肝脏、小肠、脾脏、胸腺、肺脏、胰腺和腔上囊等器官,Bouin液固定,乙醇脱水,二甲苯透明,石蜡包埋,徕卡切片机切片6 μm,HE染色,OLYMPUS-CH30显微摄影系统显微观察并摄影。
1.4 电镜材料制备与观察 取上述各器官组织,切成约1 mm×1 mm×1 mm大小,2.5%戊二醛固定并修成0.5 mm 3左右的小块,1%锇酸后固定、梯度酒精脱水、环氧树脂Epon812聚合和包埋,LKBV型超薄切片机切片,醋酸铀和柠檬酸铅染色,日本JEM-1200EX透射电镜观察和拍摄。超薄切片的制作与检查,由南京军区总医院病理科完成。
2 结果
2.1 临床和剖检变化 与对照组鸭相比较,试验组鸭在接种后的20 d观察期内,均未出现感染死亡病例,除部分精神稍有沉郁和腹泻等外,其个体发育表现出日益明显的差异,在试验结束时,其体重和大小呈现出显著的不均一性,少数相差达1倍~2倍。试验组鸭的病变总体特征为:腺胃和小肠有轻微的炎性水肿、充血或出血现象;脾脏肿大明显,质地变脆;肝脏肿大呈土黄色;肾脏明显肿大;胸腺、脾脏、肝脏、肾脏、心脏、肺脏等实质性器官都表现为较严重的充血和出血现象。人工感染后各时期的剖检病变详述如下:
接种后第4 d时心脏点状出血、肿大、质地变软,心包积液;脾脏肿大明显;腺胃粘膜脱落、坏死,质地变软;胰腺肿胀、有针尖状出血;气管环有轻度出血;胸腺有针尖状出血;肝脏边缘略变钝,有的呈淡灰色。
接种后第8 d时胸腺点状出血;心包积液,心肌柔软,心房肿大;肝脏土黄色、有出血斑并轻微肿胀;气囊膜浑浊、有纤维样附着物;腺胃分泌物增多、呈粘液样;肾脏肿胀、出血;气管针点状出血;喉头部分泌物增多、为浓稠样。
接种后第12 d时胸腺点状出血;心包积液,心脏出血明显;肺部出血、浆膜增厚;肠粘膜出血;气管点状出血,分泌物增多;肾脏肿大、出血。
接种后第16 d时腹膜出血,气囊有干酪样渗出物;胸腺出血;肝脏肿大。
接种后第20 d时剖检肉眼未见明显病变。
2.2 显微与亚显微病理学变化 与同日龄对照组鸭比较,试验组鸭各组织器官的病理组织学变化如下:心脏:第4 d时心肌出血;8 d~20 d心肌纤维肿胀,心肌纤维断裂,周围可见大量固缩的胞核和红细胞(图 1)。
肺脏:第4 d时呈浆液性肺炎,间质淤血,炎性细胞浸润,并见有三级支气管出血(图2);第8 d时,间质血管充血、出血,呼吸毛细管破裂,炎性细胞浸润;第12 d时充血、淤血更加严重,间质增厚,呼吸毛细管可见红细胞;第16 d~20 d时呼吸毛细管破裂,并有充血和出血现象。

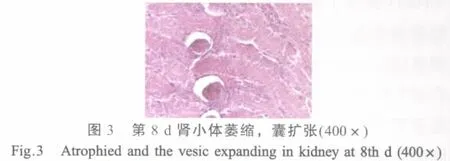
肾脏:第4 d时肾小管上皮细胞颗粒变性,管腔内可见脱落的上皮细胞和炎性细胞,血管球充血;第8 d时肾小管上皮细胞肿胀、颗粒变性,间质水肿,毛细血管扩张;有的血管球萎缩,肾小囊腔增大(图3);第12 d时肾脏间质充血,肾小管上皮细胞肿胀、变性、坏死,血管球内皮细胞肿胀;第16 d~20 d时,间质仍有充血,有的肾小体血管球坏死、崩解,内皮肿胀,肾小囊腔内可见细胞碎片。
脾脏:第4 d时被膜下方可见大量红细胞,红髓充血现象明显(图4),白髓粒细胞浸润;第8 d时淋巴细胞有核固缩现象,椭球周边细胞排列疏松,细胞间有较大空隙呈花形;第12 d时脾小结可见出血现象;第16 d和20 d时脾小结增多、增大,生发中心较为明显。

电镜下,第4 d时肾小管上皮细胞内细胞器轻度变性,部分线粒体呈空泡状(图5)。第8 d时肾小管上皮细胞内空泡状线粒体明显增多,肾小囊壁层细胞肿胀,细胞器变性(图6)。第16 d时肾小管上皮细胞内细胞器严重变性,胞浆局灶性溶解(图7)。

胸腺:第4 d时部分胸腺小体崩解,形成碎片及圆形包囊,或溶解呈空泡状,有的形成坏死灶(图8),第8 d和12 d时胸腺小叶髓质仍有类似病变。第16 d和20 d时病变减轻。

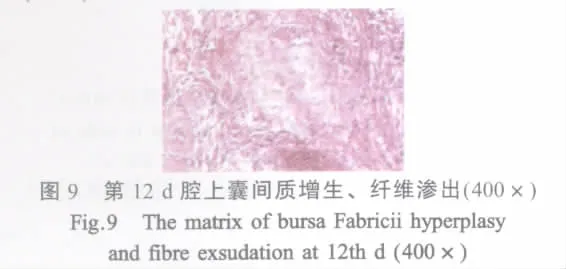
腔上囊:第4 d时腔上囊小结髓质浆液性渗出,有的小结萎缩,淋巴细胞变性坏死,结缔组织增生;第12 d时腔上囊进一步退化,间质增生、纤维渗出(图 9)。
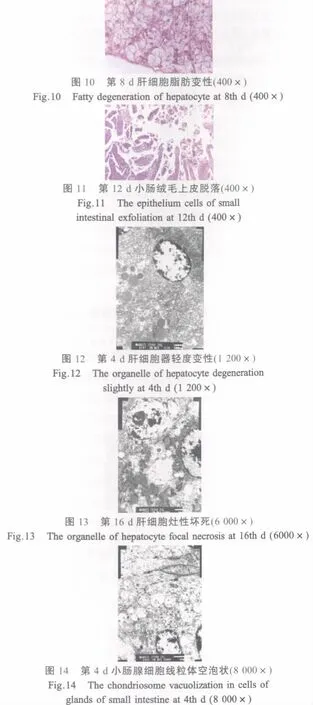
肝脏:第4 d时被膜下部分肝细胞呈空泡状,电镜下细胞器轻度变性(图12),中央静脉扩张,肝血窦扩张、淤血;第8 d~12 d血窦里有大量血细胞,靠近被膜出现坏死灶,肝细胞严重脂肪变性(图10);第16 d~20 d肝细胞肿胀或萎缩,大小不一。第16 d时,电镜下肝细胞严重变性,大量吞噬泡聚集,线粒体空泡化,胞浆局灶性坏死(图13)。
胰腺:第4 d~20 d均可见炎性细胞浸润,腺泡破裂。
腺胃:第4 d时腺集合窦壁内炎性细胞浸润或出血,腺细胞变性、坏死、脱落;第8 d~20 d上皮细胞坏死、脱落,集合窦内有大量脱落的细胞碎片,固有膜水肿,出现坏死灶。
小肠:第4 d时黏膜上皮细胞变性、肿胀,固有膜水肿,有出血现象。电镜下上皮和肠腺的细胞变性、溶解,线粒体空泡化,粗面内质网脱颗粒等现象明显(图14)。第8 d~20 d黏膜上皮细胞间可见炎性细胞浸润,固有膜充血、出血,黏膜上皮坏死、脱落,肠腔内有大量的脱落物(图11)。
3 讨论
本研究在进行鸭副粘病毒病首次鉴定时,将分离毒株(即WF00D株)回归10日龄雏鸭,结果显示,静脉接种、肌注和滴鼻点眼途径的雏鸭,发病率均为100%,而病死率分别100%、75%和50%,从出现发病症状到死亡的时间分别为2 d~5 d、3 d~5 d和4 d~7 d[6]。而用同期分离鉴定的鸡源NDV(MDT为44 h;ICPI为1.74;IVPI为2.39)人工试验感染16日龄的鸭,其发病率均为100%,病死率为0;静注、肌注和滴鼻点眼途径的病程分别为4 d~7 d、5 d~7 d和6 d~8 d[7]。本实验以鸭副粘病毒WF00D株人工感染20日龄建湖麻鸭,除部分感染鸭精神稍有沉郁和个体发育差异显著外,也均未出现感染致死病例,与自然发病鸭群的10%~50%死亡率[6]有一定差异。其原因除鸭品种因素外,可能是家鸭对该鸭副粘病毒病具有明显的日龄抵抗力;同时,感染途径也直接影响了感染的结局。如王宏伟等用企鹅源的新城疫强毒人工感染7日龄和14日龄北京雏鸭,结果只有静脉接种才致雏鸭发病死亡,其致死率分别为100%和50%;而肌注和滴鼻点眼途径均未表现任何异常[8]。此外,由于试验鸭都是在恒温控制的隔离环境下进行全价饲养,基本消除了饲养过程中的多种应激影响,因而也进一步降低了试验鸭群的感染易感性。
本实验结果显示,感染鸭的临床症状不甚明显,剖检变化也较轻微,未出现感染死亡病例,与近年来的鸭副粘病毒病疫情趋于平稳的现象相一致。但感染鸭在消化系统、免疫系统、泌尿系统和呼吸系统却都有明显的病理组织学变化,而且其演变也有一定的规律性:组织病变在接种后的第4 d~16 d逐渐加剧,其中,第16 d时胸腺、腔上囊和脾等免疫器官及消化管病变减轻;第20 d时大部分器官组织病变逐渐开始好转,但肝、肾、肺等器官的病变仍较为严重。因此,通过与对照组相比较,笔者认为,感染病毒对鸭组织器官的这种持续性严重病理损伤,是导致感染鸭群体重和大小产生显著性发育差异的根本原因。由此可见,在现行的开放或半开放生产模式与饲养条件下,由于各种诸如温度、湿度、密度、营养等方面应激因素的综合作用下,鸭副粘病毒病零星散发的自然流行现象也是不难解释的。这种以持续性病理组织学损伤和生长发育障碍为特征的“隐性感染”疫情,已取代高致病性鸭副粘病毒病[6]并成为该病的主要流行表现形式,这一新情况应引起兽医防疫部门的高度重视。
本研究结果和我们先前对鸭副粘病毒感染剖检病理观察的描述[5],进一步充实和丰富了新城疫的病理学研究内容。其与鸡新城疫[2,7]和鹅副粘病毒病[9-11]在剖检病变及病理组织学变化呈现出的差异性,如鸭副粘病毒对各组织器官的侵害程度及病理表现特征等的不同。至于这种差异是否与病毒的变异有关,还是与宿主有关[7,12],有待后续的进一步研究。
[1]洪健,周雪平.ICTV第八次报告的最新病毒分类系统[J].中国病毒学,2006,21(1):84-96.
[2]卡尔尼克(Calnek B.W)主编,高福,苏敬良,主译.禽病学[M].10版,北京:中国农业出版社,1999,691-726.
[3]Higgins D A.Nine disease outbreaks associated with myxoviruses among ducks in HongKong[J].Trop Anim Health Prod,1971,3:232-240.
[4]辛朝安,任涛,罗开健,等.疑似鹅副粘病毒感染诊断初报[J].养禽与禽病防治,1997,1:5.
[5]王永坤,田慧芳,周继宏,等.鹅副粘病毒病的研究[J].江苏农学院学报,1998,19(1):59-62.
[6]张训海,朱鸿飞,陈溥言,等.鸭副粘病毒强毒株的分离和鉴定[J].中国动物检疫,2001,18(10):24-27.
[7]张训海,朱鸿飞,周功强,等.鸡新城疫强毒株的分离及其人工感染试验[J].中国预防兽医学报,2002,24(3):29-32.
[8]王宏伟,郭志儒,丁壮,等.企鹅新城疫强毒人工感染北京雏鸭的研究[J].中国预防兽医学报,2000,22(3):177-179.
[9]万洪全,吴力力,许益民,等.鹅副粘病毒病的病理变化[J].中国兽医学报,2000,20(2):132-134.
[10]张洁,辛朝安,任涛,等.鹅的禽副粘病毒感染的病理学研究[J].动物医学进展,1999,20(3):170-173.
[11]周继红,田慧芳,王永坤,等.鹅副粘病毒的人工感染试验[J].中国预防兽医学报,1999,21(1):51-52.
[12]刘文博,万洪全,吴艳涛,等.鸡新城疫标准强毒感染鹅试验[J].中国家禽,2001,23(19):10-11.

